解题方法
1 . 下列有关实验目的和装置设计合理的是
| 选项 | A | B | C | D |
| 实验装置 |  | 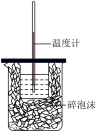 | 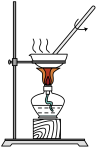 |  |
| 实验目的 | 实验室制备少量CO2 | 中和热的测定 | 蒸干FeSO4溶液制备 FeSO4晶体 | 模拟工业合成氨并检验产物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验验证反应得到的混合气体中含有SO2、H2、H2O

已知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→___ (不可重复使用)。
(3)装置E中的干燥管中盛放的物质为碱石灰,其作用是______ 。
(4)证明有H2存在的实验现象是_________ 。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:

(5)W溶液可以是下列溶液中的______ (填字母代号);
A.H2O2溶液B.NaOH溶液C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为___________ (用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为____ (用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
I.甲同学设计如下实验验证反应得到的混合气体中含有SO2、H2、H2O

已知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→
(3)装置E中的干燥管中盛放的物质为碱石灰,其作用是
(4)证明有H2存在的实验现象是
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:

(5)W溶液可以是下列溶液中的
A.H2O2溶液B.NaOH溶液C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为
您最近一年使用:0次
3 . 下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是


| A.若按①→③→②顺序连接,可检验所有气体产物 |
| B.若装置②只保留a、b,同样可以达到实验目的 |
| C.若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6 |
| D.实验结束后,应按从下往上、从左往右的顺序拆卸装置 |
您最近一年使用:0次
2018-05-26更新
|
522次组卷
|
6卷引用:江西省南昌市四校联盟2020届高三第二次联考理综化学试题
江西省南昌市四校联盟2020届高三第二次联考理综化学试题【全国市级联考】山东省济南市2018届高三5月针对性练习(二模)理综化学试题(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础重庆市2019-2020学年高三下学期网络考试化学试题(已下线)第13讲 硫及其化合物(精讲)-2022年一轮复习讲练测山东省烟台市2021-2022学年高二下学期期末考试化学试题
名校
解题方法
4 . 高氯酸铵(NH4ClO4)为白色晶体且不稳定,受热易分解产生多种气体。某化学兴趣小组同学利用如图所示装置探究NH4ClO4的分解产物。(假设装置内药品均足量。)
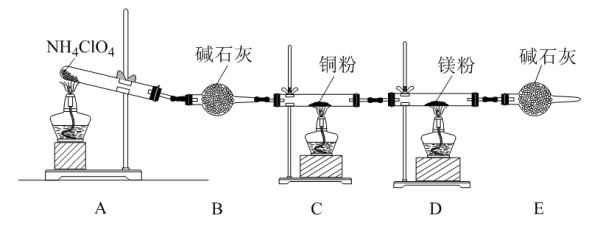
(1)在实验过程中发现_______ ,说明产物中有氧气生成。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,该气体化学式为_______ ,则原来D中发生反应的化学方程式为_______ 。
(3)为了证明H2O和Cl2的存在,用下图提供的装置进行实验(不重复使用):
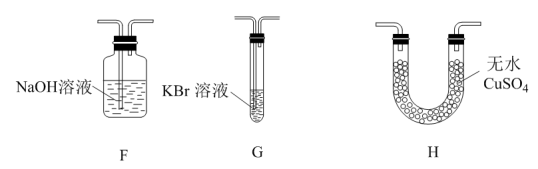
①按气流从左至右,装置的连接顺序为A→_______ ;实验过程中H中的现象为__________ 。
②写出F中发生反应的离子方程式:_______ 。
(4)NH4ClO4分解时产生了,上述几种物质,则高氯酸铵分解的化学方程式为_______ 。

(1)在实验过程中发现
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,该气体化学式为
(3)为了证明H2O和Cl2的存在,用下图提供的装置进行实验(不重复使用):

①按气流从左至右,装置的连接顺序为A→
②写出F中发生反应的离子方程式:
(4)NH4ClO4分解时产生了,上述几种物质,则高氯酸铵分解的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 某小组同学按如图所示装置,将气体SO2(可能混有CO2)从a端通入,则:
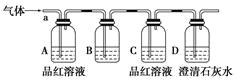
(1) B中应该装下列______ 试剂(填字母)。
A.氯化钠溶液 B.酸性高锰酸钾溶液
C.盐酸 D.澄清石灰水
(2) A中品红溶液的作用是_____________ 。
(3) D中澄清石灰水的作用是___________ 。
(4) 通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
由上述现象该小组同学确认该气体的成分为___________________________ 。

(1) B中应该装下列
A.氯化钠溶液 B.酸性高锰酸钾溶液
C.盐酸 D.澄清石灰水
(2) A中品红溶液的作用是
(3) D中澄清石灰水的作用是
(4) 通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
由上述现象该小组同学确认该气体的成分为
您最近一年使用:0次
2021-05-23更新
|
110次组卷
|
2卷引用:江西省赣州市赣县第三中学2023届高三上学期月考强化训练(B8)化学试题
6 . 莫尔盐也叫硫酸亚铁铵,是一种重要的化工原料,可作净水剂。在不同温度下其分解产物不同,如图为500℃时隔绝空气加热,探究其分解生成的气体产物的装置。下列说法不正确的是
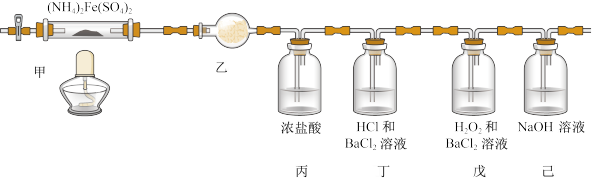

| A.乙装置的干燥管盛装无水硫酸铜检验分解产物中可能含有的水 |
| B.丙中浓盐酸检验可能的分解产物NH3,浓盐酸可用浓硝酸代替 |
| C.若分解产物有SO2,无SO3,则丁装置中无现象,戊装置中有白色沉淀生成 |
| D.己装置吸收实验尾气,防止酸性气体对环境造成污染 |
您最近一年使用:0次
2021-05-11更新
|
1806次组卷
|
4卷引用:江西师范大学附属中学2020-2021学年高一下学期4月月考化学试题
名校
7 . 碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是____ 和_____ ;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是_____ 。
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。____ 中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2_____ ;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是____ g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;_____ (填“合理”“不合理”),理由是_____ 。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。
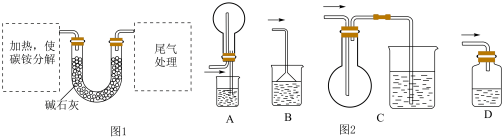
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;
您最近一年使用:0次
2019-10-18更新
|
132次组卷
|
5卷引用:江西省上饶市横峰中学2021届高三上学期第一次月考化学试题
8 . 硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。
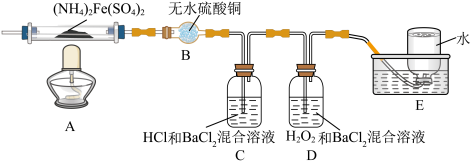
(1)B装置的作用是_________ 。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______ 气体产生,写出D中发生反应的离子方程式________ 。
(3)A中固体分解后产生NH3,写出其两种用途_________ 。
(4)用实验的方法验证C溶液含有NH4+:_________ 。

(1)B装置的作用是
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有
(3)A中固体分解后产生NH3,写出其两种用途
(4)用实验的方法验证C溶液含有NH4+:
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
|
名校
解题方法
9 . 硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)B装置的作用是__________ 。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有______ 气体产生,写出D中发生反应的离子方程式__________ 。若去掉C,是否能得出同样结论并解释其原因_____________ 。
(3)A中固体完全分解后变为红宗色粉末,某同学设计实验验证固体残留物仅为Fe2O3.而不含FeO。请完成表内容。(试剂,仅然和用品自选)
(4)E中收集到的气体只有N2,其物质的量为xmol,固体残留物刚体死目物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,根据氧化还原反应的基本规律,x、y和z应满足的关系为________ 。
(5)结合上述实验现象和相关数据的分析。写出硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式:_____________ 。

(1)B装置的作用是
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有
(3)A中固体完全分解后变为红宗色粉末,某同学设计实验验证固体残留物仅为Fe2O3.而不含FeO。请完成表内容。(试剂,仅然和用品自选)
| 实验步骤 | 预期现象 | 结论 |
| 取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解: | 固体残留物仅为Fe2O3 |
(5)结合上述实验现象和相关数据的分析。写出硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式:
您最近一年使用:0次
2017-06-05更新
|
1092次组卷
|
3卷引用:江西省师范大学附属中学2017届高三第三次模拟考试理综化学试题
18-19高三上·江西南昌·阶段练习
解题方法
10 . 醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
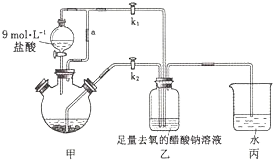
①检查装置气密性后,往三颈瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭k2。打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76g[Cr(CH3COO)2]2·2H2O.
(1)三颈瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为___ .
(2)实现步骤③中溶液自动转移至装置乙中的实验操作为___ .
(3)装置丙中导管口水封的目的是___ .
(4)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是___ (填标号).
A.乙醚 B.去氧冷的蒸馏水 C.无水乙醇
(5)若实验所取用的CrCl3溶液中含溶质3.17g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是___ ,
(6)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在.___ .

①检查装置气密性后,往三颈瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭k2。打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76g[Cr(CH3COO)2]2·2H2O.
(1)三颈瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为
(2)实现步骤③中溶液自动转移至装置乙中的实验操作为
(3)装置丙中导管口水封的目的是
(4)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是
A.乙醚 B.去氧冷的蒸馏水 C.无水乙醇
(5)若实验所取用的CrCl3溶液中含溶质3.17g,则[Cr(CH3COO)2]2·2H2O(相对分子质量为376)的产率是
(6)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在.
您最近一年使用:0次



