解题方法
1 . 某小组探究Na2CO3和NaHCO3的性质。
(1)探究溶解性。在两支试管中,分别加入约1g Na2CO3和NaHCO3固体,分别加入5mL水,充分振荡后,一支试管中固体有剩余,剩余的固体是______ 。
(2)探究稳定性。按照如图所示装置进行实验(部分夹持装置已略去)。
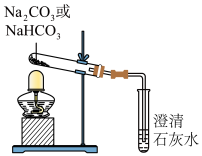
①能够证明Na2CO3的热稳定性强于NaHCO3的证据是______ 。
②NaHCO3受热分解的化学方程式是______ 。
(3)探究与酸的反应。
(4)该小组在探究Na2CO3和NaHCO3的性质时,运用的化学思想方法有______ (填序号)。
a.比较 b.定性与定量相结合
(1)探究溶解性。在两支试管中,分别加入约1g Na2CO3和NaHCO3固体,分别加入5mL水,充分振荡后,一支试管中固体有剩余,剩余的固体是
(2)探究稳定性。按照如图所示装置进行实验(部分夹持装置已略去)。

①能够证明Na2CO3的热稳定性强于NaHCO3的证据是
②NaHCO3受热分解的化学方程式是
(3)探究与酸的反应。
实验步骤 | 实现现象 | 用离子方程式解释现象 |
向盛有Na2CO3溶液的试管中滴加稀盐酸 | 开始无气泡产生,一段时间后产生气泡 | ① ② |
向盛有NaHCO3溶液的试管中滴加稀盐酸 | 立即产生气泡 |
(4)该小组在探究Na2CO3和NaHCO3的性质时,运用的化学思想方法有
a.比较 b.定性与定量相结合
您最近一年使用:0次
名校
解题方法
2 . FeSO4·7H2O 广泛用于医药和工业领域。下面是以工业废铁屑为原料生产FeSO4·7H2O 的流程图。

(1)加适量碳酸钠溶液的目的是___________ ,反应Ⅰ需要加热数分钟,其原因是___________ 。
(2)判断反应Ⅱ完成的现象是___________ 。反应Ⅱ需要 100mL1mol/L 的稀硫酸,用 98.3%,ρ=1.84g/cm3 的浓硫酸配制。所用的仪器除量筒、烧杯、玻璃棒外,还需要玻璃仪器___________ 。
(3)测定 FeSO4·7H2O 产品中 Fe2+含量的方法是用 KMnO4溶液滴定法(5Fe2++MnO +8H+= 5Fe3++Mn2++4H2O),步骤为:
+8H+= 5Fe3++Mn2++4H2O),步骤为:
Ⅰ.称取 2.8500g FeSO4·7H2O 产品,配制成 250mL 溶液;
Ⅱ.量取 25.00mL 待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的 0.0100moL/L KMnO4溶液滴定至终点,消耗 KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的现象是___________ ;
②计算上述样品中 FeSO4·7H2O 的质量分数为___________ (用小数表示,保留三位小数);
(4)已知 FeSO4·7H2O 晶体在加热条件下发生如下反应:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。

①仪器的连接顺序为 a___________ 。
②装置 C 中的 X 为___________ ;该装置中冷水的作用是___________ 。

(1)加适量碳酸钠溶液的目的是
(2)判断反应Ⅱ完成的现象是
(3)测定 FeSO4·7H2O 产品中 Fe2+含量的方法是用 KMnO4溶液滴定法(5Fe2++MnO
 +8H+= 5Fe3++Mn2++4H2O),步骤为:
+8H+= 5Fe3++Mn2++4H2O),步骤为:Ⅰ.称取 2.8500g FeSO4·7H2O 产品,配制成 250mL 溶液;
Ⅱ.量取 25.00mL 待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的 0.0100moL/L KMnO4溶液滴定至终点,消耗 KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的现象是
②计算上述样品中 FeSO4·7H2O 的质量分数为
(4)已知 FeSO4·7H2O 晶体在加热条件下发生如下反应:2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
①仪器的连接顺序为 a
②装置 C 中的 X 为
您最近一年使用:0次
3 . 化学兴趣小组课外实验时,取出镁条,发现久置的镁条有一层灰黑色的“外衣”他们把该镁条放入试管中,倒入一定浓度的盐酸,观察到有气泡产生,试管壁发烫。同学们对此气体成分产生了兴趣。
【提出问题】产生的气体是什么?
【查阅资料】i.灰黑色“外衣”中含有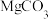
ii.无水 遇水由白色变为蓝色
遇水由白色变为蓝色
【猜想假设】猜想一: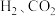
猜想二: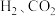 和水蒸气
和水蒸气
猜想三: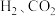 、水蒸气和HCl气体
、水蒸气和HCl气体
(1)猜想三中有HCl气体的理由是___________ 。
【设计实验】为检测产生的气体成分,同学们设计如图所示装置进行实验(部分固定装置略去)
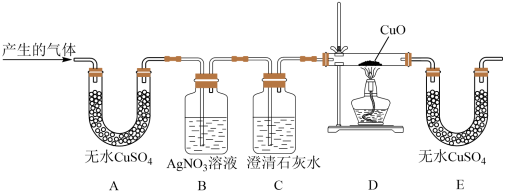
(2)B装置中出现白色沉淀,证明产生的气体中含有___________ ,写出有关的化学方程式___________ 。
(3)C装置的作用是___________ 。
(4)甲同学观察到E装置中无水 由白色变为蓝色,于是得出结论:产生的气体中一定含有H2。乙同学对此提出质疑,理由是
由白色变为蓝色,于是得出结论:产生的气体中一定含有H2。乙同学对此提出质疑,理由是___________ 。
(5)若颠倒B装置和C装置的安装顺序,___________ (填“能”或“不能”)达到实验目的,原因是___________ 。
【反思与评价】
(6)从安全角度考虑,你认为实验时应注意___________ 。
【提出问题】产生的气体是什么?
【查阅资料】i.灰黑色“外衣”中含有
ii.无水
 遇水由白色变为蓝色
遇水由白色变为蓝色【猜想假设】猜想一:
猜想二:
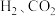 和水蒸气
和水蒸气猜想三:
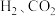 、水蒸气和HCl气体
、水蒸气和HCl气体(1)猜想三中有HCl气体的理由是
【设计实验】为检测产生的气体成分,同学们设计如图所示装置进行实验(部分固定装置略去)

(2)B装置中出现白色沉淀,证明产生的气体中含有
(3)C装置的作用是
(4)甲同学观察到E装置中无水
 由白色变为蓝色,于是得出结论:产生的气体中一定含有H2。乙同学对此提出质疑,理由是
由白色变为蓝色,于是得出结论:产生的气体中一定含有H2。乙同学对此提出质疑,理由是(5)若颠倒B装置和C装置的安装顺序,
【反思与评价】
(6)从安全角度考虑,你认为实验时应注意
您最近一年使用:0次
名校
解题方法
4 . 根据如图所示实验回答问题。

(1)A中,仪器a的名称是___________ ;KMnO4制取O2的化学方程式为___________ ;选择向上排空气法收集氧气的原因是___________ 。
(2)B中,铁丝燃烧生成的黑色固体是___________ 。
(3)C中,能说明木炭在氧气中燃烧的产物为二氧化碳的现象是___________ ;验证产物发生的化学方程式为___________ 。

(1)A中,仪器a的名称是
(2)B中,铁丝燃烧生成的黑色固体是
(3)C中,能说明木炭在氧气中燃烧的产物为二氧化碳的现象是
您最近一年使用:0次
名校
解题方法
5 . 王老师上课做了“木炭在氧气中燃烧”的实验:将点燃的木炭缓缓地伸入集满氧气的集气瓶中,将木炭取出后向集气瓶中倒入少量澄清石灰水后振荡,让大家观察。
请回答下列问题:
(1)老师“缓慢”地将木炭伸入集气瓶的原因是___________
(2)木炭伸入集气瓶中后所观察到的现象是:___________ ,大家根据___________ 现象,可判断木炭燃烧时生成了二氧化碳。
(3)小华看到老师实验时从集气瓶中取出的木炭已经熄灭,猜想实验时生成的气体中还有___________ 气体。下课后,小华将自己的想法说给老师听,在老师的帮助下,小华对集气瓶中的气体作如下探究:

实验中,当观察到___________ 现象,说明小华的猜想是正确的,请写出直玻璃管中发生反应的化学方程式:___________ 。
(4)从对此实验中生成物的分析可知:反应物的浓度对反应有的影响是___________ 。通过检验,集气瓶中还有氧气剩余,请设计实验进行验证___________ 。
请回答下列问题:
(1)老师“缓慢”地将木炭伸入集气瓶的原因是___________
| A.让同学们观察得更清楚 | B.让木炭与氧气充分反应 |
| C.保证实验时的安全 | D.老师的动作都很慢 |
(3)小华看到老师实验时从集气瓶中取出的木炭已经熄灭,猜想实验时生成的气体中还有

实验中,当观察到
(4)从对此实验中生成物的分析可知:反应物的浓度对反应有的影响是
您最近一年使用:0次
解题方法
6 . 氯元素能与许多元素形成种类繁多的化合物,这些含氯化合物在生活及工农业生产中发挥着重要的作用。
(1)从海水中获取粗盐的方法是_______ 。
(2)利用电解饱和食盐水可以制备氢气、氯气、氢氧化钠。电解时阳极产物为_______ ,该产物的检验方法为_______ 。
(3)工业上用氯气和消石灰反应制备漂白粉,其有效成分是_______ (填化学式);写出漂白粉露置在空气中失效过程中所涉及的化学方程式:_______ 、_______ 。
(4)H2与Cl2在点燃条件下可以制取HCl。某同学对HCl性质进行如下预测:
①从物质类别上看,HCl属于酸,其水溶液能与碳酸钙反应,相应的离子方程式为_______ 。
②从化合价角度看,HCl中的Cl元素显-1价,处于氯元素的最低价,因此-1价的Cl元素在反应中可以被_______ (选填“氧化”或“还原”),在一定条件下能与_______ 发生氧化还原反应(填编号)。
a.KI b.NaOH c.KMnO4
(5)已知HClO4是强酸,HClO4在水中的电离方程式为_______ 。
(1)从海水中获取粗盐的方法是
(2)利用电解饱和食盐水可以制备氢气、氯气、氢氧化钠。电解时阳极产物为
(3)工业上用氯气和消石灰反应制备漂白粉,其有效成分是
(4)H2与Cl2在点燃条件下可以制取HCl。某同学对HCl性质进行如下预测:
①从物质类别上看,HCl属于酸,其水溶液能与碳酸钙反应,相应的离子方程式为
②从化合价角度看,HCl中的Cl元素显-1价,处于氯元素的最低价,因此-1价的Cl元素在反应中可以被
a.KI b.NaOH c.KMnO4
(5)已知HClO4是强酸,HClO4在水中的电离方程式为
您最近一年使用:0次
名校
7 . SO2虽是大气污染物之一,但也是重要的工业原料。某同学在实验室设计了如下实验,对SO2的部分性质进行了探究。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是_______ (结合有关平衡方程式简要说明)。
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。
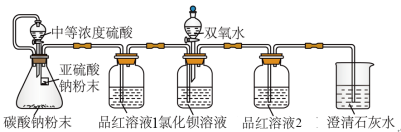
(2)加入碳酸钠粉末的目的是_______ 。
(3)当_______ 时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是_______ 。
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为_______ 。
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若_______ ,说明还原性:SO2>I-,写出该反应的离子方程式:_______ 。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。

(2)加入碳酸钠粉末的目的是
(3)当
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若
您最近一年使用:0次
2022-12-31更新
|
305次组卷
|
2卷引用:广东省梅州市名校2022-2023学年高三上学期期末考试化学试题
解题方法
8 . 某同学欲在实验中利用一氧化碳还原氧化铁反应的实验,实验装置如图甲所示。
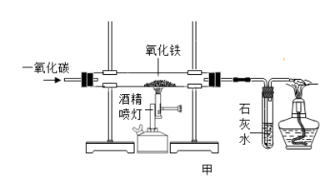
回答下列问题:
(1)硬质玻璃管中实验现象为___________ 发生反应的化学方程式___________
(2)下面是甲装置的基本操作步骤:①点燃酒精喷灯给氧化铁加热;②停止通入一氧化碳。;③熄灭酒精喷灯,继续通一氧化碳直至装置冷却(防止刚生成的铁在高温下又与氧气反应,使实验失败);④先通入一氧化碳一段时间(目的是排尽玻璃管内的空气,防止加热时玻璃管内的一氧化碳与空气的混合气体发生爆炸)正确的排序为:___________
(3)装置中链接澄清石灰水的作用是___________ ;请写出相关的的离子方程式:___________
(4)实验室加热氯化铵和氢氧化钙固体混合物制取氨气(已知:氨气密度比空气小,极易溶于水,与空气不反应),则实验室制取氨气选用的实验装置组合为___________ (填字母)
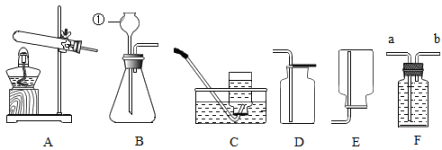
(5)仪器①的名称为___________ 。

回答下列问题:
(1)硬质玻璃管中实验现象为
(2)下面是甲装置的基本操作步骤:①点燃酒精喷灯给氧化铁加热;②停止通入一氧化碳。;③熄灭酒精喷灯,继续通一氧化碳直至装置冷却(防止刚生成的铁在高温下又与氧气反应,使实验失败);④先通入一氧化碳一段时间(目的是排尽玻璃管内的空气,防止加热时玻璃管内的一氧化碳与空气的混合气体发生爆炸)正确的排序为:
(3)装置中链接澄清石灰水的作用是
(4)实验室加热氯化铵和氢氧化钙固体混合物制取氨气(已知:氨气密度比空气小,极易溶于水,与空气不反应),则实验室制取氨气选用的实验装置组合为

(5)仪器①的名称为
您最近一年使用:0次
9 . 人体呼出气体中主要含有氮气、氧气、水蒸气、二氧化碳。为验证人体呼出气体的成分,某兴趣小组利用下面装置进行实验。请回答:
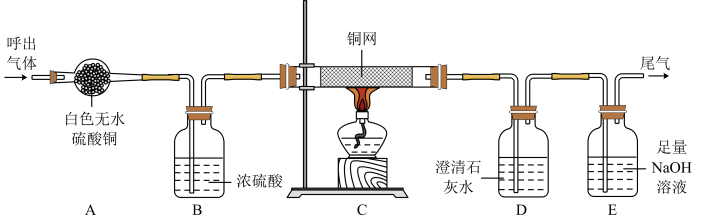
(1)呼出气体通过装置A可观察到_______ ,目的是_______ ;
(2)随反应进行,装置中铜网逐渐变为黑色,其反应的化学方程式为_______ 。
(3)装置D出现白色浑浊,证明呼出的气体中含有_______ 。
(4)E装置的作用是_______ 。

(1)呼出气体通过装置A可观察到
(2)随反应进行,装置中铜网逐渐变为黑色,其反应的化学方程式为
(3)装置D出现白色浑浊,证明呼出的气体中含有
(4)E装置的作用是
您最近一年使用:0次
2022-09-07更新
|
84次组卷
|
2卷引用:山东省临沂市重点中学2022-2023学年高一上学期9月入学考试化学试题
名校
解题方法
10 . 摩尔盐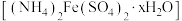 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是___________ 。
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有___________ 。取样品 加热至两次质量恒重为
加热至两次质量恒重为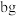 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为___________ (用含a、b的代数式表示)。
(3)利用摩尔盐分解产生的 ,可制取氯化亚砜
,可制取氯化亚砜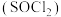 :
: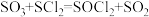 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
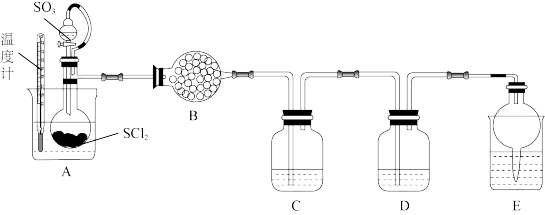
①装置B为无水 ,其作用是
,其作用是___________ 。
②装置C和装置D中的试剂分别是___________ 、___________ (填小写字母)。
a. 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液
(4)利用摩尔盐分解产生的 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
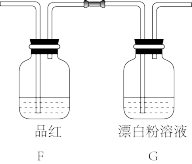
①将少量 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是___________ (用化学反应方程式表示)。
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是___________ ,其作用是___________ ,通过___________ (填现象)即可证明亚硫酸的酸性强于次氯酸。
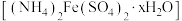 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有
 加热至两次质量恒重为
加热至两次质量恒重为 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为(3)利用摩尔盐分解产生的
 ,可制取氯化亚砜
,可制取氯化亚砜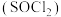 :
: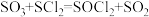 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
①装置B为无水
 ,其作用是
,其作用是②装置C和装置D中的试剂分别是
a.
 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液(4)利用摩尔盐分解产生的
 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
①将少量
 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是
您最近一年使用:0次
2022-07-15更新
|
303次组卷
|
2卷引用:河南省开封市五县2021-2022学年高二下学期期末考试化学试题



