名校
解题方法
1 . 连四硫酸钠( )是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为:
)是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为: ,按如下装置制备足量
,按如下装置制备足量 并探究其性质。下列表述不正确的是
并探究其性质。下列表述不正确的是
 )是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为:
)是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为: ,按如下装置制备足量
,按如下装置制备足量 并探究其性质。下列表述不正确的是
并探究其性质。下列表述不正确的是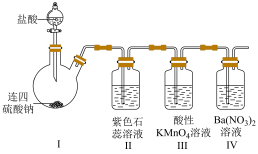
| A.Ⅱ中溶液由紫色变成红色 |
B.Ⅲ中溶液褪色说明 有还原性 有还原性 |
| C.Ⅳ中溶液无明显变化 |
| D.基于环保,本实验应连接尾气处理装置 |
您最近一年使用:0次
2024-03-15更新
|
865次组卷
|
5卷引用:安徽省亳州市第二完全中学2023-2024学年高一下学期3月第一次月考化学试题
2 . 某化学兴趣小组对教材中乙醇性质及产物检验的实验进行了改进和创新,其改进后的实验装置如图所示,按图组装好仪器,装好试剂。
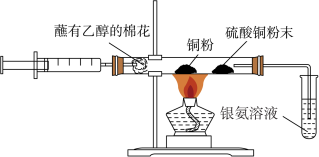
下列叙述正确的是

下列叙述正确的是
| A.因乙醇具有氧化性,所以医疗上常用75%(体积分数)的乙醇溶液作消毒液 |
| B.点燃酒精灯,轻轻推动注射器活塞即可实现乙醇的催化氧化及部分产物的检验 |
| C.可用酸性高锰酸钾溶液来鉴别乙烯、乙醇 |
| D.实验中铜粉和硫酸铜粉末颜色的变化,说明乙醇发生了还原反应 |
您最近一年使用:0次
2023-07-08更新
|
222次组卷
|
3卷引用:安徽省宿州市省、市示范高中2022--2023学年高一下学期期末考试化学试题
3 . 某化学兴趣小组同学做了探究Cl2与Na2SO3溶液反应,实验装置如下。
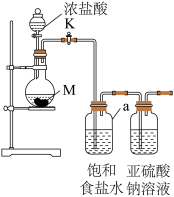
(1)装置中仪器a的名称是___________ ,饱和食盐水的作用是___________ ,发生装置的气密性检查操作方法是___________ 。
(2)试剂M是___________ (填名称)。写出制取氯气的化学方程式___________ 。
(3)该装置的不足之处___________ 。
(4)Cl2与Na2SO3溶液反应的离子方程式为___________ 。
(5)设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化___________ 。

(1)装置中仪器a的名称是
(2)试剂M是
(3)该装置的不足之处
(4)Cl2与Na2SO3溶液反应的离子方程式为
(5)设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化
您最近一年使用:0次
解题方法
4 . 某化学小组设计了如图装置用于制取 并验证其性质。
并验证其性质。
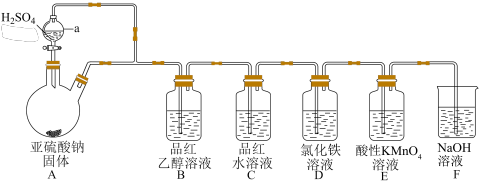
(1)仪器a的名称为___________ ,仪器a连接的导管的作用是___________ 。
(2)装置A中反应的化学方程式为___________ 。
(3)若装置B中无明显现象,装置C中溶液红色褪色,则使品红的水溶液褪色的含硫微粒可能是___________ (填化学式)。
(4)装置D中溶液颜色由黄色变为浅绿色,发生反应的离子方程式为___________ 。
(5)装置E中盛有100 mL 0.100 mol/L的酸性 溶液,当
溶液,当 完全反应时,参加反应的
完全反应时,参加反应的 的质量为
的质量为___________ g。
(6)装置F的作用是___________ 。
 并验证其性质。
并验证其性质。
(1)仪器a的名称为
(2)装置A中反应的化学方程式为
(3)若装置B中无明显现象,装置C中溶液红色褪色,则使品红的水溶液褪色的含硫微粒可能是
(4)装置D中溶液颜色由黄色变为浅绿色,发生反应的离子方程式为
(5)装置E中盛有100 mL 0.100 mol/L的酸性
 溶液,当
溶液,当 完全反应时,参加反应的
完全反应时,参加反应的 的质量为
的质量为(6)装置F的作用是
您最近一年使用:0次
5 . 如图为实验室制取乙炔并验证其性质的装置图。下列说法错误的是
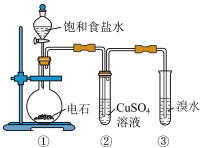

A.①中反应方程式为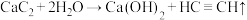 |
| B.②中溶液里会有黑色沉淀生成 |
| C.反应结束时,③中液体出现分层现象 |
| D.实验时可用长颈漏斗代替分液漏斗 |
您最近一年使用:0次
名校
解题方法
6 . 硫和氮及其化合物性质具有多样性。回答下列问题:
(1) 固体在高温下易发生分解(
固体在高温下易发生分解(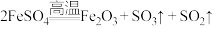 ),利用下图装置来检验分解的气态产物:
),利用下图装置来检验分解的气态产物:_______ 、_______ ,确认分解产物中存在 、
、 的现象分别为
的现象分别为_______ 、_______ 。
②装置C为尾气吸收装置,若其中盛放酸性 溶液,则反应的离子方程式为
溶液,则反应的离子方程式为_______ 。
(2)氨基钠可以用于生产 ——安全气囊气体发生剂,实验小组用下图装置来制备少量的氨基钠,已知:
——安全气囊气体发生剂,实验小组用下图装置来制备少量的氨基钠,已知: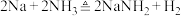 ,氨基钠极易与水剧烈反应,且易被空气氧化。
,氨基钠极易与水剧烈反应,且易被空气氧化。_______ 装置(填装置的标号)和_______ (填试剂标号)来制备氨气。
A.氯化铵固体 B.浓氨水和生石灰 C.氯化铵溶液与钠
②b装置中药品可选_______ (填选项字母)。
A.浓硫酸 B.无水氯化钙 C.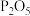 D.碱石灰
D.碱石灰
③氨基钠与水反应的化学方程式为_______ 。
④下列关于制备氨基钠实验方案正确的是_______ (填选项字母)。
A.实验开始时,为使氨气充分反应先点燃c处酒精灯,再通入氨气
B.d为尾气吸收装置,导管不伸入液面是为了防止倒吸
C.该实验方案存在缺陷,应在e、d之间再增加一个b装置或用装有无水氯化钙的干燥管替换d装置
(1)
 固体在高温下易发生分解(
固体在高温下易发生分解( ),利用下图装置来检验分解的气态产物:
),利用下图装置来检验分解的气态产物: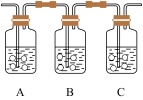
 、
、 的现象分别为
的现象分别为②装置C为尾气吸收装置,若其中盛放酸性
 溶液,则反应的离子方程式为
溶液,则反应的离子方程式为(2)氨基钠可以用于生产
 ——安全气囊气体发生剂,实验小组用下图装置来制备少量的氨基钠,已知:
——安全气囊气体发生剂,实验小组用下图装置来制备少量的氨基钠,已知: ,氨基钠极易与水剧烈反应,且易被空气氧化。
,氨基钠极易与水剧烈反应,且易被空气氧化。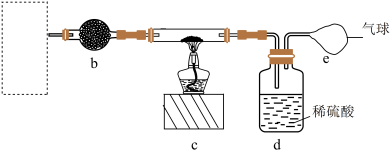
|
|
|
| f | g | h |
②b装置中药品可选
A.浓硫酸 B.无水氯化钙 C.
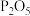 D.碱石灰
D.碱石灰③氨基钠与水反应的化学方程式为
④下列关于制备氨基钠实验方案正确的是
A.实验开始时,为使氨气充分反应先点燃c处酒精灯,再通入氨气
B.d为尾气吸收装置,导管不伸入液面是为了防止倒吸
C.该实验方案存在缺陷,应在e、d之间再增加一个b装置或用装有无水氯化钙的干燥管替换d装置
您最近一年使用:0次
2023-04-16更新
|
261次组卷
|
2卷引用:安徽师范大学附属中学2022-2023学年高一下学期4月期中考试化学试题
解题方法
7 . 卤族元素的单质及其化合物有重要的用途。实验室用以下装置制取氯气,并探究相关物质的化学性质。
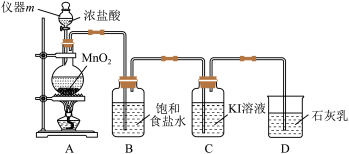
(1)仪器m的名称是___________ ,制取 的离子方程式为
的离子方程式为___________ ,HCl的下列性质中,由氯元素表现出来的性质是___________ 。
a.酸性 b.氧化性 c.还原性 d.挥发性
(2)装置B的作用是除去混在 中的
中的___________ 杂质。
(3)尾气处理装置D可模拟制备___________ (填一种化工产品的名称)。
(4)①实验开始后,装置C中的溶液迅速出现棕色。此时,若生成 物质的量为
物质的量为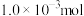 ,则理论上装置A中发生反应的HCl有
,则理论上装置A中发生反应的HCl有___________ mol。
②继续通气一段时间,装置C溶液先变深棕褐色,后变浅,当褪至无色时立即结束实验。据文献报道,碘元素生成碘酸( ,中强酸),
,中强酸), 和
和 在溶液中反应生成碘酸的化学方程式为:
在溶液中反应生成碘酸的化学方程式为:___________ 。某小组设计实验探究碘酸的一种化学性质,请补全实验方案(见如表)。
限选试剂: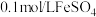 溶液(浸有铁粉)、
溶液(浸有铁粉)、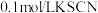 溶液、石蕊试液、
溶液、石蕊试液、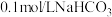 ;溶液、
;溶液、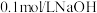 溶液。
溶液。

(1)仪器m的名称是
 的离子方程式为
的离子方程式为a.酸性 b.氧化性 c.还原性 d.挥发性
(2)装置B的作用是除去混在
 中的
中的(3)尾气处理装置D可模拟制备
(4)①实验开始后,装置C中的溶液迅速出现棕色。此时,若生成
 物质的量为
物质的量为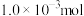 ,则理论上装置A中发生反应的HCl有
,则理论上装置A中发生反应的HCl有②继续通气一段时间,装置C溶液先变深棕褐色,后变浅,当褪至无色时立即结束实验。据文献报道,碘元素生成碘酸(
 ,中强酸),
,中强酸), 和
和 在溶液中反应生成碘酸的化学方程式为:
在溶液中反应生成碘酸的化学方程式为:限选试剂:
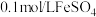 溶液(浸有铁粉)、
溶液(浸有铁粉)、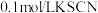 溶液、石蕊试液、
溶液、石蕊试液、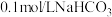 ;溶液、
;溶液、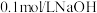 溶液。
溶液。| 操作 | 预期现象 | 结论 |
实验结束后,取少量装置C的溶液到试管中,除去过剩 和HClO后, 和HClO后, |
您最近一年使用:0次
2023-04-11更新
|
231次组卷
|
2卷引用:安徽省安庆市宿松县2022-2023学年高一下学期4月期中考试化学试题
8 . 元素价一类二维图是学习元素化合物知识的重要模型,下图为铁元素的价一类二维图:

请问答下列问题:
(1)炽热的铁水注入模具前,模具必须彻底干燥,是为了避免_______ 反应的发生(写化学方程式)。
(2)高温下利用铝粉与甲反应可用来焊接钢轨。某化学兴趣小组欲用以下装置探究甲与铝粉的反应,实验发现:反应放出大量的热,并发出耀眼的光芒,纸漏斗的下部被烧穿,有熔融物落入沙中。
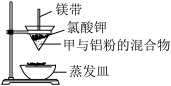
①铝粉与甲反应的化学方程式为_______ 。
②该小组玲玲同学欲探究该熔融物中是否含有+3价铁,进行了如下实验:取出适量的熔融物,加入稀盐酸充分溶解,滴加KSCN溶液,无明显现象,说明熔融物中无+3价铁。芳芳同学不同意此观点,原因为:_______ 。
(3)戊、己分别能与碱反应能生成丙和丁。若己为硫酸盐,向其溶液中加入NaOH溶液时,出现的现象有_______ 。
(4)将表面附有铁锈(主要成分是甲)的铁钉放入稀硫酸中,开始反应时主要离子方程式是_______ ;反应片刻后,向反应后溶液滴加KSCN溶液,溶液未出现红色,其原因为_______ (用离子方程式表示)。
(5)将1.12 g铁粉加入40 mL 2 mol·L 的戊溶液中(戊为氯化物),充分反应后,溶液中
的戊溶液中(戊为氯化物),充分反应后,溶液中 和
和 的物质的量浓度之比为
的物质的量浓度之比为_______ ,标准状况下至少通入_______ mL  才可完全除去溶液中的
才可完全除去溶液中的 。
。

请问答下列问题:
(1)炽热的铁水注入模具前,模具必须彻底干燥,是为了避免
(2)高温下利用铝粉与甲反应可用来焊接钢轨。某化学兴趣小组欲用以下装置探究甲与铝粉的反应,实验发现:反应放出大量的热,并发出耀眼的光芒,纸漏斗的下部被烧穿,有熔融物落入沙中。

①铝粉与甲反应的化学方程式为
②该小组玲玲同学欲探究该熔融物中是否含有+3价铁,进行了如下实验:取出适量的熔融物,加入稀盐酸充分溶解,滴加KSCN溶液,无明显现象,说明熔融物中无+3价铁。芳芳同学不同意此观点,原因为:
(3)戊、己分别能与碱反应能生成丙和丁。若己为硫酸盐,向其溶液中加入NaOH溶液时,出现的现象有
(4)将表面附有铁锈(主要成分是甲)的铁钉放入稀硫酸中,开始反应时主要离子方程式是
(5)将1.12 g铁粉加入40 mL 2 mol·L
 的戊溶液中(戊为氯化物),充分反应后,溶液中
的戊溶液中(戊为氯化物),充分反应后,溶液中 和
和 的物质的量浓度之比为
的物质的量浓度之比为 才可完全除去溶液中的
才可完全除去溶液中的 。
。
您最近一年使用:0次
9 . 利用下列装置探究干燥的Cl2和干燥NH3的能否反应。

(1)B装置发生的反应方程式为_______
(2)D中的药品为_______ (填名称),F中的药品为_______ (填名称)
(3)反应发生后E中产生大量白烟,推测Cl2和NH3的反应方程式为_______
(4)装置的连接顺序为_______ 。a→_______→_______→_______→_______→_______→_______→_______→_______→b

(1)B装置发生的反应方程式为
(2)D中的药品为
(3)反应发生后E中产生大量白烟,推测Cl2和NH3的反应方程式为
(4)装置的连接顺序为
您最近一年使用:0次
2022-11-10更新
|
72次组卷
|
2卷引用:安徽省宣城中学2022-2023学年高二上学期开学考试化学试题
10 . 将下端卷成螺旋状的铜丝插入足量热的浓硫酸中进行如下图所示实验(a~d均为浸有相应试液的棉花)。下列分析正确的是
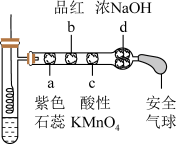
| A.a处现象:先变红后褪色 |
| B.b和c处褪色原理相同 |
| C.铜与浓硫酸反应,硫酸只体现酸性 |
| D.试管底部出现白色固体,体现浓硫酸的吸水性 |
您最近一年使用:0次