名校
解题方法
1 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠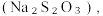 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度: 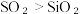 |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
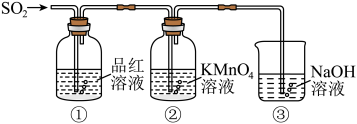
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
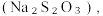 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A.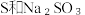 | B. 和浓 和浓 | C. 和 和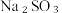 | D.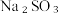 和 和 |
(9)为进一步减少
 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 某化学小组探究硫酸铁铵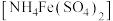 与
与 、
、 的反应。
的反应。
已知: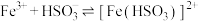 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
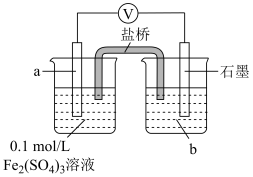
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
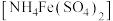 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入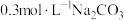 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
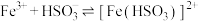 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近一年使用:0次
3 . 某小组为探究 与
与 之间的反应,进行了如下实验。
之间的反应,进行了如下实验。
已知: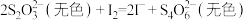 ;
; 为白色沉淀,可吸附
为白色沉淀,可吸附 ;
;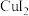 在溶液中不存在;
在溶液中不存在;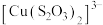 呈无色,
呈无色,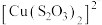 呈黄色。
呈黄色。
下列结论或推断不合理 的是
 与
与 之间的反应,进行了如下实验。
之间的反应,进行了如下实验。实验 |
|
|
现象 | ①产生土黄色沉淀,溶液为棕黄色 ②变为白色悬浊液,最后得到无色澄清溶液 | ①产生土黄色沉淀,溶液为蓝绿色 ②开始变为浅蓝色悬浊液,逐渐变为黄绿色悬浊液,然后变为黄色溶液,最后得到无色溶液 |
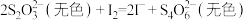 ;
; 为白色沉淀,可吸附
为白色沉淀,可吸附 ;
;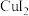 在溶液中不存在;
在溶液中不存在;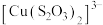 呈无色,
呈无色,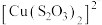 呈黄色。
呈黄色。下列结论或推断
A. 与 与 能发生反应: 能发生反应: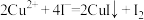 |
B. 与 与 反应的速率快于 反应的速率快于 与 与 反应的速率 反应的速率 |
C.黄绿色悬浊液变为黄色溶液时,有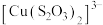 、 、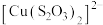 生成 生成 |
D.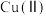 与 与 生成配合物反应的限度小于二者发生氧化还原反应的限度 生成配合物反应的限度小于二者发生氧化还原反应的限度 |
您最近一年使用:0次
名校
解题方法
4 . 下列各组实验中,实验操作、现象及结论或解释均正确的是
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| B | 在干冰中央挖一个小穴,撒一些镁粉,用红热的铁棒把镁引燃,盖上另一块干冰 | 镁粉在干冰中继续燃烧,发出耀眼的白光 | CO2不能扑灭金属镁引起的火灾 |
| C | 向K2S溶液中通入足量的CO2,然后将产生的气体导入CuSO4溶液中 | CuSO4溶液中产生黑色沉淀 | Ka1(H2S)>Ka1(H2CO3) |
| D | 向蔗糖中加入适量浓硫酸,搅拌 | 产生黑色“面包” | 浓硫酸具有酸性和吸水性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 在探究铜与硝酸反应时,发现在室温下,溶液A与铜片立即产生气泡,而相同条件下,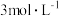 稀硝酸(溶液B)遇铜片短时间内无明显变化,一段时间后才产生气泡。针对这一现象,同学们展开了一系列研究。
稀硝酸(溶液B)遇铜片短时间内无明显变化,一段时间后才产生气泡。针对这一现象,同学们展开了一系列研究。 与浓
与浓 反应的化学方程式为
反应的化学方程式为___________ 。
(2)己知 与浓
与浓 反应后溶液呈绿色的原因是溶液中溶解了生成的气体所致,用化学方程式表示加水稀释过程中溶液变为蓝色的原因
反应后溶液呈绿色的原因是溶液中溶解了生成的气体所致,用化学方程式表示加水稀释过程中溶液变为蓝色的原因___________ 。
(3)查阅资料:
①二氧化氮溶于水的过程产生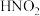 。
。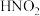 中氮元素的化合价为
中氮元素的化合价为___________ 。
②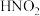 (亚硝酸):无色,易溶于水:不稳定:弱酸,可由亚硝酸盐与强酸反应制得。
(亚硝酸):无色,易溶于水:不稳定:弱酸,可由亚硝酸盐与强酸反应制得。
(4)分析溶液A与铜片立即产生气泡,而相同条件下,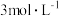 稀硝酸(溶液B)遇铜片短时间内无明显变化的原因,提出假设:
稀硝酸(溶液B)遇铜片短时间内无明显变化的原因,提出假设: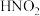 对该反应有催化作用。通过进一步实验确认了这种假设,其实验操作和现象是:向放有铜片的B溶液中
对该反应有催化作用。通过进一步实验确认了这种假设,其实验操作和现象是:向放有铜片的B溶液中___________ 。
(5)催化剂能够加快化学反应速率的原因是:改变反应历程,先参加反应,后又生成,所以反应前后催化剂的量和性质不发生改变。由此同学们推测 与稀硝酸反应中
与稀硝酸反应中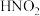 起催化作用的过程如下:
起催化作用的过程如下:
i.___________ (用离子方程式表示)
ii.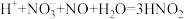
(6)同学们进一步查阅文献资料显示,工业生产硝酸时,会生成亚硝酸等物质。亚硝酸能分解为 (易分解为
(易分解为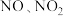 )等物质。要充分考虑到这些变化而采取必要的措施,可提高硝酸的产率,该措施是
)等物质。要充分考虑到这些变化而采取必要的措施,可提高硝酸的产率,该措施是___________ 。
 稀硝酸(溶液B)遇铜片短时间内无明显变化,一段时间后才产生气泡。针对这一现象,同学们展开了一系列研究。
稀硝酸(溶液B)遇铜片短时间内无明显变化,一段时间后才产生气泡。针对这一现象,同学们展开了一系列研究。
 与浓
与浓 反应的化学方程式为
反应的化学方程式为(2)己知
 与浓
与浓 反应后溶液呈绿色的原因是溶液中溶解了生成的气体所致,用化学方程式表示加水稀释过程中溶液变为蓝色的原因
反应后溶液呈绿色的原因是溶液中溶解了生成的气体所致,用化学方程式表示加水稀释过程中溶液变为蓝色的原因(3)查阅资料:
①二氧化氮溶于水的过程产生
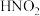 。
。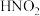 中氮元素的化合价为
中氮元素的化合价为②
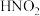 (亚硝酸):无色,易溶于水:不稳定:弱酸,可由亚硝酸盐与强酸反应制得。
(亚硝酸):无色,易溶于水:不稳定:弱酸,可由亚硝酸盐与强酸反应制得。(4)分析溶液A与铜片立即产生气泡,而相同条件下,
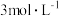 稀硝酸(溶液B)遇铜片短时间内无明显变化的原因,提出假设:
稀硝酸(溶液B)遇铜片短时间内无明显变化的原因,提出假设: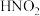 对该反应有催化作用。通过进一步实验确认了这种假设,其实验操作和现象是:向放有铜片的B溶液中
对该反应有催化作用。通过进一步实验确认了这种假设,其实验操作和现象是:向放有铜片的B溶液中(5)催化剂能够加快化学反应速率的原因是:改变反应历程,先参加反应,后又生成,所以反应前后催化剂的量和性质不发生改变。由此同学们推测
 与稀硝酸反应中
与稀硝酸反应中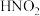 起催化作用的过程如下:
起催化作用的过程如下:i.
ii.
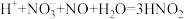
(6)同学们进一步查阅文献资料显示,工业生产硝酸时,会生成亚硝酸等物质。亚硝酸能分解为
 (易分解为
(易分解为 )等物质。要充分考虑到这些变化而采取必要的措施,可提高硝酸的产率,该措施是
)等物质。要充分考虑到这些变化而采取必要的措施,可提高硝酸的产率,该措施是
您最近一年使用:0次
解题方法
6 . 下列关于实验的描述说法错误的是

A.图1:验证 的漂白性 的漂白性 |
| B.图2:做钠在氯气中燃烧性质实验时,先将盛有氯气的集气瓶倒扣在钠块上,后加热 |
| C.图3:用碱石灰和无水醋酸钠固体制取甲烷 |
| D.图4:配制银氨溶液要振荡试管,进行银镜实验时不能振荡试管 |
您最近一年使用:0次
7 . 本实验将氨的制备与性质探究及尾气处理综合在一起进行一体化创新设计,实验使用氢氧化钠固体与浓氨水在常温下反应快速制备少量氨,省时高效。
(1)图中装置用到的玻璃实验仪器有______________ (填字母)。
a.具支试管 b.干燥管 c.试管架 d.烧瓶 e.烧杯 f.铁架台 g.橡胶塞
(2)①本实验改进了氨极易溶于水的喷泉实验,运用自制紫甘蓝溶液替代常规的水加无色酚酞溶液,使喷泉的颜色由_______________ 色变得绚丽多彩。
表1紫甘蓝指示剂变色范围
②本实验将氨的尾气吸收试剂(常规的吸收试剂为水或稀硫酸)改为水与无水乙醇以体积比1:1混合而成的乙醇溶液,其作用为___________________ 。
(3)实验步骤及现象分析
①检查装置气密性。如图所示连接好装置,打开开关__________________ (填“1”或“2”,下同),关闭开关__________________ ,使整个装置密闭。记录小注射器活塞的初始位置,缓慢向下拉大注射器活塞一段距离,松开大注射器活塞,观察,若大、小注射器活塞均回到原来的位置,则说明装置气密性良好。
②装入试剂,准备实验。本实验增设了氨与氯气的反应实验,增设实验中另选装置用高锰酸钾固体与浓盐酸在常温下反应快速制备氯气,写出该反应的离子方程式:__________________ 。
Ⅱ.探究氨气的还原性
已知:Cu2O为红色固体,在酸性溶液中不稳定: 。
。
(4)用装置A制备氨气,仪器接口的连接顺序为_________________ ,装置B的作用为_________________ ,实验开始前应先通一段时间的N2,其目的是_________________ 。_________________ 。

(1)图中装置用到的玻璃实验仪器有
a.具支试管 b.干燥管 c.试管架 d.烧瓶 e.烧杯 f.铁架台 g.橡胶塞
(2)①本实验改进了氨极易溶于水的喷泉实验,运用自制紫甘蓝溶液替代常规的水加无色酚酞溶液,使喷泉的颜色由
表1紫甘蓝指示剂变色范围
| pH | 1 | 2~3 | 4~6 | 7~9 | 10 | 11 | 12~14 |
| 紫甘蓝溶液颜色变化 | 深红 | 紫红 | 浅紫 | 蓝 | 青 | 绿 | 黄 |
(3)实验步骤及现象分析
①检查装置气密性。如图所示连接好装置,打开开关
②装入试剂,准备实验。本实验增设了氨与氯气的反应实验,增设实验中另选装置用高锰酸钾固体与浓盐酸在常温下反应快速制备氯气,写出该反应的离子方程式:
Ⅱ.探究氨气的还原性
已知:Cu2O为红色固体,在酸性溶液中不稳定:
 。
。(4)用装置A制备氨气,仪器接口的连接顺序为
A. 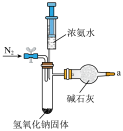 B.
B.  C.
C.  D.
D. 
您最近一年使用:0次
8 . 按照下图进行铜与浓硫酸反应的探究实验,下列说法正确的是
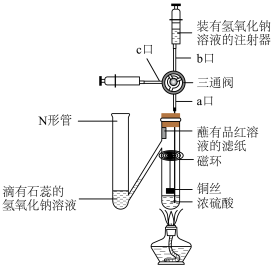
A.蘸有品红溶液的滤纸褪色,说明 具有强氧化性 具有强氧化性 |
| B.N形管溶液变为红色,说明有酸性气体进入N形管 |
| C.反应后,从c口抽取反应液加到足量的氨水中最终产生蓝色沉淀 |
| D.实验结束后从b口注入足量NaOH溶液,会有2种物质与NaOH反应 |
您最近一年使用:0次
解题方法
9 . 某小组同学为探究FeSO4的性质设计了如下实验。
Ⅰ.新配制0.1 mol·L−1 FeSO4溶液450 mL:
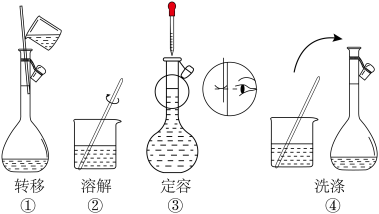
(1)配制0.1 mol·L−1 FeSO4溶液450 mL,需用托盘天平准确称取绿矾(FeSO4·7H2O)
_______ g,其部分实验操作示意图如下,正确的步骤顺序为_______ (填序号)。
Ⅱ.取2 mL新配制的FeSO4溶液,按下图进行实验并观察到如下现象:
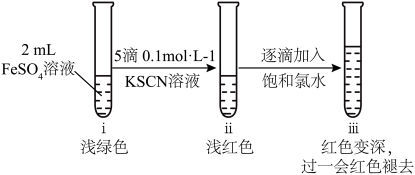
(2)ⅱ中溶液呈浅红色,说明FeSO4溶液中存在_______ (填离子符号)。
(3)ⅲ中溶液红色变深的主要原因是_______ (用离子方程式表示)。
Ⅲ.探究ⅲ中“红色褪去”的原因:
查阅资料:SCN−具有还原性,能被氯气氧化为(SCN)2。
根据查阅资料,甲、乙两位同学提出了如下猜想:
(4)乙同学的猜想是_______ 。为验证甲、乙两位同学的猜想,设计如下实验:将褪色后的溶液分为两等份,一份滴加KSCN溶液,呈血红色;另一份加入氯化铁溶液,无明显现象,则_______ 同学猜想是正确的。
Ⅳ.丙和丁同学探究无水FeSO4在450 ℃、不同氛围中的分解产物:
① 丙同学在450 ℃、空气氛围中加热15.2 g FeSO4,直至固体质量不变,得到纯净的红棕色固体m g,产生的气体通入品红溶液,无明显变化,通入氯化钡溶液中有白色沉淀生成;
② 丁同学在450 ℃、氮气氛围中加热15.2 g FeSO4,直至固体质量不变,得到纯净的红棕色固体也是m g,产生的气体依次通入氯化钡溶液和品红溶液,氯化钡溶液中有白色沉淀,品红溶液褪色。
(5)则m =_______ g,FeSO4固体在空气氛围中加热时反应的化学方程式为_______ 。
Ⅰ.新配制0.1 mol·L−1 FeSO4溶液450 mL:
(1)配制0.1 mol·L−1 FeSO4溶液450 mL,需用托盘天平准确称取绿矾(FeSO4·7H2O)

Ⅱ.取2 mL新配制的FeSO4溶液,按下图进行实验并观察到如下现象:

(2)ⅱ中溶液呈浅红色,说明FeSO4溶液中存在
(3)ⅲ中溶液红色变深的主要原因是
Ⅲ.探究ⅲ中“红色褪去”的原因:
查阅资料:SCN−具有还原性,能被氯气氧化为(SCN)2。
根据查阅资料,甲、乙两位同学提出了如下猜想:
| 猜想 | |
| 甲 | +3价铁又被还原成+2价铁 |
| 乙 |
(4)乙同学的猜想是
Ⅳ.丙和丁同学探究无水FeSO4在450 ℃、不同氛围中的分解产物:
① 丙同学在450 ℃、空气氛围中加热15.2 g FeSO4,直至固体质量不变,得到纯净的红棕色固体m g,产生的气体通入品红溶液,无明显变化,通入氯化钡溶液中有白色沉淀生成;
② 丁同学在450 ℃、氮气氛围中加热15.2 g FeSO4,直至固体质量不变,得到纯净的红棕色固体也是m g,产生的气体依次通入氯化钡溶液和品红溶液,氯化钡溶液中有白色沉淀,品红溶液褪色。
(5)则m =
您最近一年使用:0次
解题方法
10 .  用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。
 .配制溶液
.配制溶液
(1)配制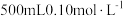 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为___________  。
。
(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有___________ (填标号)。 .实验探究
.实验探究
探究温度对 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。
(3) 溶液显碱性的原因是
溶液显碱性的原因是___________ (用离子方程式表示)。
(4)实验1中测得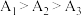 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中___________ 发挥主导作用。实验1中测得 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。
(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料: 溶液中存在平衡:
溶液中存在平衡: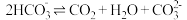 。
。
提出猜想:对于 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。
实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
实验结论:②根据实验1~3的结果,小组同学认为猜想成立,其判断依据是___________ 。
拓展总结:③ 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: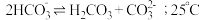 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为___________ [保留两位有效数字;已知: 时,
时,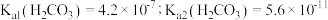 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。
(6)写出 在生产或生活中的一种应用
在生产或生活中的一种应用___________ 。
 用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。 .配制溶液
.配制溶液(1)配制
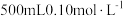 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为 。
。(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有
 .实验探究
.实验探究探究温度对
 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。| 实验序号 | 操作 | 测试温度 |  |
| 1 | 采用水浴加热,将 溶液从 溶液从 持续升温至 持续升温至 ,每隔 ,每隔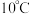 测量并记录溶液 测量并记录溶液 |  |  |
 |  | ||
 |  | ||
 |  | ||
 |  |
 溶液显碱性的原因是
溶液显碱性的原因是(4)实验1中测得
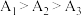 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中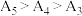 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料:
 溶液中存在平衡:
溶液中存在平衡: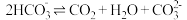 。
。提出猜想:对于
 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
| 实验序号 | 操作 | 测试温度 |  |
| 2 | 采用水浴加热,① ,并记录溶液 ,并记录溶液 |  |  |
| 3 | 采用水浴加热,将 溶液从 溶液从 升温至 升温至 ,然后冷却至 ,然后冷却至 ,并记录溶液 ,并记录溶液 |  |  |
拓展总结:③
 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: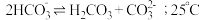 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为 时,
时,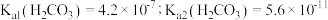 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。(6)写出
 在生产或生活中的一种应用
在生产或生活中的一种应用
您最近一年使用:0次