名校
解题方法
1 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: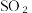 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠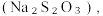 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少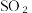 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原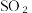 得到单质硫的方法来除去
得到单质硫的方法来除去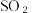 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度: 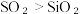 |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

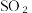 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
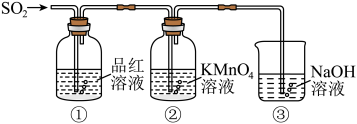
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
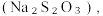 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A.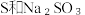 | B.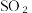 和浓 和浓 | C.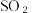 和 和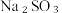 | D.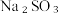 和 和 |
(9)为进一步减少
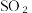 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原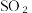 得到单质硫的方法来除去
得到单质硫的方法来除去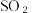 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
2 . 用如图实验装置探究二氧化硫的氧化性。按图充入气体,连接装置,关闭旋塞1和2。___________ 。
2.若A瓶和B瓶的体积相等,恢复到常温,关闭旋塞1,打开旋塞2,可观察到的现象是___________ 。
3.将 气体通入下列装置中,一定不可能产生沉淀的是
气体通入下列装置中,一定不可能产生沉淀的是___________ 。

2.若A瓶和B瓶的体积相等,恢复到常温,关闭旋塞1,打开旋塞2,可观察到的现象是
3.将
 气体通入下列装置中,一定不可能产生沉淀的是
气体通入下列装置中,一定不可能产生沉淀的是
您最近一年使用:0次
3 . 利用 的漂白性检测干白葡萄酒(液体为无色)中的
的漂白性检测干白葡萄酒(液体为无色)中的 或
或 设计如图的实验:
设计如图的实验: 水溶液显酸性,用离子方程式说明
水溶液显酸性,用离子方程式说明___________
2.甲同学得出的实验结论是干白葡萄酒中不含 或
或 这个结论
这个结论___________ (填“成立”或“不成立”),理由是___________ 。
 的漂白性检测干白葡萄酒(液体为无色)中的
的漂白性检测干白葡萄酒(液体为无色)中的 或
或 设计如图的实验:
设计如图的实验: 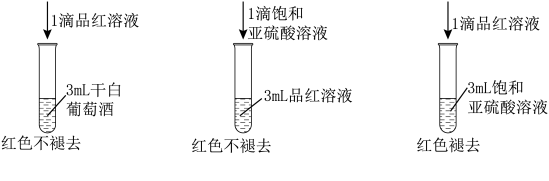
 水溶液显酸性,用离子方程式说明
水溶液显酸性,用离子方程式说明2.甲同学得出的实验结论是干白葡萄酒中不含
 或
或 这个结论
这个结论
您最近一年使用:0次
解题方法
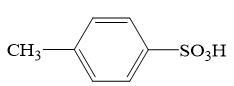
4 . Ⅰ.对甲苯磺酸是一种白色晶体,熔点107℃,易溶于醇、醚和水,是用途广泛的化工原料。
(2)写出反应的化学方程式。___________
Ⅱ.根据对甲苯磺酸的结构,有同学推测对甲苯磺酸的性质和硫酸相似,进行了如下探究:
(3)对甲苯磺酸可能是强酸,电离方程式: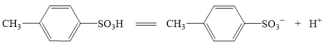 ,设计简单实验证明猜想。
,设计简单实验证明猜想。___________
(4)采用如图所示装置进行实验,观察到蔗糖迅速变黑。上述实验现象说明对甲苯磺酸具有___________ 。
(5)向吸收液中滴加一定量___________ 溶液,仍未观察到明显现象,说明对甲苯磺酸不具有强氧化性。
A.Ba(OH)2 B.NaCl C.CaCl2
Ⅲ.对甲苯磺酸可做酯化反应的催化剂,催化合成丙酸乙酯。
将0.2 mol丙酸(M=74 g∙mol−1)、1 g对甲苯磺酸和0.24 mol乙醇(M=46 g∙mol−1)加入三口瓶中,加热进行反应。反应结束后将反应液过滤,分别经水、碳酸钠溶液、饱和食盐水洗涤,干燥后进行蒸馏,蒸出17.4 g馏分。
(6)计算该反应的产率____ 。(产率= ,写出计算过程,结果保留1位小数)
,写出计算过程,结果保留1位小数)
(7)请评价用对甲苯磺酸代替浓硫酸做酯化反应催化剂的优点___________ 。
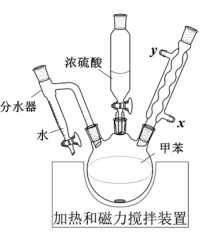
| A.当分水器中的水量不再增加时,停止加热 |
| B.分水器可将反应体系中的甲苯移除 |
| C.烧瓶中不需要添加沸石 |
| D.冷凝水从x口进入 |
Ⅱ.根据对甲苯磺酸的结构,有同学推测对甲苯磺酸的性质和硫酸相似,进行了如下探究:
(3)对甲苯磺酸可能是强酸,电离方程式:
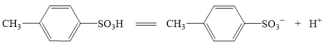 ,设计简单实验证明猜想。
,设计简单实验证明猜想。(4)采用如图所示装置进行实验,观察到蔗糖迅速变黑。上述实验现象说明对甲苯磺酸具有
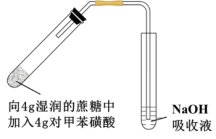
(5)向吸收液中滴加一定量
A.Ba(OH)2 B.NaCl C.CaCl2
Ⅲ.对甲苯磺酸可做酯化反应的催化剂,催化合成丙酸乙酯。
将0.2 mol丙酸(M=74 g∙mol−1)、1 g对甲苯磺酸和0.24 mol乙醇(M=46 g∙mol−1)加入三口瓶中,加热进行反应。反应结束后将反应液过滤,分别经水、碳酸钠溶液、饱和食盐水洗涤,干燥后进行蒸馏,蒸出17.4 g馏分。
(6)计算该反应的产率
 ,写出计算过程,结果保留1位小数)
,写出计算过程,结果保留1位小数)(7)请评价用对甲苯磺酸代替浓硫酸做酯化反应催化剂的优点
您最近一年使用:0次
解题方法
5 . 为探究+1价Ag的氧化性,开展如下活动。
(1)配制溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签
①下列图示中,操作①为_______ 、操作②为_______ 。_______ g固体。
③实验室AgNO3溶液通常盛放在_______ 试剂瓶中。
(2)通过如下实验,比较Ag+、Fe3+、I2的氧化性。
I中产生黑色沉淀,滴加KSCN溶液,变红
II中溶液呈棕黄色,滴加淀粉溶液,变蓝
III中产生黄色沉淀,滴加淀粉溶液,未变蓝
①II中反应的离子方程式为:_______ 。
②I、II中的现象说明:_______ 。
A.氧化性顺序:Ag+>Fe3+>I2 B.氧化性顺序:Fe3+>I–>Fe2+
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
③推测III中未发生Ag+氧化I–的原因_______ 。
(3)利用如下图所示装置,探究Ag+氧化I–的反应。_______ 。
A.KCl B.KNO3 C.Fe2(SO4)3
②闭合K,电流计指针偏转。“石墨2”作_______ 。
A.阴极 B.阳极 C.正极 D.负极
③已知0.1mol·L-1AgNO3溶液的pH=6。上述实验中可能是 氧化了I–,将装置中的
氧化了I–,将装置中的_______ 溶液换成_______ ,闭合K,指针未发生偏转,确认Ag+氧化了I–。
取I中产生的黑色沉淀0.0216g于试管中。进行实验:①向黑色沉淀中滴加稀硝酸使其溶解;②再向试管中滴加氨水,边滴边振荡至沉淀恰好溶解;③再向其中滴加乙醛溶液,加热,产生光亮的银镜。
(4)写出第①步反应的化学方程式。_______ 。
(5)为得到光亮的银镜,实验时应做到:_______ (任写2点)。若黑色沉淀全部转化为银镜,理论上需要乙醛_______ mol。
A.1×10-4 B.2×10-4 C.1×10-3 D.2×10-3
(1)配制溶液:称量→溶解→冷却→操作①→洗涤→注入→混匀→定容→操作②→装瓶贴标签
①下列图示中,操作①为

③实验室AgNO3溶液通常盛放在
(2)通过如下实验,比较Ag+、Fe3+、I2的氧化性。
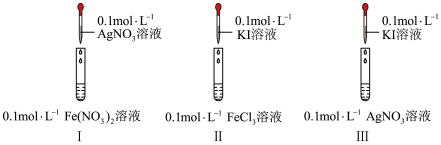
I中产生黑色沉淀,滴加KSCN溶液,变红
II中溶液呈棕黄色,滴加淀粉溶液,变蓝
III中产生黄色沉淀,滴加淀粉溶液,未变蓝
①II中反应的离子方程式为:
②I、II中的现象说明:
A.氧化性顺序:Ag+>Fe3+>I2 B.氧化性顺序:Fe3+>I–>Fe2+
C.还原性顺序:I–>Fe2+>Fe3+ D.还原性顺序:Fe2+>Ag>I–
③推测III中未发生Ag+氧化I–的原因
(3)利用如下图所示装置,探究Ag+氧化I–的反应。

A.KCl B.KNO3 C.Fe2(SO4)3
②闭合K,电流计指针偏转。“石墨2”作
A.阴极 B.阳极 C.正极 D.负极
③已知0.1mol·L-1AgNO3溶液的pH=6。上述实验中可能是
 氧化了I–,将装置中的
氧化了I–,将装置中的取I中产生的黑色沉淀0.0216g于试管中。进行实验:①向黑色沉淀中滴加稀硝酸使其溶解;②再向试管中滴加氨水,边滴边振荡至沉淀恰好溶解;③再向其中滴加乙醛溶液,加热,产生光亮的银镜。
(4)写出第①步反应的化学方程式。
(5)为得到光亮的银镜,实验时应做到:
A.1×10-4 B.2×10-4 C.1×10-3 D.2×10-3
您最近一年使用:0次
名校
解题方法
6 . 某班同学用如下实验探究Fe2+、Fe3+的性质:
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有______ (填“氧化”或“还原”)性。写出上面划线处操作所发生反应的离子方程式______ 。
(2)针对Fe3++3SCN- Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是______ 。(不定项)
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和13%H2O2溶液,溶液变红,煤油的作用是______ 。
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:
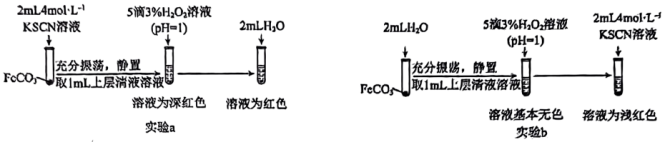
写出实验a中FeCO3与KSCN反应的离子方程式______ ,实验b的目的是______ 。
(5)反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。

①写出反应历程中“速率决定步骤”的热化学方程式:______ 。
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:______ 。
(6)溶液中Fe2+与邻二集非X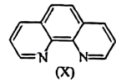 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。
①邻二氮菲提供的配位原子是______ 。
②使用该方法时,需要控制pH在2~9之间,其原因为:______ 。
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
已知吸光度A与有色物质的浓度 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。
Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):______ 。
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有
(2)针对Fe3++3SCN-
 Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是| A.增大KSCN溶液的浓度,平衡常数增大 |
| B.向上述平衡体系中加入适量KCl圆体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,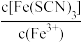 减小 减小 |
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:

写出实验a中FeCO3与KSCN反应的离子方程式
(5)反应S2O
 (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
①写出反应历程中“速率决定步骤”的热化学方程式:
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:
(6)溶液中Fe2+与邻二集非X
 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。①邻二氮菲提供的配位原子是
②使用该方法时,需要控制pH在2~9之间,其原因为:
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
| V(X)/mL | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 | 8.00 |
| 吸光度/A | 0.24 | 0.36 | 0.48 | 0.60 | 0.72 | 0.72 |
 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):
您最近一年使用:0次
解题方法
7 . 某小组同学探究卤族元素性质递变规律,设计如下实验:
(1)实验①的离子方程式为_______ 。实验②的现象是_______ 。
(2)综合实验①②③,Cl2、Br2、I2单质的氧化性由强到弱的顺序是_______ (用化学式表示);从原子结构的角度解释上述递变规律。_______
(3)实验中加入CCl4萃取的目的是_______ ;CCl4可以作为萃取剂的原因是_______ 。
| 序号 | 过程 | 现象 | 结论 |
| ① | 向NaBr溶液中加入少量氯水,再加入CCl4,振荡后静置 | 液体分层,下层呈红棕色 | 氧化性:Cl2>Br2 |
| ② | 向KI溶液中加入少量氯水,再加入CCl4,振荡后静置 | 氧化性:Cl2>I2 | |
| ③ | 向KI溶液中加入少量溴水,再加入CCl4,振荡后静置 |
(2)综合实验①②③,Cl2、Br2、I2单质的氧化性由强到弱的顺序是
(3)实验中加入CCl4萃取的目的是
您最近一年使用:0次
8 . 下列关于溴苯制备,并验证反应类型的实验,说法正确的是
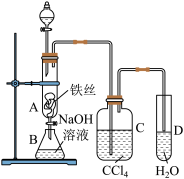
| A.分液漏斗中的试剂是苯和水的混合物 |
| B.B中NaOH用于反应后萃取产品溴苯 |
| C.CCl4中可观察到分层现象 |
| D.反应结束后还需向D中加入AgNO3溶液或石蕊 |
您最近一年使用:0次
2023-12-04更新
|
328次组卷
|
4卷引用:上海市新中高级中学2023-2024学年高二上学期期中考试化学试题
上海市新中高级中学2023-2024学年高二上学期期中考试化学试题(已下线)2.3.1 芳香烃(巩固)(已下线)2.3.2苯的同系物云南省昆明市第一中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
9 . 化合物X由三种元素组成,某研究性学习小组设计并完成如下实验:

请回答:
(1)气体1的VSEPR模型名称为___________ ;气体2的电子式为___________
(2)反应①的化学方程式为___________ 。
(3)气体1与甲醛(HCHO)在一定条件下可生成乌洛托品( ),该反应的化学方程式是
),该反应的化学方程式是___________ (乌洛托品可以用分子式表示)。
(4)足量的气体1和气体2通入饱和食盐水中发生的化学反应方程式为___________
(5)设计实验分别检验气体1和气体2___________

请回答:
(1)气体1的VSEPR模型名称为
(2)反应①的化学方程式为
(3)气体1与甲醛(HCHO)在一定条件下可生成乌洛托品(
 ),该反应的化学方程式是
),该反应的化学方程式是(4)足量的气体1和气体2通入饱和食盐水中发生的化学反应方程式为
(5)设计实验分别检验气体1和气体2
您最近一年使用:0次
2023-07-08更新
|
124次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期9月月考化学试卷
名校
解题方法
10 . 人类的生产和生活都离不开金属。金属材料的使用作为一个时代的标志,见证了人类文明发展的过程,历史上人类冶炼不同金属的大致年代如图所示:
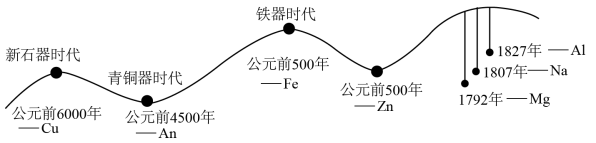
(1)由图可知:人类最早使用的合金是________ ,通过敲打可将金属材料打制成不同的形状,是利用了金属的________ 性。含碳量在0.03%~2%之间某合金,是目前使用量最大的合金,这种合金是________ (填字母)。
A.铝合金 B.镁合金 C.生铁 D,钢
(2)北宋沈插在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾,熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是________ (填字母)。
A.“苦泉”的溶质之一: ;
;
B.“挹其水熬之”:蒸发溶剂;
C.“熬胆矾铁釜,久之亦化为铜”:发生分解反应。
(3)铝的使用距今仅200年左右,现如今铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是________ (用化学方程式表示)。
(4)某溶液中含有 、
、 、
、 、
、 等离子,向其中加入过量
等离子,向其中加入过量 后,过滤,将滤渣投入足量盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是
后,过滤,将滤渣投入足量盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是________ (填字母),大量增加的离子有________ (填化学式)。
A. B.
B. C.
C. D.
D.
工业上用废铁皮制取铁红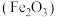 的部分流程示意图如下:
的部分流程示意图如下:
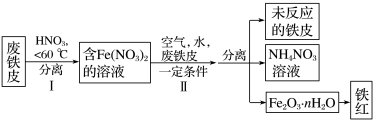
(5)步骤II中发生反应: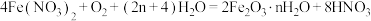 ,反应产生的
,反应产生的 又可将废铁皮中的铁转化为
又可将废铁皮中的铁转化为 ,该反应的化学方程式为:
,该反应的化学方程式为:________ 。
 可制取新型、高效水处理剂——高铁酸钾
可制取新型、高效水处理剂——高铁酸钾 。
。
________ ________
________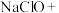 ________
________ ________
________ (高铁酸钾)+________
(高铁酸钾)+________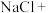 ________
________
(6)配平上述反应,并用单线桥法表示反应过程中的电子转移方向和数目________ 。
(7)此过程中氧化剂是________ (填化学式)。
(8)高铁酸钾 是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用有
是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用有________ 、________
工业上常用铝质容器盛装冷浓酸,为研究铝质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(9)将铝片放入氢氧化钠溶液中可去除表面氧化膜,反应的离子方程式为:________ 。
(10)将已除去表面氧化膜的铝片继续置于氢氧化钠溶液中,迅速产生大量气泡,反应的化学方程式为:________ 。反应过程中氧化剂与还原剂的物质的量之比为________ 。
(11)另取一同样已除去表面氧化膜的铝片放入冷浓硫酸中,10分钟后,移入硫酸铜溶液中,片刻后取出观察,铝片表面无明显变化,其原因是________ 。
(12)另称取铝片6.0g放入15.0mL浓硫酸中,加热,充分应后收集到气体X;甲同学取448mL(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量 溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中
溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中 的体积分数为
的体积分数为________ 。
分析上述实验中 体积分数的结果,丙同学认为气体X中还可能含量有
体积分数的结果,丙同学认为气体X中还可能含量有 ;为此设计了下列探究实验装置(图中央持仪器省略)。
;为此设计了下列探究实验装置(图中央持仪器省略)。
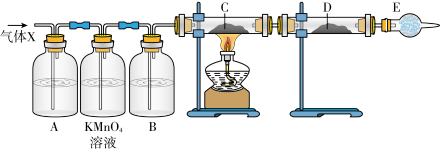
(13)丙同学认为还可能产生氢气的理由是________ 。
(14)A中试剂可选用________。
(15)B中加入的试剂是________ ,E的作用是________ 。
(16)可以证明气体X中含有氢气的实验现象是:________ 。

(1)由图可知:人类最早使用的合金是
A.铝合金 B.镁合金 C.生铁 D,钢
(2)北宋沈插在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾,熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是
A.“苦泉”的溶质之一:
 ;
;B.“挹其水熬之”:蒸发溶剂;
C.“熬胆矾铁釜,久之亦化为铜”:发生分解反应。
(3)铝的使用距今仅200年左右,现如今铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是
(4)某溶液中含有
 、
、 、
、 、
、 等离子,向其中加入过量
等离子,向其中加入过量 后,过滤,将滤渣投入足量盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是
后,过滤,将滤渣投入足量盐酸中,所得溶液与原溶液相比,溶液中大量减少的正离子是A.
 B.
B. C.
C. D.
D.
工业上用废铁皮制取铁红
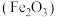 的部分流程示意图如下:
的部分流程示意图如下:
(5)步骤II中发生反应:
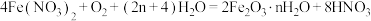 ,反应产生的
,反应产生的 又可将废铁皮中的铁转化为
又可将废铁皮中的铁转化为 ,该反应的化学方程式为:
,该反应的化学方程式为: 可制取新型、高效水处理剂——高铁酸钾
可制取新型、高效水处理剂——高铁酸钾 。
。________
 ________
________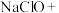 ________
________ ________
________ (高铁酸钾)+________
(高铁酸钾)+________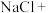 ________
________
(6)配平上述反应,并用单线桥法表示反应过程中的电子转移方向和数目
(7)此过程中氧化剂是
(8)高铁酸钾
 是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用有
是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用有工业上常用铝质容器盛装冷浓酸,为研究铝质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(9)将铝片放入氢氧化钠溶液中可去除表面氧化膜,反应的离子方程式为:
(10)将已除去表面氧化膜的铝片继续置于氢氧化钠溶液中,迅速产生大量气泡,反应的化学方程式为:
(11)另取一同样已除去表面氧化膜的铝片放入冷浓硫酸中,10分钟后,移入硫酸铜溶液中,片刻后取出观察,铝片表面无明显变化,其原因是
(12)另称取铝片6.0g放入15.0mL浓硫酸中,加热,充分应后收集到气体X;甲同学取448mL(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量
 溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中
溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中 的体积分数为
的体积分数为分析上述实验中
 体积分数的结果,丙同学认为气体X中还可能含量有
体积分数的结果,丙同学认为气体X中还可能含量有 ;为此设计了下列探究实验装置(图中央持仪器省略)。
;为此设计了下列探究实验装置(图中央持仪器省略)。
(13)丙同学认为还可能产生氢气的理由是
(14)A中试剂可选用________。
| A.溴水 | B.品红溶液 | C.氢氧化钠溶液 | D.饱和食盐水 |
(16)可以证明气体X中含有氢气的实验现象是:
您最近一年使用:0次



