解题方法
1 .  是重要的供氧剂。图所示装置(省略夹持部件)用于验证
是重要的供氧剂。图所示装置(省略夹持部件)用于验证 和
和 的反应,所需
的反应,所需 由
由 固体与稀盐酸反应制备。回答下列问题:
固体与稀盐酸反应制备。回答下列问题:______ 。
(2)验证装置的气密性时,需用F替换装置中的E。若装置气密性良好,应观察到F中的导管口会有______ 的现象。
(3)装置中的B与C用于除去 气体中的杂质。饱和
气体中的杂质。饱和 溶液的作用是吸收
溶液的作用是吸收______ (填化学式)气体;为了干燥 气体,C中盛放的试剂是足量的
气体,C中盛放的试剂是足量的______ 。
(4)实验过程中,D中部分 固体由淡黄色变为
固体由淡黄色变为______ 色。在E的瓶口放置一条带火星的木条,若木条复燃,则说明生成的气体是______ (填化学式),并且E中的气体______ (填“已集满”或“未集满”)。收集气体时,E的瓶口朝上的主要原因是______ 。
(5)完成上述实验后,除去玻璃纤维,回收D中的所有固体药品共22.76g。使该固体与过量的水充分反应,假定该反应生成的气体共224mL(标准状况)。据此计算,实验中与 反应的
反应的 的物质的量为
的物质的量为______ mol。
 是重要的供氧剂。图所示装置(省略夹持部件)用于验证
是重要的供氧剂。图所示装置(省略夹持部件)用于验证 和
和 的反应,所需
的反应,所需 由
由 固体与稀盐酸反应制备。回答下列问题:
固体与稀盐酸反应制备。回答下列问题:
(2)验证装置的气密性时,需用F替换装置中的E。若装置气密性良好,应观察到F中的导管口会有
(3)装置中的B与C用于除去
 气体中的杂质。饱和
气体中的杂质。饱和 溶液的作用是吸收
溶液的作用是吸收 气体,C中盛放的试剂是足量的
气体,C中盛放的试剂是足量的(4)实验过程中,D中部分
 固体由淡黄色变为
固体由淡黄色变为(5)完成上述实验后,除去玻璃纤维,回收D中的所有固体药品共22.76g。使该固体与过量的水充分反应,假定该反应生成的气体共224mL(标准状况)。据此计算,实验中与
 反应的
反应的 的物质的量为
的物质的量为
您最近一年使用:0次
2 . 某兴趣小组对FeSO4的一些性质进行探究实验。回答下列问题:
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变_____ 色,说明样品已变质。同学甲认为若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,发生反应的离子方程式为______________ 。
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。________________ 。
②装置C中盛放的溶液为________ ;装置D中盛放的溶液为________ (填标号)。
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是_____________ 。
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为_____________ 。
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。

②装置C中盛放的溶液为
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为
您最近一年使用:0次
名校
解题方法
3 . 连四硫酸钠( )是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为:
)是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为: ,按如下装置制备足量
,按如下装置制备足量 并探究其性质。下列表述不正确的是
并探究其性质。下列表述不正确的是
 )是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为:
)是生物酶、生物键的修复剂,其与盐酸反应的离子方程式为: ,按如下装置制备足量
,按如下装置制备足量 并探究其性质。下列表述不正确的是
并探究其性质。下列表述不正确的是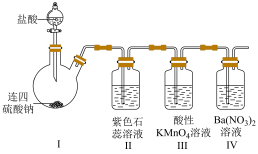
| A.Ⅱ中溶液由紫色变成红色 |
B.Ⅲ中溶液褪色说明 有还原性 有还原性 |
| C.Ⅳ中溶液无明显变化 |
| D.基于环保,本实验应连接尾气处理装置 |
您最近一年使用:0次
2024-03-15更新
|
865次组卷
|
5卷引用:广西贺州第一高级中学2023-2024学年高一下学期4月考试化学试题
名校
解题方法
4 . 人们借助数字传感器可以进行更精准的定量实验研究。利用pH传感器研究CO2、SO2与水的反应,实验装置如图所示。
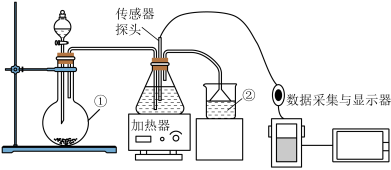
(1)CO2的电子式为___________ 。
(2)装置①的名称为___________ ,装置②中所装液体为___________ 。
(3)写出用以上装置制备SO2的化学方程式___________ 。
(4)通过pH传感器测定CO2和SO2分别溶于水后pH的变化,得到如图1;分别加热两溶液,测得pH随时间变化曲线如图2(已知在30°C101kPa下,CO2溶液度为1.26g/L;SO2溶解度为78g/L。)

①请解释图1中两溶液的pH不同的原因___________ 。
②请结合方程式解释图2中曲线④下降的原因:___________ 。
(5)利用SO2传感器来检测空气中SO2的含量,工作原理如下图所示,该装置的阴极电极反应式为:_________ 。
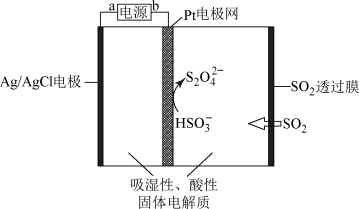
已知SO2穿过透过膜后能完全转化为 。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为___________ g/L。(用含V、a的式子表示) 。

(1)CO2的电子式为
(2)装置①的名称为
(3)写出用以上装置制备SO2的化学方程式
(4)通过pH传感器测定CO2和SO2分别溶于水后pH的变化,得到如图1;分别加热两溶液,测得pH随时间变化曲线如图2(已知在30°C101kPa下,CO2溶液度为1.26g/L;SO2溶解度为78g/L。)

①请解释图1中两溶液的pH不同的原因
②请结合方程式解释图2中曲线④下降的原因:
(5)利用SO2传感器来检测空气中SO2的含量,工作原理如下图所示,该装置的阴极电极反应式为:

已知SO2穿过透过膜后能完全转化为
 。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
。若将标准状况下VL某待测空气通过传感器时,电路中电子转移a mol。则该空气中SO2的含量为
您最近一年使用:0次
5 . 铜和浓硫酸共热能发生反应:Cu + 2H2SO4  CuSO4 + SO2↑+ 2H2O 。某化学兴趣小组的同学利用下图所示的装置,探究铜与浓硫酸的反应情况以及二氧化硫的化学性质。
CuSO4 + SO2↑+ 2H2O 。某化学兴趣小组的同学利用下图所示的装置,探究铜与浓硫酸的反应情况以及二氧化硫的化学性质。
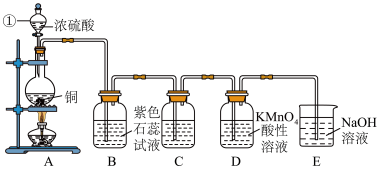
(1)上述装置中,仪器①的名称为_______ 。
(2)B中的现象是:_______ 。
(3)C中溶液的作用是检验SO2具有漂白性,则C中应装入的是_______ 溶液。
(4)D中溶液由紫色褪为无色,证明二氧化硫具有_______ 性(填“氧化”或“还原”)。
(5)若E中NaOH溶液足量,则其中发生反应的离子方程式为:_______ 。
(6)将烧瓶中反应后的溶液用水稀释,得到的溶液呈_______ 色。
(7)反应完毕,烧瓶中有铜剩余,请根据你所学知识判断,硫酸_______ (填“有”或“没有“)剩余。
 CuSO4 + SO2↑+ 2H2O 。某化学兴趣小组的同学利用下图所示的装置,探究铜与浓硫酸的反应情况以及二氧化硫的化学性质。
CuSO4 + SO2↑+ 2H2O 。某化学兴趣小组的同学利用下图所示的装置,探究铜与浓硫酸的反应情况以及二氧化硫的化学性质。
(1)上述装置中,仪器①的名称为
(2)B中的现象是:
(3)C中溶液的作用是检验SO2具有漂白性,则C中应装入的是
(4)D中溶液由紫色褪为无色,证明二氧化硫具有
(5)若E中NaOH溶液足量,则其中发生反应的离子方程式为:
(6)将烧瓶中反应后的溶液用水稀释,得到的溶液呈
(7)反应完毕,烧瓶中有铜剩余,请根据你所学知识判断,硫酸
您最近一年使用:0次
6 . 某学习小组制备 并探究其性质,回答下列问题:
并探究其性质,回答下列问题:
(1)仪器m的名称为___________ 。
(2)若用铜和浓硫酸反应制备 ,可选择如图中的装置
,可选择如图中的装置___________ (填字母)作发生装置,该反应的化学方程式为___________ 。
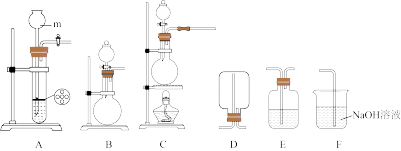
(3) 与装置E中的溶液充分接触后,溶液变浑浊,则该溶液可能是___________。
与装置E中的溶液充分接触后,溶液变浑浊,则该溶液可能是___________。
(4)若 与装置E中的100 mL 0.2
与装置E中的100 mL 0.2  酸性
酸性 溶液恰好完全反应,则被氧化的
溶液恰好完全反应,则被氧化的 的质量为
的质量为___________ g。(已知: )
)
(5)若选用装置F进行 尾气吸收,则该反应的离子方程式为
尾气吸收,则该反应的离子方程式为___________ 。
 并探究其性质,回答下列问题:
并探究其性质,回答下列问题:(1)仪器m的名称为
(2)若用铜和浓硫酸反应制备
 ,可选择如图中的装置
,可选择如图中的装置
(3)
 与装置E中的溶液充分接触后,溶液变浑浊,则该溶液可能是___________。
与装置E中的溶液充分接触后,溶液变浑浊,则该溶液可能是___________。A. 溶液 溶液 | B. 溶液 溶液 |
| C.氯水 | D. 溶液 溶液 |
 与装置E中的100 mL 0.2
与装置E中的100 mL 0.2  酸性
酸性 溶液恰好完全反应,则被氧化的
溶液恰好完全反应,则被氧化的 的质量为
的质量为 )
)(5)若选用装置F进行
 尾气吸收,则该反应的离子方程式为
尾气吸收,则该反应的离子方程式为
您最近一年使用:0次
解题方法
7 . 化学实验要符合“绿色化学”理念。某实验小组对浓硝酸的一些性质进行了探究性实验。试回答下列问题:

(1)写出铜和浓硝酸反应的离子方程式:_______ 。
(2)与装置Ⅰ相比,装置Ⅱ的优点是_______ ,装置Ⅲ除具有装置Ⅱ的优点外,还具有的优点是_______ 。
(3)在装置Ⅲ中,若要使 气体充满烧瓶,应先关闭弹簧夹
气体充满烧瓶,应先关闭弹簧夹_______ (填字母,下同),再打开弹簧夹_______ 。
(4)浓硝酸不仅可以和铁、铜反应,在加热条件下还可以和一种非金属单质发生氧化还原反应生成导致温室效应的气体,请写出该反应的化学方程式:_______ 。
(5)燃料电池是一种高效的供能装置,下图是甲烷燃料电池原理示意图,写出该燃料电池b极发生的电极反应式_______ 。


(1)写出铜和浓硝酸反应的离子方程式:
(2)与装置Ⅰ相比,装置Ⅱ的优点是
(3)在装置Ⅲ中,若要使
 气体充满烧瓶,应先关闭弹簧夹
气体充满烧瓶,应先关闭弹簧夹(4)浓硝酸不仅可以和铁、铜反应,在加热条件下还可以和一种非金属单质发生氧化还原反应生成导致温室效应的气体,请写出该反应的化学方程式:
(5)燃料电池是一种高效的供能装置,下图是甲烷燃料电池原理示意图,写出该燃料电池b极发生的电极反应式

您最近一年使用:0次
名校
解题方法
8 . 熔融的金属锡(熔点231℃)在300℃左右能直接与氯气作用生成无水四氯化锡:Sn+2Cl2 SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
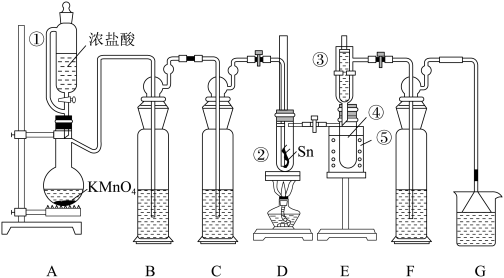
回答下列问题:
(1)装置A中烧瓶内反应的离子方程式为____ ;仪器①中导管的作用是___ 。
(2)B、C、F、G盛装的试剂应依次选用下列中的____ (填标号)。
a.浓H2SO4 b.饱和NaHCO3溶液 c.饱和NaCl溶液 d.NaOH浓溶液
(3)取少量Sn片切成丝状,放入D装置反应器②中。冷阱③和小烧杯⑤内都装入冷水,按图将仪器连接好后,再一次检验整个装置,确证系统不漏气。先打开恒压滴液漏斗活塞使反应发生,排尽装置中的空气后,再加热D装置中试管②使Sn丝熔化,并与Cl2发生反应。能说明装置中的空气被排尽的现象是____ ;生成的SnCl4经冷凝后,收集于E装置的试管④中,该液体常常呈黄绿色,原因是___ 。
(4)用玻璃棒蘸取少量产物SnCl4,放置在空气中,片刻即产生白色烟雾,产物为SnO2•xH2O和____ (填化学式)。
(5)0.500gSn完全反应,制得SnCl41.03g,产率为____ 。
 SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
回答下列问题:
(1)装置A中烧瓶内反应的离子方程式为
(2)B、C、F、G盛装的试剂应依次选用下列中的
a.浓H2SO4 b.饱和NaHCO3溶液 c.饱和NaCl溶液 d.NaOH浓溶液
(3)取少量Sn片切成丝状,放入D装置反应器②中。冷阱③和小烧杯⑤内都装入冷水,按图将仪器连接好后,再一次检验整个装置,确证系统不漏气。先打开恒压滴液漏斗活塞使反应发生,排尽装置中的空气后,再加热D装置中试管②使Sn丝熔化,并与Cl2发生反应。能说明装置中的空气被排尽的现象是
(4)用玻璃棒蘸取少量产物SnCl4,放置在空气中,片刻即产生白色烟雾,产物为SnO2•xH2O和
(5)0.500gSn完全反应,制得SnCl41.03g,产率为
您最近一年使用:0次
2022-06-25更新
|
277次组卷
|
4卷引用:广西钦州市第四中学2022-2023学年高二上学期11月考试化学试题
9 . 工业和居民生活向大气排放污染物使大气酸化,造成大气酸化的主要气体之一是SO2.某化学学习小组同学对SO2性质进行了探究。
(1)学习小组用图1装置制备SO2气体。_______ 。
②写出仪器A中发生反应的化学方程式_______ 。
③反应结束后,排除A瓶中残留的SO2气体,其具体操作是_______ 。
(2)学习小组用图2装置来检验SO2的性质,回答有关问题。
①甲同学欲检验SO2的漂白性,则B中应加入的试剂是_______ 。
②乙同学欲检验SO2的氧化性和还原性,分别在B、C中盛放Na2S溶液、FeCl3溶液,请描述在通入SO2气体过程中观察到的现象_______ 。
③丙同学欲检验H2SO3与HClO酸性强弱,应分别在B、C中盛放_______ (填标号)。
A.足量Ca (ClO)2溶液、Ba (OH)2溶液 B.足量NaClO、澄清石灰水
C.足量NaHCO3、NaClO溶液 D.足量NaHCO3、Ca (ClO)2溶液
(3)学习小组对Na2SO3固体的纯度进行了测定,取15. 0g Na2SO3固体样品配置成100 mL溶液,取25. 00mL放入锥形瓶中,加水稀释到50 mL,然后用1. 000 mol·L-1酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液10. 00mL。
①滴定终点的判断依据是_______ 。
②Na2SO3固体的纯度为_______ 。
(1)学习小组用图1装置制备SO2气体。

②写出仪器A中发生反应的化学方程式
③反应结束后,排除A瓶中残留的SO2气体,其具体操作是
(2)学习小组用图2装置来检验SO2的性质,回答有关问题。
①甲同学欲检验SO2的漂白性,则B中应加入的试剂是
②乙同学欲检验SO2的氧化性和还原性,分别在B、C中盛放Na2S溶液、FeCl3溶液,请描述在通入SO2气体过程中观察到的现象
③丙同学欲检验H2SO3与HClO酸性强弱,应分别在B、C中盛放
A.足量Ca (ClO)2溶液、Ba (OH)2溶液 B.足量NaClO、澄清石灰水
C.足量NaHCO3、NaClO溶液 D.足量NaHCO3、Ca (ClO)2溶液
(3)学习小组对Na2SO3固体的纯度进行了测定,取15. 0g Na2SO3固体样品配置成100 mL溶液,取25. 00mL放入锥形瓶中,加水稀释到50 mL,然后用1. 000 mol·L-1酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液10. 00mL。
①滴定终点的判断依据是
②Na2SO3固体的纯度为
您最近一年使用:0次
2022-05-24更新
|
1136次组卷
|
3卷引用:广西2022届高三第一次适应性测试理科综合化学试题
解题方法
10 . 化学实验室是验证假设、推断结论的重要方法。某学习小组学习了氧化还原知识后,对SO2的还原性进行了探究。
Ⅰ.探究SO2和FeCl3溶液之间的反应:

(1)A中反应的离子方程式是_______ ,D中溶液的作用是_______ 。
(2)装置B具有缓冲气流和储存气体的作用,装置中试剂是_______ 。
(3)通入足量的SO2,反应结束后,向装置C中滴加酸性高锰酸钾溶液,检验生成的Fe2+ ,若酸性高锰酸钾溶液紫色褪去证明SO2与Fe3+发生了反应,你认为该结论是否正确,理由是_______ 。
Ⅱ.有同学认为CO2、SO2均是酸性氧化物,性质相似,由CO2与Ca(ClO)2溶液反应,推测SO2与Ca(ClO)2溶液反应也生成CaSO3,通过如图所示装置验证假设。实验过程发现:开始装置A中出现浑浊,溶液逐渐变为黄绿色,随着SO2不断通入,产生大量白色沉淀,溶液黄绿色又褪去。
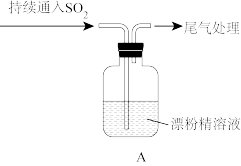
(4)取白色沉淀,加入稀盐酸,没有明显变化,推测沉淀是_______ 。
(5)通入SO2一段时间后,黄绿色消失,发生反应的离子方程式是_______ 。若要验证该反应能发生,实验方案是 _______ 。
Ⅰ.探究SO2和FeCl3溶液之间的反应:

(1)A中反应的离子方程式是
(2)装置B具有缓冲气流和储存气体的作用,装置中试剂是
(3)通入足量的SO2,反应结束后,向装置C中滴加酸性高锰酸钾溶液,检验生成的Fe2+ ,若酸性高锰酸钾溶液紫色褪去证明SO2与Fe3+发生了反应,你认为该结论是否正确,理由是
Ⅱ.有同学认为CO2、SO2均是酸性氧化物,性质相似,由CO2与Ca(ClO)2溶液反应,推测SO2与Ca(ClO)2溶液反应也生成CaSO3,通过如图所示装置验证假设。实验过程发现:开始装置A中出现浑浊,溶液逐渐变为黄绿色,随着SO2不断通入,产生大量白色沉淀,溶液黄绿色又褪去。

(4)取白色沉淀,加入稀盐酸,没有明显变化,推测沉淀是
(5)通入SO2一段时间后,黄绿色消失,发生反应的离子方程式是
您最近一年使用:0次



