名校
1 . 某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是


| A.①和②中发生的反应均为复分解反应 |
| B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 |
| C.一段时间后②中有胶冻状物质生成 |
| D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸 |
您最近一年使用:0次
2016-12-09更新
|
250次组卷
|
11卷引用:贵州省遵义航天高级中学2017-2018学年高一上学期期末考试理科综合化学试题
贵州省遵义航天高级中学2017-2018学年高一上学期期末考试理科综合化学试题2015-2016学年北京市西城区高一上学期期末考试化学试卷2016-2017学年广东省汕头市金山中学高一上学期期末考试化学试卷(已下线)北京市第四中学2016-2017学年高一下学期期中考试化学试题安徽省定远重点中学2018-2019学年高一下学期开学考试化学试题云南省漾濞二中2019-2020学年高二上学期开学考试化学试题安徽省合肥市肥东县高级中学2019-2020学年高一上学期期末考试化学试题安徽省滁州市民办高中2019-2020学年高一上学期期末考试化学试题甘肃省玉门市油田第一中学2020-2021学年高一上学期期末考试化学试题四川省绵阳中学实验学校2019-2020学年高一下学期入学考试化学试题 云南省玉溪师范学院附属中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
2 . 下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
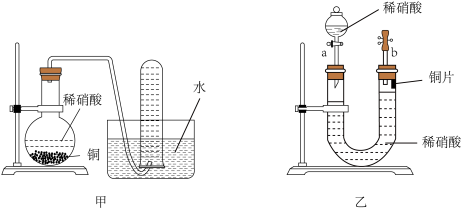
(1)写出铜和稀硝酸反应的离子方程式:___________ 。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体___________ (填“能”或“不能”),请简述理由(用文字和化学方程式表示):___________
(3)若用实验装置乙进行实验,该装置的优点是___________ 。

(1)写出铜和稀硝酸反应的离子方程式:
(2)实验装置甲能否证明铜和稀硝酸反应的产物是NO气体
(3)若用实验装置乙进行实验,该装置的优点是
您最近一年使用:0次
解题方法
3 . 浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如下图所示的实验。请据此回答下列问题。
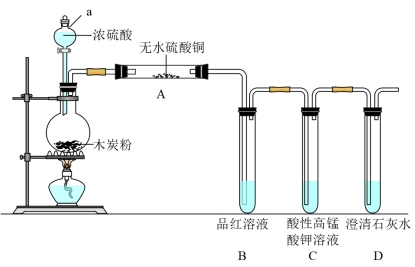
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式_______ 。
(2)仪器a的名称是_______ 。
(3)装置A中出现_______ 现象,证明气体产物中有 。
。
(4)C装置作用是_______ 。

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式
(2)仪器a的名称是
(3)装置A中出现
 。
。(4)C装置作用是
您最近一年使用:0次
2022-04-15更新
|
982次组卷
|
4卷引用:贵州省“三新”改革联盟校2021-2022学年高一下学期联考试题(三) 化学试题
名校
解题方法
4 . 为探究SO2与Fe3+间是否发生氧化还原反应,按如图所示装置进行实验(夹持、加热仪器略),下列说法正确的是


| A.A中的反应仅体现了浓硫酸的氧化性 |
| B.试剂a为饱和NaHCO3溶液 |
| C.C中溶液pH降低,证明Fe3+氧化了SO2 |
| D.检验C中的溶液含有Fe2+,证明Fe3+氧化了SO2 |
您最近一年使用:0次
2022-02-22更新
|
651次组卷
|
10卷引用:贵州省贵阳市五校2021-2022学年高三下学期联考(五)理科综合化学试题
贵州省贵阳市五校2021-2022学年高三下学期联考(五)理科综合化学试题北京市朝阳区六校2020届高三四月联考化学(B卷)试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学与生活 氧化还原反应 阿伏加德罗常数上海市静安区2021届高三一模化学试题(已下线)重点1 仪器组合型实验方案的设计与评价-2021年高考化学【热点·重点·难点】专练(新高考)重庆市南开中学2020-2021学年高一下学期期中考试化学试题(已下线)考向35 实验的方案设计与评价-备战2022年高考化学一轮复习考点微专题上海市杨浦高级中学2021-2022学年高一上学期期末考试化学试题湖南省株洲市第二中学2022届高三下学期期中考试化学试题 上海市大同中学2021-2022学年高一下学期期中考试化学试题
5 . 某兴趣小组为丰富课本所学的SO2性质,设计了下列系列实验:
(1)用下图装置制取并收集SO2以验证其氧化性
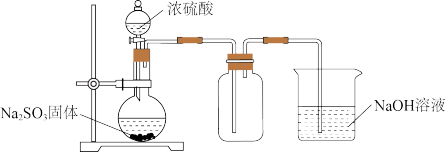
①Na2SO3久置于空气中易变质,体现了Na2SO3具有___________ 性。
②烧杯中NaOH溶液的作用是___________ 。
③若将集气瓶换成盛有Na2S溶液的广口瓶,通气一段时间后产生大量淡黄色浑浊现象,经测定,产物中还有一种相对分子质量为104的酸式盐。则该酸式盐的化学式为___________ 。
(2)用下图装置验证H2SO3比H2CO3酸性强
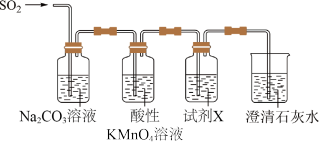
①试剂X是___________ ,其作用是___________ 。
②当观察到___________ ,即证明H2SO3比H2CO3酸性强。
(1)用下图装置制取并收集SO2以验证其氧化性

①Na2SO3久置于空气中易变质,体现了Na2SO3具有
②烧杯中NaOH溶液的作用是
③若将集气瓶换成盛有Na2S溶液的广口瓶,通气一段时间后产生大量淡黄色浑浊现象,经测定,产物中还有一种相对分子质量为104的酸式盐。则该酸式盐的化学式为
(2)用下图装置验证H2SO3比H2CO3酸性强

①试剂X是
②当观察到
您最近一年使用:0次
2020-12-17更新
|
506次组卷
|
4卷引用:贵州省六盘水市六枝特区2021-2022学年高一下学期期中教学质量检测化学试题
6 . 草酸亚铁晶体( FeC2O4·2H2O)是一种淡黄色粉末,可用作照相显影剂。某课外小组利用如下实验装置对草酸亚铁晶体分解产物进行探究,并设计实验测定草酸亚铁晶体样品纯度。
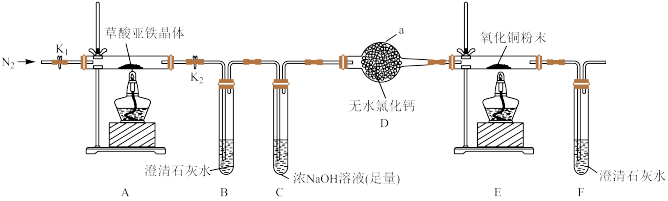
回答下列问题:
(1)仪器a的名称为_____ ;装置B中澄清石灰水变浑浊,说明气体分解产物中含有_____ ;
(2)实验前先通一段时间N2目的是________ ;装置C中浓NaOH溶液的作用是______ ;
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是______ ;
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是______ (填化学式);根据上述实验现象写出草酸亚铁晶体分解的化学方程式_______ ;
(5)所给实验装置存在明显的设计缺陷,该缺陷是______ ;
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为________ (已知该草酸亚铁晶体样品中不含其他与高锰酸钾反应的还原性杂质)。

回答下列问题:
(1)仪器a的名称为
(2)实验前先通一段时间N2目的是
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是
(5)所给实验装置存在明显的设计缺陷,该缺陷是
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为
您最近一年使用:0次
名校
7 . 某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。

(1)B的作用是_____________ ,G的作用是____________ ;请写出C中发生的离子反应方程式_________ 。
(2)填写装置中可能使用的药品:E_________ ,F________ 。
(3)证明有H2生成的实验现象是__________ 。
(4)若判断出有H2生成,取少量A中反应后的溶液,加入KSCN溶液,溶液_____ (填“是”或“否”)变红色。

(1)B的作用是
(2)填写装置中可能使用的药品:E
(3)证明有H2生成的实验现象是
(4)若判断出有H2生成,取少量A中反应后的溶液,加入KSCN溶液,溶液
您最近一年使用:0次
名校
解题方法
8 . 根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。

(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________ 。干燥管D的作用是____________ 。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________ 。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________ 。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________ (填序号);试管中发生反应的离子方程式为__________________ 。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________ 。

(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为
您最近一年使用:0次
2020-01-13更新
|
528次组卷
|
12卷引用:贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题
贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题贵州省岑巩县第二中学2019-2020学年高一上学期期末考试化学试题云南省梁河县第一中学2019-2020学年高一上学期期末考试化学试题云南省文山壮族苗族自治州富宁县第二中学2019-2020学年高一上学期期末考试化学试题广西壮族自治区河池市罗城县第二高级中学2019-2020学年高一上学期期末考试化学试题安徽省定远县育才学校2019-2020学年高一下学期4月月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高一下学期期中考试化学试题四川省泸县第二中学2019-2020学年高一下学期期末模拟考试化学试题(已下线)5.1.3 同主族元素的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)云南省玉溪第三中学2021-2022学年高一上学期期末考试化学试题广西钦州市第四中学2022-2023学年高一上学期12月份考试化学试题河北省衡水市河北武强中学2023-2024学年高二上学期开学考试化学试题
解题方法
9 . 为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:
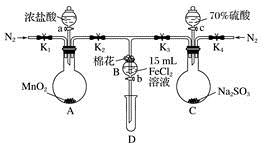
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________ 。
(2)棉花中浸润的溶液为_____________ 。作用是___________________ 。
(3)A中发生反应的化学方程式:______________________________________ 。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________ 。用______________ (写试剂化学式)检验氧化产物,现象是____________ 。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________ 。
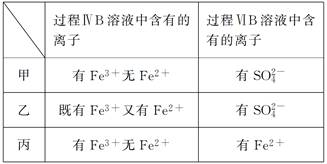
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________ (填“甲”“乙”或“丙”)。

Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是
(2)棉花中浸润的溶液为
(3)A中发生反应的化学方程式:
(4)导致步骤Ⅲ中溶液变黄的离子反应是
(5)能说明氧化性Fe3+>SO2的离子方程式是
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是

您最近一年使用:0次
2018-06-28更新
|
541次组卷
|
4卷引用:贵州省三都水族自治县高级中学2019-2020学年高一上学期期末考试化学试题
名校
10 . 某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。
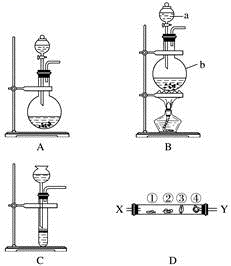
(1)写出装置B中指定仪器的名称a________ ,b_________ 。
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________ 装置制取氯气。
(3)反应装置的导气管连接装置D的________ (填“X”或“Y”)导管,试回答下列问题
①处所发生反应的离子方程式:____________________ ;
②处的现象:____________________ ;
③处所发生反应的离子方程式:__________________________ 。
(4)装置D中④的作用是__________________ 。
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________ (填“能”或“不能”)证明该结论、理由是___________ 。

(1)写出装置B中指定仪器的名称a
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的
(3)反应装置的导气管连接装置D的
①处所发生反应的离子方程式:
②处的现象:
③处所发生反应的离子方程式:
(4)装置D中④的作用是
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象
您最近一年使用:0次
2018-06-28更新
|
965次组卷
|
14卷引用:贵州省毕节市威宁县黑石中学2017-2018学年高一下学期6月份考试化学试题
贵州省毕节市威宁县黑石中学2017-2018学年高一下学期6月份考试化学试题云南省普洱市孟连县一中2018-2019学年高一下学期期末考试化学试题人教版高中化学必修2第一章《物质结构 元素周期律》测试卷2人教版高中化学必修2第一章《物质结构 元素周期律》测试卷2苏教版高一化学必修2专题1《微观结构与物质的多样性》测试卷2020年人教版高中化学必修2第一章《物质结构 元素周期律》测试卷2020年春季苏教版高中化学必修2专题一《微观结构与物质的多样性》测试卷湖北省武汉市钢城第四中学2019-2020高一下学期学习质量检测化学试题广东省湛江市2018-2019学年高一下学期期末考试化学试题广西钦州市浦北县浦北中学2020-2021学年高一3月月考化学试题四川省华蓥中学2020-2021学年高一下学期5月月考化学考试题云南省玉溪市三中2021-2022学年高一下学期3月份入学考试 化学试题山东师范大学附属中学2021-2022学年高一下学期第一次月考化学试题河南省南召现代中学2021-2022学年高一下学期开学检测化学试题



