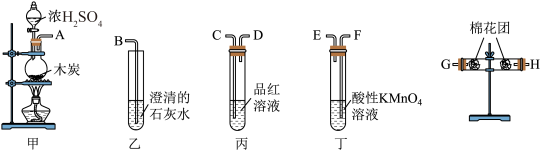
1 . 用如图所示的装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。___________ 。再此反应中硫酸显___________ 性。
如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):A接G,H接C,D接F,E接C,D接B。
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中___________ ,第二次使用的丙中 ___________ ;
(3)丁中酸性KMnO4溶液的作用是___________ ;
(4)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的横线上:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
Ⅰ.在化学实验中,浓硫酸可干燥剂。___________ 。
Ⅱ.Cu与浓H2SO4反应,可生成CuSO4和SO2。___________ 。
Ⅲ.向滤纸上滴加浓H2SO4,滤纸变黑。___________ 。
Ⅳ.在冷浓H2SO4中放入铁片没明显现象。___________ 。
如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):A接G,H接C,D接F,E接C,D接B。
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中
(3)丁中酸性KMnO4溶液的作用是
(4)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的横线上:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
Ⅰ.在化学实验中,浓硫酸可干燥剂。
Ⅱ.Cu与浓H2SO4反应,可生成CuSO4和SO2。
Ⅲ.向滤纸上滴加浓H2SO4,滤纸变黑。
Ⅳ.在冷浓H2SO4中放入铁片没明显现象。
您最近一年使用:0次
2 . 三氯化硼是重要的化工原料。可用于制取乙硼烷( ),也可作有机合成的催化剂。
),也可作有机合成的催化剂。
【查阅资料】① 的沸点为12.5℃,熔点为-107.3℃;
的沸点为12.5℃,熔点为-107.3℃;
② ,硼也能与强碱反应。
,硼也能与强碱反应。
③ 遇潮气会剧烈水解产生白雾。
遇潮气会剧烈水解产生白雾。
某研究性学习小组用如图所示装置制备三氯化硼。回答下列问题:
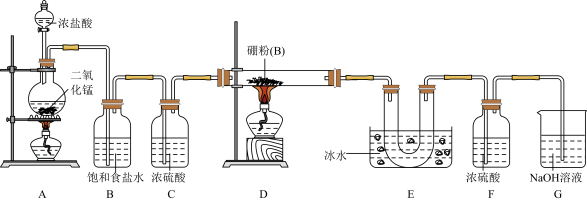
(1)A装置中反应的离子方程式______ 。
(2)B装置的作用是______ ;如果拆去B装置,可能的后果是______ 。
(3)D装置中发生反应的化学方程式______ 。
(4)G装置的作用是______ ;为使实验装置简便,可用一个装置代替F和G装置。该装置所用仪器是______ ,所装试剂是______ 。
(5)A、D两处加热的先后顺序是______ 。
 ),也可作有机合成的催化剂。
),也可作有机合成的催化剂。【查阅资料】①
 的沸点为12.5℃,熔点为-107.3℃;
的沸点为12.5℃,熔点为-107.3℃;②
 ,硼也能与强碱反应。
,硼也能与强碱反应。③
 遇潮气会剧烈水解产生白雾。
遇潮气会剧烈水解产生白雾。某研究性学习小组用如图所示装置制备三氯化硼。回答下列问题:

(1)A装置中反应的离子方程式
(2)B装置的作用是
(3)D装置中发生反应的化学方程式
(4)G装置的作用是
(5)A、D两处加热的先后顺序是
您最近一年使用:0次
名校
解题方法
3 . 如图装置可用于收集气体并验证其某些化学性质能达到目的的是


选项 | 气体 | 试剂 | 现象 | 结论 |
A |
| 酚酞试液 | 溶液变红色 | 氨水显碱性 |
B |
| 紫色石蕊试液 | 溶液先变红后褪色 |  有酸性和漂白性 有酸性和漂白性 |
C |
| 溴水 | 溶液褪色 |  有氧化性 有氧化性 |
D | X | KI淀粉溶液 | 溶液变蓝 | X可能是 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
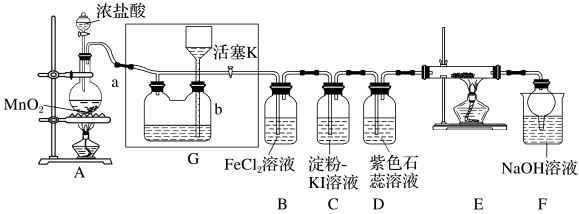
(1)A中发生反应的化学方程式为___________ 。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置D中能看到的实验现象是___________ 。
②在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为___________ 。
③装置F中球形干燥管的作用是___________ 。
(3)储气瓶b内盛放的试剂是___________ 。
(4)装置B中Fe2+被Cl2氧化为Fe3+,反应的离子方程式为___________ 。
(5)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为___________ ,所得漂白粉的有效成分是___________ (填物质名称)。

(1)A中发生反应的化学方程式为
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置D中能看到的实验现象是
②在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为
③装置F中球形干燥管的作用是
(3)储气瓶b内盛放的试剂是
(4)装置B中Fe2+被Cl2氧化为Fe3+,反应的离子方程式为
(5)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 氯气常用于自来熟的杀菌消毒,实验室常用MnO2和浓盐酸共热制备氯气。
(1)写出该反应的离子方程式:_______ ,其中氧化剂和还原剂的物质的量之比为_______ 。
(2)若 和
和 盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为_______。(不考虑盐酸的挥发)
盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为_______。(不考虑盐酸的挥发)
(3)若改用漂白粉与浓盐酸反应制备氯气,反应的化学方程式为 。据此回答下列问题:装置如图所示,同时验证氯气性质(其中夹持装置已省略)
。据此回答下列问题:装置如图所示,同时验证氯气性质(其中夹持装置已省略)
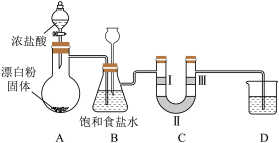
①从反应条件看,MnO2和Ca(ClO)2的氧化能力不同,氧化能力较强的是_______ 。
②装置B除了用于除去挥发的HCl,也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:_______ 。
③装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是_______ (填序号)。
④装置D的烧杯内是NaOH溶液,其作用是_______ ,发生的反应的离子方程式:_______ 。
(4)用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效氨气的消毒剂。 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是_______(填序号)。
除去,下列试剂能实现其转化过程的是_______(填序号)。
(1)写出该反应的离子方程式:
(2)若
 和
和 盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为_______。(不考虑盐酸的挥发)
盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为_______。(不考虑盐酸的挥发)| A.等于0.15mol | B.小于0.15mol |
| C.大于0.15mol,小于0.3mol | D.以上结论都不正确 |
(3)若改用漂白粉与浓盐酸反应制备氯气,反应的化学方程式为
 。据此回答下列问题:装置如图所示,同时验证氯气性质(其中夹持装置已省略)
。据此回答下列问题:装置如图所示,同时验证氯气性质(其中夹持装置已省略)
①从反应条件看,MnO2和Ca(ClO)2的氧化能力不同,氧化能力较强的是
②装置B除了用于除去挥发的HCl,也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:
③装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是
| 序号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效氨气的消毒剂。
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是_______(填序号)。
除去,下列试剂能实现其转化过程的是_______(填序号)。A. | B. | C.KI | D. |
您最近一年使用:0次
名校
解题方法
6 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
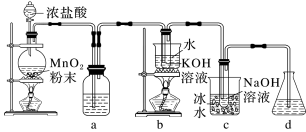
回答下列问题:
(1)浓盐酸在反应过程中表现出来的性质有:___________ (填字母)。
a.酸性 b.氧化性 c.还原性 d.碱性 e.易挥发性
(2)a中的试剂为___________ 。b中发生的化学反应的离子方程式是___________ 。
(3)d中可选用试剂___________ (填字母)。
a. 溶液 b.饱和
溶液 b.饱和 溶液 c.石灰乳 d.稀
溶液 c.石灰乳 d.稀
(4)反应结束后,取出b中试管,经冷却结晶,过滤,___________ ,干燥,得到 晶体。
晶体。
(5)取少量 和
和 溶液置于两支试管中,分别滴加一定浓度的中性淀粉
溶液置于两支试管中,分别滴加一定浓度的中性淀粉 溶液。装有
溶液。装有 的试管溶液颜色不变,装有
的试管溶液颜色不变,装有 的试管溶液变为蓝色。由此可知在该条件下,氧化能力
的试管溶液变为蓝色。由此可知在该条件下,氧化能力
___________  (填“大于”或“小于”)。溶液变蓝的试管内发生反应的离子方程式为:
(填“大于”或“小于”)。溶液变蓝的试管内发生反应的离子方程式为:___________ 。
 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
回答下列问题:
(1)浓盐酸在反应过程中表现出来的性质有:
a.酸性 b.氧化性 c.还原性 d.碱性 e.易挥发性
(2)a中的试剂为
(3)d中可选用试剂
a.
 溶液 b.饱和
溶液 b.饱和 溶液 c.石灰乳 d.稀
溶液 c.石灰乳 d.稀
(4)反应结束后,取出b中试管,经冷却结晶,过滤,
 晶体。
晶体。(5)取少量
 和
和 溶液置于两支试管中,分别滴加一定浓度的中性淀粉
溶液置于两支试管中,分别滴加一定浓度的中性淀粉 溶液。装有
溶液。装有 的试管溶液颜色不变,装有
的试管溶液颜色不变,装有 的试管溶液变为蓝色。由此可知在该条件下,氧化能力
的试管溶液变为蓝色。由此可知在该条件下,氧化能力
 (填“大于”或“小于”)。溶液变蓝的试管内发生反应的离子方程式为:
(填“大于”或“小于”)。溶液变蓝的试管内发生反应的离子方程式为:
您最近一年使用:0次
2023-12-21更新
|
127次组卷
|
2卷引用:新疆乌鲁木齐市实验学校2023-2024学年高一上学期1月期末化学试题
7 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
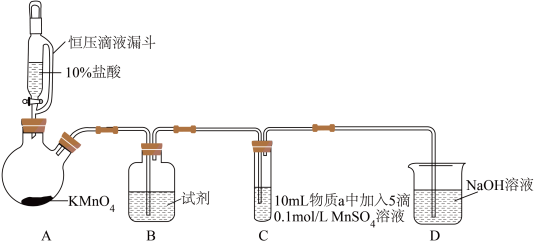
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
690次组卷
|
29卷引用:新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题
新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
8 . 氯气、“84”消毒液、源白粉等都是含氯的消毒剂,某化学兴趣小组利用如图装置制备“84”消毒液、漂白粉,并收集纯净干燥的氯气。回答下列问题:
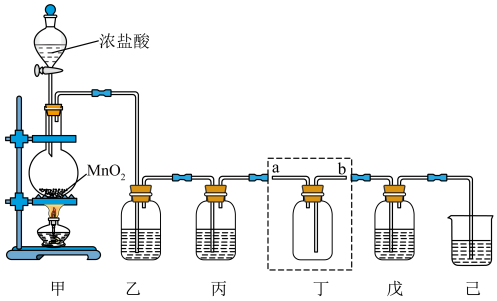
(1)装置甲中发生反应的化学方程式为_______ ,盛装浓盐酸的仪器的名称为________ 。
(2)实验开始前应进行的操作是___________ 。
(3)装置丁用来收集纯净且干燥的氯气,进气口为___________ (填a或b);装置乙盛装的试剂是___________ ,其作用是___________ ;丙盛装的试剂是___________ ,其作用是___________ 。(试剂填名称)
(4)装置戊中盛装石灰乳用来制备漂白粉,则装置戊中发生反应的化学方程式为___________ ;漂白粉长时间暴露在空气中容易发生变质的原因为___________ (结合化学方程式说明)。
(5)实验室中,除上述制取氯气的方法以外,还可利用以下反应: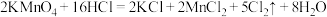 。此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
。此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
①写出该反应的离子方程式:___________ 。
②该反应中,氧化剂是___________ ,被氧化的物质是___________ 。

(1)装置甲中发生反应的化学方程式为
(2)实验开始前应进行的操作是
(3)装置丁用来收集纯净且干燥的氯气,进气口为
(4)装置戊中盛装石灰乳用来制备漂白粉,则装置戊中发生反应的化学方程式为
(5)实验室中,除上述制取氯气的方法以外,还可利用以下反应:
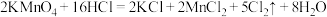 。此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
。此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。①写出该反应的离子方程式:
②该反应中,氧化剂是
您最近一年使用:0次
名校
9 . 某小组为了探究硫酸的性质,设计如下实验:
回答下列问题:
(1)实验①没有明显现象的原因是___________ ;改变一个条件,为使实验①中的反应持续发生,改变条件是___________ 。
(2)为了引发实验②中的反应,宜采取的措施是___________ ;实验后,观察产物水溶液的颜色,其操作方法是___________ 。
(3)实验④产生的气体是___________ (填化学式),比较实验③和④可知,从氧化还原角度分析,H+的作用是___________ ;写出该反应的离子方程式:___________ 。
(4)向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12 g M完全分解为10 g CuO。M的化学式为___________ ;M能与稀硫酸酸化的KI溶液反应生成白色沉淀CuI(碘化亚铜),在滤液中加入淀粉溶液,溶液变蓝色。写出M和稀硫酸酸化的KI溶液反应的离子方程式:___________ 。
| 序号 | 操作 | 现象 |
| ① | 常温下,在铁片中加入过量的浓硫酸 | 没有明显现象 |
| ② | 常温下,在铜片上加入过量的浓硫酸 | 没有明显现象 |
| ③ | 在铜和过量30%H2O2的混合溶液中加入Na2SO4溶液 | 没有明显现象 |
| ④ | 在铜和过量30%H2O2的混合溶液中加入稀硫酸 | 溶液变蓝色,并产生气泡 |
(1)实验①没有明显现象的原因是
(2)为了引发实验②中的反应,宜采取的措施是
(3)实验④产生的气体是
(4)向实验④所得溶液中加入过量NaOH溶液得到沉淀M,用元素分析仪分析,M为铜的氧化物,提纯干燥后的M在惰性气体氛围下加热,12 g M完全分解为10 g CuO。M的化学式为
您最近一年使用:0次
2023-10-22更新
|
73次组卷
|
4卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期11月月考化学试题
10 . 某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物的组成。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
假设I.固体产物为Mg3N2。
假设II.__________
假设Ⅲ._________
请回答下列问题:已知: 2NO2+ 2NaOH=NaNO3+NaNO2+H2O
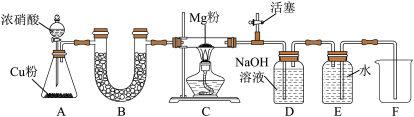
开始时打开活塞K,让A中反应进行一段时间,待C中充满红棕色气体后,关闭活塞K,再点燃C处酒精灯,D中盛有足量的NaOH溶液。
(1)按图连接好仪器,装药品前如何检验装置的气密性:___________
(2)待C中充满红棕色气体后,再点燃C处酒精灯的原因:___________
(3)A中发生的化学反应方程式为:___________
(4)装置B中盛装的干燥剂可以是___________ (填序号)。
a.浓硫酸 b.无水CaCl2 c.碱石灰 d.五氧化二磷
(5)E中收集到的气体对氢气的相对密度是14。则该气体是___________
(6)装置C中实验得到固体残留物的质量是实验前Mg粉质量的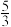 倍,Mg与NO2的反应的固体产物为
倍,Mg与NO2的反应的固体产物为___________
(7)本实验存在明显的缺陷,改进的措施是___________ 。
假设I.固体产物为Mg3N2。
假设II.__________
假设Ⅲ._________
请回答下列问题:已知: 2NO2+ 2NaOH=NaNO3+NaNO2+H2O

开始时打开活塞K,让A中反应进行一段时间,待C中充满红棕色气体后,关闭活塞K,再点燃C处酒精灯,D中盛有足量的NaOH溶液。
(1)按图连接好仪器,装药品前如何检验装置的气密性:
(2)待C中充满红棕色气体后,再点燃C处酒精灯的原因:
(3)A中发生的化学反应方程式为:
(4)装置B中盛装的干燥剂可以是
a.浓硫酸 b.无水CaCl2 c.碱石灰 d.五氧化二磷
(5)E中收集到的气体对氢气的相对密度是14。则该气体是
(6)装置C中实验得到固体残留物的质量是实验前Mg粉质量的
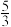 倍,Mg与NO2的反应的固体产物为
倍,Mg与NO2的反应的固体产物为(7)本实验存在明显的缺陷,改进的措施是
您最近一年使用:0次




