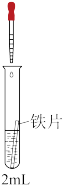1 . 某同学用下列装置制备并检验Cl2的性质。下列说法中正确的是( )

| A.Ⅰ图中如果MnO2过量,浓盐酸就可全部消耗完 |
| B.将Ⅰ图中MnO2换成浓硫酸,撤去酒精灯后可以用于制取少量HCl气体 |
| C.Ⅱ图中铜丝在氯气中燃烧,生成棕黄色的烟 |
| D.若将Ⅲ图装置直接与Ⅰ图发生装置连接,可用于证明干燥的氯气无漂白性 |
您最近一年使用:0次
2019-09-30更新
|
420次组卷
|
4卷引用:第2章 总结与检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)
第2章 总结与检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第2章 总结与检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)专题06 氯及其化合物(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学山东省菏泽市单县第五中学希望部2021-2022学年高三上学期第一次月考化学试题
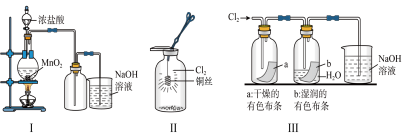
2 . 高铁酸钾(K2FeO4,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备K2FeO4并探究其性质。回答下列问题:
实验(一)制备K2FeO4。___________ ,装置B的作用是___________ ,盛装的试剂为 ___________ 。
(2)装置C中生成K2FeO4的化学方程式为___________
实验(二)探究K₂FeO4的性质。
(3)R溶液为______ (填“稀硫酸”或“盐酸”),写出装置a中的离子方程式:____________ ,不选择另一种酸的主要原因是____________ .
(4)设计一种方案检验从d口逸出的气体:______ 。
ll.探究K₂FeO4在酸性条件下的氧化性。
(5)向K₂FeO4溶液中滴加少量用稀硫酸酸化后的MnSO4溶液,溶液呈紫红色。______ (填“能”或“不能”)证明氧化性:  >MnSO4,原因是
>MnSO4,原因是____________ (用文字说明)。
实验(一)制备K2FeO4。

(2)装置C中生成K2FeO4的化学方程式为
实验(二)探究K₂FeO4的性质。
(3)R溶液为
(4)设计一种方案检验从d口逸出的气体:
ll.探究K₂FeO4在酸性条件下的氧化性。
(5)向K₂FeO4溶液中滴加少量用稀硫酸酸化后的MnSO4溶液,溶液呈紫红色。
 >MnSO4,原因是
>MnSO4,原因是
您最近一年使用:0次
2024-02-28更新
|
377次组卷
|
4卷引用:第三章 铁 金属材料【单元测试A卷】
第三章 铁 金属材料【单元测试A卷】河南省唐河县鸿唐高级中学2023-2024学年高三上学期10月月考化学试题(已下线)T28-实验综合题(已下线)大题02 化学实验综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
3 . 为验证氧化性 ,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
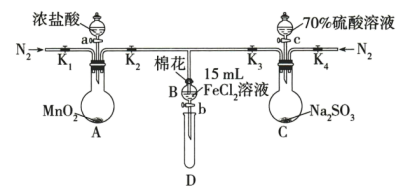
实验过程:
Ⅰ.打开止水夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1,K3,K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸溶液,一段时间后关闭K3。
Ⅵ.更换试管D,重复过程Ⅳ,检验B中溶液的离子。
(1)过程Ⅰ的目的是_______ 。
(2)若向过程ⅢB中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式:_______ 。
(3)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为_______ 。
(4)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性 的是
的是_______ (填“甲”“乙”或“丙”)。
(5)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入22.4LCl2(标准状况下),若溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_______ 。
 ,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
实验过程:
Ⅰ.打开止水夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1,K3,K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸溶液,一段时间后关闭K3。
Ⅵ.更换试管D,重复过程Ⅳ,检验B中溶液的离子。
(1)过程Ⅰ的目的是
(2)若向过程ⅢB中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式:
(3)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为
(4)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性
 的是
的是| 过程为Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有Fe2+ |
| 乙 | 既有Fe3+又有Fe2+ | 有 |
| 丙 | 有Fe3+无Fe2+ | 有 |
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)将将Na、K、Mg、Al各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_______ 与盐酸反应最剧烈,_______ 与盐酸反应产生的气体最多(填元素符号)。
(2)向 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:
溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:_______ 。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
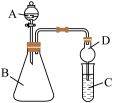
(3)仪器A的名称为_______ 。
(4)实验室中现有药品:①酸稀盐酸;②酸稀硝酸;③ 液溶液;④
液溶液;④ 固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为
固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为_______ 、_______ (填序号)。但有同学认为该装置有缺陷,如何改进?_______ 。
Ⅲ.完成下列问题
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式_______ 。
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现: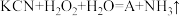 (已配平)。试指出A的化学式
(已配平)。试指出A的化学式_______ ,如此反应中有6.72L(标准状况)气体生成,转移电子数目为_______ 。
(1)将将Na、K、Mg、Al各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向
 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:
溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(3)仪器A的名称为
(4)实验室中现有药品:①酸稀盐酸;②酸稀硝酸;③
 液溶液;④
液溶液;④ 固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为
固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为Ⅲ.完成下列问题
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现:
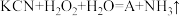 (已配平)。试指出A的化学式
(已配平)。试指出A的化学式
您最近一年使用:0次
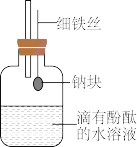
5 . 某研究性学习小组设计出如图所示的装置,目的是做钠与水反应的实验并验证:
①钠的某些物理性质;②钠与水反应的产物。____ 。
(2)当进行适当操作时,还需要用到___ 实验仪器。实验室取用一小块钠,若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量___ (填“偏大”、“偏小”或“不变”)。
(3)钠与水反应的现象很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是___ 。
②能证明钠的熔点低的现象是___ 。
③能证明有氢氧化钠生成的现象是___ 。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是___ 。
①钠的某些物理性质;②钠与水反应的产物。
(2)当进行适当操作时,还需要用到
(3)钠与水反应的现象很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是
②能证明钠的熔点低的现象是
③能证明有氢氧化钠生成的现象是
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是
您最近一年使用:0次
2021-09-28更新
|
332次组卷
|
4卷引用:第二章 海水中的重要元素——钠和氯【章节专项提升】
第二章 海水中的重要元素——钠和氯【章节专项提升】福建省厦门市同安第一中学2021-2022学年高一上学期9月教学质量检测化学试题(已下线)必考点06 钠及其氧化物的性质-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)(已下线)易错专题09 钠与氧气、水和水溶液反应的规律-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
6 . 某学习小组在学习了亚铁盐的性质后,欲探究 溶液分别与
溶液分别与 溶液、
溶液、 溶液的反应。已知:
溶液的反应。已知: 和
和 均为白色沉淀,不存在
均为白色沉淀,不存在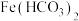 。实验操作及现象记录如下:
。实验操作及现象记录如下:
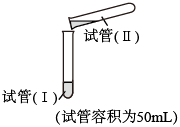
(1)甲同学认为实验a中白色颗粒状沉淀是 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ ;为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入___________ ,产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有 ,他将实验a中两种溶液体积均改为15 mL后再进行实验,证实了他的推测。能证明
,他将实验a中两种溶液体积均改为15 mL后再进行实验,证实了他的推测。能证明 存在的实验现象是
存在的实验现象是___________ 。
(3)实验b中白色颗粒状沉淀主要成分也为 ,写出生成
,写出生成 的离子方程式:
的离子方程式:___________ 。
(4)实验b中液面上方试管内壁黏附的白色颗粒状沉淀物变为红褐色,主要原因是潮湿的 被氧气氧化,写出该反应的化学方程式:
被氧气氧化,写出该反应的化学方程式:___________ 。
 溶液分别与
溶液分别与 溶液、
溶液、 溶液的反应。已知:
溶液的反应。已知: 和
和 均为白色沉淀,不存在
均为白色沉淀,不存在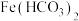 。实验操作及现象记录如下:
。实验操作及现象记录如下:
| 试剂 | 操作及现象 | ||
| 实验a | 试管(I) | 试管(II) | |
1.0mol/L 溶液24mL 溶液24mL | 1.0mol/L 溶液24mL 溶液24mL | 倾倒完后,迅速用胶塞塞紧试管(Ⅰ)的试管口,反复上下颠倒摇匀,使反应物充分混合;反应过程中无气泡产生,生成白色絮状沉淀;放置1.5~2h后,白色絮状沉淀转化为白色颗粒沉淀 | |
| 实验b | 1.0mol/L 溶液10mL 溶液10mL | 1.0mol/L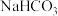 溶液16mL 溶液16mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4min后液面上方试管内壁黏附的白色颗粒状沉淀物变成红褐色 |
 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有
 ,他将实验a中两种溶液体积均改为15 mL后再进行实验,证实了他的推测。能证明
,他将实验a中两种溶液体积均改为15 mL后再进行实验,证实了他的推测。能证明 存在的实验现象是
存在的实验现象是(3)实验b中白色颗粒状沉淀主要成分也为
 ,写出生成
,写出生成 的离子方程式:
的离子方程式:(4)实验b中液面上方试管内壁黏附的白色颗粒状沉淀物变为红褐色,主要原因是潮湿的
 被氧气氧化,写出该反应的化学方程式:
被氧气氧化,写出该反应的化学方程式:
您最近一年使用:0次
名校
7 . 某研究性学习小组利用下列有关装置,对二氧化硫的性质及空气中二氧化硫的含量进行探究(装置的气密性已检查):

(1)装置A中反应的化学方程式是___________ 。
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹,此操作的目的是:___________ 。
(3)实验过程中装置B中没有明显变化。实验结束后取下装置B,从中取少量溶液于洁净试管中,向试管中滴加适量氨水出现白色沉淀___________ (填化学式)。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明二氧化硫具有___________ 性。
(5)装置D的作用是___________ 。
(6)另一小组利用装置E进行实验:二氧化硫性质实验之后,用注射器对实验室内空气进行取样,并向装置E中注入VmL(已折算为标准状况下体积)的空气,当溶液刚好褪色时,停止实验。请计算该空气中二氧化硫的体积分数(用含V的代数式表示)___________ 。(写出计算过程)

(1)装置A中反应的化学方程式是
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹,此操作的目的是:
(3)实验过程中装置B中没有明显变化。实验结束后取下装置B,从中取少量溶液于洁净试管中,向试管中滴加适量氨水出现白色沉淀
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明二氧化硫具有
(5)装置D的作用是
(6)另一小组利用装置E进行实验:二氧化硫性质实验之后,用注射器对实验室内空气进行取样,并向装置E中注入VmL(已折算为标准状况下体积)的空气,当溶液刚好褪色时,停止实验。请计算该空气中二氧化硫的体积分数(用含V的代数式表示)
您最近一年使用:0次
2020-12-29更新
|
1084次组卷
|
3卷引用:第五章 化工生产中的重要非金属元素(培优提升卷)-2020-2021学年高一化学必修第二册章末集训必刷卷(新教材人教版)
(已下线)第五章 化工生产中的重要非金属元素(培优提升卷)-2020-2021学年高一化学必修第二册章末集训必刷卷(新教材人教版)江苏省盐城市华东师范大学盐城实验中学2020-2021学年高一上学期第二次质量监控化学试题河北省保定市唐县第一中学2021-2022学年高一上学期12月考试化学试题
8 . 某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验 i 中的现象是_____ 。
②用化学用语解释实验i中的现象:_____ 。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_____ 。
②进行下列实验,在实验几分钟后的记录如下:
a.以上实验表明:在_____ 条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净) 后再进行实验 iii,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl-的作用是_____ 。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验 ii 结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是_____ (填 字母序号)。
| 装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
| ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
①实验 i 中的现象是
②用化学用语解释实验i中的现象:
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是
②进行下列实验,在实验几分钟后的记录如下:
| 实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1 K3[Fe(CN)6] 溶液 | iii. 蒸馏水 | 无明显变化 |
| iv. 1.0 mol·L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
| v. 0.5 mol·L-1Na2SO4溶液 | 无明显变化 |
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净) 后再进行实验 iii,发现铁片表面产生蓝色沉淀。此补充实验表明 Cl-的作用是
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验 ii 结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是
| 实验 | 试剂 | 现象 |
| A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
| B | 酸洗后的铁片、K3[Fe(CN)6]和 NaCl 混合溶液(未除O2) | 产生蓝色沉淀 |
| C | 铁片、K3[Fe(CN)6]和NaCl 混合溶液(已除O2) | 产生蓝色沉淀 |
| D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除 O2) | 产生蓝色沉淀 |
您最近一年使用:0次
2020-11-12更新
|
495次组卷
|
3卷引用:第四章 化学反应与电能【单元测试B卷】
解题方法
9 . 实验探究;探究碳、硅元素的非金属性的相对强弱。根据要求回答下列问题。
(1)实验装置(部分夹持装置已略)
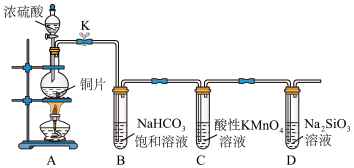
仪器a的名称为__________________ 。
(2)实验步骤
连接装置、__________ 、加药品后,打开K,然后滴入浓硫酸,加热。
(3)问题探究(已知酸性: ,
, 为白色沉淀)
为白色沉淀)
①Cu与浓硫酸反应的化学方程式是________ ;装置C中酸性 溶液的作用是
溶液的作用是_________ 。
②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是___________ 。
③依据装置B中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性________ (填“能”或“否"),装置B中发生反应的离子方程式是______________________ 。
(1)实验装置(部分夹持装置已略)

仪器a的名称为
(2)实验步骤
连接装置、
(3)问题探究(已知酸性:
 ,
, 为白色沉淀)
为白色沉淀)①Cu与浓硫酸反应的化学方程式是
 溶液的作用是
溶液的作用是②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是
③依据装置B中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性
您最近一年使用:0次
解题方法
10 . 某课外活动小组设计了下列装置,验证二氧化碳与过氧化钠反应时需要与水接触。

步骤1:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
请回答下列问题:
(1)装置①中反应的离子方程式是______________________________ 。
(2)装置②中的试剂是___________ (填序号)。
a.饱和 溶液 b.饱和
溶液 b.饱和 溶液 c.浓
溶液 c.浓
(3)装置③中的试剂是____________ 。
(4)过氧化钠与二氧化碳反应的化学方程式是____________________________________ 。
(5)有同学提出质疑,认为上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应,其理由是________________________________________________ 。
(6)需要补充的实验操作是取少量⑤中反应后的固体,____________________________________ 。

步骤1:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。步骤2:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。请回答下列问题:
(1)装置①中反应的离子方程式是
(2)装置②中的试剂是
a.饱和
 溶液 b.饱和
溶液 b.饱和 溶液 c.浓
溶液 c.浓
(3)装置③中的试剂是
(4)过氧化钠与二氧化碳反应的化学方程式是
(5)有同学提出质疑,认为上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应,其理由是
(6)需要补充的实验操作是取少量⑤中反应后的固体,
您最近一年使用:0次
2020-09-02更新
|
1717次组卷
|
7卷引用:第三章 金属及其化合物(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)
(已下线)第三章 金属及其化合物(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)苏教版(2020)高一必修第一册专题3第二单元 综合训练人教版(2019)高一必修第一册 第二章 第一节综合训练(已下线)3.2.1 钠的重要化合物(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)易错专题10 Na2O和Na2O2的性质与比较-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)河南省三门峡市2022-2023学年高三上学期11月阶段性考试化学试题 江西省余干县第二中学2020-2021学年高一上学期12月月考化学试题