名校
解题方法
1 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠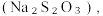 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度: 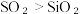 |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
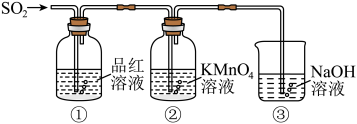
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
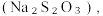 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A.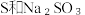 | B. 和浓 和浓 | C. 和 和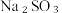 | D.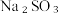 和 和 |
(9)为进一步减少
 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 氯化铁常用于生物和矿物分析,可作为诊断试剂。某小组制备无水 并探究其性质。
并探究其性质。
实验(一)制备无水 。
。
资料显示:亚硫酰氯( )沸点为
)沸点为 ,
, 。
。
操作:将 和适量
和适量 混合共热制备无水
混合共热制备无水 ,装置如图所示。
,装置如图所示。
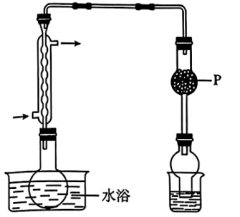
(1)干燥管P中宜盛放_______ (填物质名称)。
(2)写出足量 和
和 反应的化学方程式:
反应的化学方程式:_______ 。
(3)反应完成后,取少量烧瓶中固体溶于蒸馏水中,滴加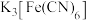 溶液,产生蓝色沉淀,简要分析其原因:
溶液,产生蓝色沉淀,简要分析其原因:_______ 。
实验(二)测定 和
和 反应的热效应。
反应的热效应。
配制 溶液:取一定量
溶液:取一定量 固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
(4)浓盐酸的作用是_______ 。
(5)某小组设计两种方案测定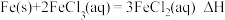 。
。
方案1:直接法
取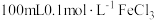 溶液和
溶液和 反应,测量反应前、后溶液的温度计算反应热。
反应,测量反应前、后溶液的温度计算反应热。
方案2:间接法
分别测定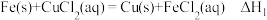 和
和 ,利用盖斯定律计算反应热。
,利用盖斯定律计算反应热。
其中,方案_______ (填“1”或“2”)不可靠,原因是_______ 。
实验(三)探究 和
和 的反应。
的反应。
【查阅资料】 的氧化性大于
的氧化性大于 。
。
【提出假设】 和
和 的反应存在可逆性。
的反应存在可逆性。
【设计实验】如图所示。
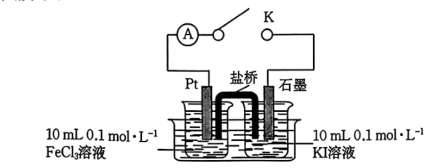
实验操作及现象与记录如下:
(6)b_______ (填“>”“<”或“=”)0.上述实验说明,改变_______ 使反应向逆反应方向进行。
(7)简述实验原理:_______ 。由此证明假设成立。
 并探究其性质。
并探究其性质。实验(一)制备无水
 。
。资料显示:亚硫酰氯(
 )沸点为
)沸点为 ,
, 。
。操作:将
 和适量
和适量 混合共热制备无水
混合共热制备无水 ,装置如图所示。
,装置如图所示。
(1)干燥管P中宜盛放
(2)写出足量
 和
和 反应的化学方程式:
反应的化学方程式:(3)反应完成后,取少量烧瓶中固体溶于蒸馏水中,滴加
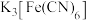 溶液,产生蓝色沉淀,简要分析其原因:
溶液,产生蓝色沉淀,简要分析其原因:实验(二)测定
 和
和 反应的热效应。
反应的热效应。配制
 溶液:取一定量
溶液:取一定量 固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
固体溶于浓盐酸中,加蒸馏水稀释至指定体积。(4)浓盐酸的作用是
(5)某小组设计两种方案测定
 。
。方案1:直接法
取
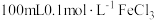 溶液和
溶液和 反应,测量反应前、后溶液的温度计算反应热。
反应,测量反应前、后溶液的温度计算反应热。方案2:间接法
分别测定
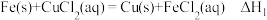 和
和 ,利用盖斯定律计算反应热。
,利用盖斯定律计算反应热。其中,方案
实验(三)探究
 和
和 的反应。
的反应。【查阅资料】
 的氧化性大于
的氧化性大于 。
。【提出假设】
 和
和 的反应存在可逆性。
的反应存在可逆性。【设计实验】如图所示。

实验操作及现象与记录如下:
| 步骤 | 操作及现象 | 记录 |
| I | 按装置图装好试剂,关闭K,发现电流计指针向左偏转 | 电流强度I为a( ) ) |
| II | 一段时间后,电流计指针慢慢回归原位 | 指针回归至原位时,电流强度I为b |
| III | 再向左烧杯里加入 浓溶液,电流计指针向右偏转 浓溶液,电流计指针向右偏转 | 电流强度I为x |
(7)简述实验原理:
您最近一年使用:0次
2024-01-11更新
|
159次组卷
|
3卷引用:河南省驻马店市2023-2024学年高三上学期12月期末理综试题
名校
3 . I.小组同学用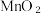 与过量浓盐酸反应制备(
与过量浓盐酸反应制备( 过程中(装置如下图所示),观察到反应停止时仍有
过程中(装置如下图所示),观察到反应停止时仍有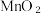 剩余,对此开展探究。
剩余,对此开展探究。

(1)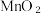 与浓HCl反应的离子方程式是
与浓HCl反应的离子方程式是_____ 。
(2)烧杯中溶液用于吸收尾气,溶液X可以是_____ 。
【提出猜想】
i、反应停止与c(Cl-)降低有关ii。反应停止与c(H+)降低有关
【实验过程】
将反应后的固液混合物倒出,平均分在2个试管中,分别进行以下实验:
(3)将I中操作补充完整:_____ 。
(4)Ⅱ中试纸变蓝说明反应生成的 又置换出I2,该反应的离子方程式为
又置换出I2,该反应的离子方程式为_____ 。
【结论与分析】
(5)通过上述实验,可得到“反应停止与c(H⁺)降低有关”的结论,其实验证据是_____ 。(填“实验I”或“实验Ⅱ”)
Ⅱ、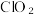 又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备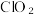 并探究
并探究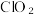 的某些性质。
的某些性质。

(6)A装置中发生反应的化学方程式为_____ 。
回答下列问题:
(7)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了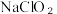 和气体,写出C中发生反应的离子方程式为:
和气体,写出C中发生反应的离子方程式为:_____ 。若关闭③,打开②,B中可观察到红布条褪色。
(8)城市饮用水处理,新技术用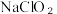 替代
替代 ,其中氯元素都被还原为Cl⁻,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂
,其中氯元素都被还原为Cl⁻,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂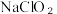 的消毒效率是
的消毒效率是 的
的_____ 倍(结果保留两位小数)。(已知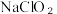 相对原子质量90.5、
相对原子质量90.5、 相对原子质量71)
相对原子质量71)
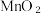 与过量浓盐酸反应制备(
与过量浓盐酸反应制备( 过程中(装置如下图所示),观察到反应停止时仍有
过程中(装置如下图所示),观察到反应停止时仍有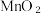 剩余,对此开展探究。
剩余,对此开展探究。
(1)
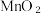 与浓HCl反应的离子方程式是
与浓HCl反应的离子方程式是(2)烧杯中溶液用于吸收尾气,溶液X可以是
【提出猜想】
i、反应停止与c(Cl-)降低有关ii。反应停止与c(H+)降低有关
【实验过程】
将反应后的固液混合物倒出,平均分在2个试管中,分别进行以下实验:
| 序号 | 实验操作 | 实验现象 |
| 实验I | 将湿润的淀粉KI试纸放置于试管口,加入_____,充分振荡后加热试管 | 试纸未变蓝 |
| 实验Ⅱ | 将湿润的淀粉KI试纸放置于试管口,滴入2滴浓硫酸 充分振荡后加热试管 | 试纸变蓝 |
(3)将I中操作补充完整:
(4)Ⅱ中试纸变蓝说明反应生成的
 又置换出I2,该反应的离子方程式为
又置换出I2,该反应的离子方程式为【结论与分析】
(5)通过上述实验,可得到“反应停止与c(H⁺)降低有关”的结论,其实验证据是
Ⅱ、
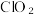 又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备
又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备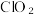 并探究
并探究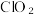 的某些性质。
的某些性质。
(6)A装置中发生反应的化学方程式为
回答下列问题:
(7)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了
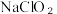 和气体,写出C中发生反应的离子方程式为:
和气体,写出C中发生反应的离子方程式为:(8)城市饮用水处理,新技术用
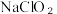 替代
替代 ,其中氯元素都被还原为Cl⁻,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂
,其中氯元素都被还原为Cl⁻,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂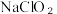 的消毒效率是
的消毒效率是 的
的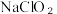 相对原子质量90.5、
相对原子质量90.5、 相对原子质量71)
相对原子质量71)
您最近一年使用:0次
名校
解题方法
4 . 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。完成下列填空:
Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

(1)如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是___________ (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取672ml(标准状况)二氧化硫,至少需要用托盘天平称取亚硫酸钠___________ g。
Ⅱ.下图是某化学兴趣小组的同学进行 的一些性质实验(加热装置略):
的一些性质实验(加热装置略):
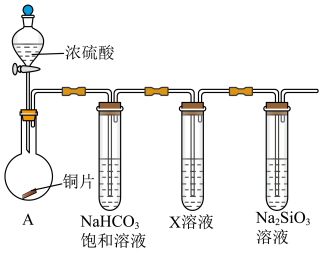
(3)首先,验证碳、硅非金属性的相对强弱。
①连接仪器、检查装置气密性、加药品后,打开分液漏斗活塞,向圆底烧瓶滴入浓硫酸,加热,则圆底烧瓶中发生反应的化学方程式为:___________ 。
②X溶液是___________ 。
③能说明碳的非金属性比硅强的实验现象是:___________ 。
(4)探究亚硫酸与次氯酸的酸性强弱。

①将少量装置A中生成的气体直接通入装置D中,不能根据D中现象判断亚硫酸与次氯酸的酸性强弱,理由是___________ (用离子反应方程式说明)。
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置B中药品是___________ ,通过___________ 现象即可证明亚硫酸的酸性强于次氯酸。
(5)化学兴趣小组的同学设计了如下实验,利用洁净的铜片(0.3mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到 和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。
和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。
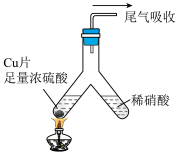
①Y型管左侧发生反应的化学方程式为___________ 。
②NO与b的物质的量之和可能为___________ 。
Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

(1)如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是
(2)若用硫酸和亚硫酸钠反应制取672ml(标准状况)二氧化硫,至少需要用托盘天平称取亚硫酸钠
Ⅱ.下图是某化学兴趣小组的同学进行
 的一些性质实验(加热装置略):
的一些性质实验(加热装置略):
(3)首先,验证碳、硅非金属性的相对强弱。
①连接仪器、检查装置气密性、加药品后,打开分液漏斗活塞,向圆底烧瓶滴入浓硫酸,加热,则圆底烧瓶中发生反应的化学方程式为:
②X溶液是
③能说明碳的非金属性比硅强的实验现象是:
(4)探究亚硫酸与次氯酸的酸性强弱。

①将少量装置A中生成的气体直接通入装置D中,不能根据D中现象判断亚硫酸与次氯酸的酸性强弱,理由是
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置B中药品是
(5)化学兴趣小组的同学设计了如下实验,利用洁净的铜片(0.3mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到
 和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。
和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。
①Y型管左侧发生反应的化学方程式为
②NO与b的物质的量之和可能为
您最近一年使用:0次
5 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域,实验室中利用如图装置(部分装置省略)制备 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
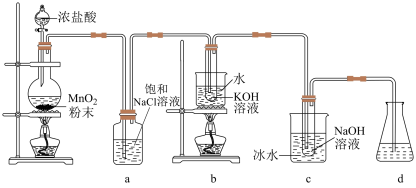
已知:温度会影响 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。
回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是___________ ,装置a的作用是___________ 。
(2)写出b中试管内反应的化学方程式___________ 。
(3)装置c采用冰水浴冷却的目的是___________ 。
(4)反应结束后,取出b中试管,经蒸发浓缩,___________ ,___________ ,少量冷水洗涤,干燥,得到 晶体。
晶体。
(5)设计实验探究 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。
因此, 的氧化能力
的氧化能力___________ (填“大于”或“小于”)NaClO的氧化能力。
(6) 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: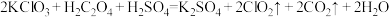 。
。
①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:___________
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为___________ 。(计算结果保留两位小数)
 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响
 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是
(2)写出b中试管内反应的化学方程式
(3)装置c采用冰水浴冷却的目的是
(4)反应结束后,取出b中试管,经蒸发浓缩,
 晶体。
晶体。(5)设计实验探究
 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。| 实验操作 | 现象 | |
| Ⅰ | 取  溶液,振荡。 溶液,振荡。 | 无明显变化 |
| Ⅱ | 取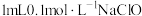 溶液于2号试管中, 溶液于2号试管中, | 出现红褐色沉淀 |
 的氧化能力
的氧化能力(6)
 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: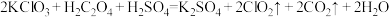 。
。①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
解题方法
6 . 某研究性学习小组对二氧化硫的制备、性质以及含量测定进行探究。
Ⅰ.制备二氧化硫
用70%的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。
(1)制备 气体最合适的发生装置是
气体最合适的发生装置是___________ (填写字母),反应的化学方程式为___________ 。
Ⅱ.探究 的性质
的性质
在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致、打开开关K,通入 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:

三次实验分别得到如下 图:
图:
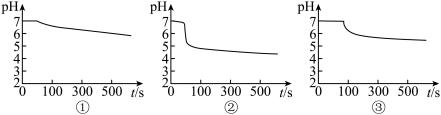
(2)A装置中覆盖食用油的目的是___________ 。
(3) 图中,曲线①呈缓慢下降趋势,这是因为
图中,曲线①呈缓慢下降趋势,这是因为___________ ;曲线②出现骤降,这是因为 与
与 溶液中溶解的
溶液中溶解的___________ 发生了氧化还原反应生成了 ;写出实验③中反应的离子方程式为
;写出实验③中反应的离子方程式为___________ 。
Ⅲ.测定空气中二氧化硫含量。
(4)将空气样品经过管道通入密闭容器中的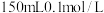 的酸性
的酸性 溶液,若管道中空气流量为
溶液,若管道中空气流量为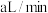 ,经过
,经过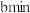 溶液恰好褪色,假设样品中的
溶液恰好褪色,假设样品中的 可被溶液充分吸收。则该空气样品中
可被溶液充分吸收。则该空气样品中 的含量为
的含量为___________ 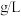 。
。
Ⅰ.制备二氧化硫
用70%的浓硫酸与
 固体反应制备
固体反应制备 气体。
气体。(1)制备
 气体最合适的发生装置是
气体最合适的发生装置是
Ⅱ.探究
 的性质
的性质在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致、打开开关K,通入
 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:| ① | ② | ③ |
已煮沸的 溶液 溶液 | 未煮沸的 溶液 溶液 | 己煮沸的 溶液 溶液 |
| 无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |

三次实验分别得到如下
 图:
图:
(2)A装置中覆盖食用油的目的是
(3)
 图中,曲线①呈缓慢下降趋势,这是因为
图中,曲线①呈缓慢下降趋势,这是因为 与
与 溶液中溶解的
溶液中溶解的 ;写出实验③中反应的离子方程式为
;写出实验③中反应的离子方程式为Ⅲ.测定空气中二氧化硫含量。
(4)将空气样品经过管道通入密闭容器中的
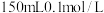 的酸性
的酸性 溶液,若管道中空气流量为
溶液,若管道中空气流量为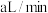 ,经过
,经过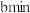 溶液恰好褪色,假设样品中的
溶液恰好褪色,假设样品中的 可被溶液充分吸收。则该空气样品中
可被溶液充分吸收。则该空气样品中 的含量为
的含量为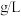 。
。
您最近一年使用:0次
解题方法
7 . 卤族元素的单质及其化合物有重要的用途。实验室用以下装置制取氯气,并探究相关物质的化学性质。
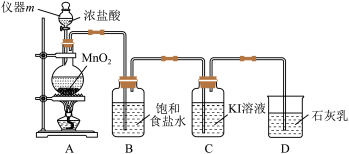
(1)仪器m的名称是___________ ,制取 的离子方程式为
的离子方程式为___________ ,HCl的下列性质中,由氯元素表现出来的性质是___________ 。
a.酸性 b.氧化性 c.还原性 d.挥发性
(2)装置B的作用是除去混在 中的
中的___________ 杂质。
(3)尾气处理装置D可模拟制备___________ (填一种化工产品的名称)。
(4)①实验开始后,装置C中的溶液迅速出现棕色。此时,若生成 物质的量为
物质的量为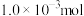 ,则理论上装置A中发生反应的HCl有
,则理论上装置A中发生反应的HCl有___________ mol。
②继续通气一段时间,装置C溶液先变深棕褐色,后变浅,当褪至无色时立即结束实验。据文献报道,碘元素生成碘酸( ,中强酸),
,中强酸), 和
和 在溶液中反应生成碘酸的化学方程式为:
在溶液中反应生成碘酸的化学方程式为:___________ 。某小组设计实验探究碘酸的一种化学性质,请补全实验方案(见如表)。
限选试剂: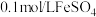 溶液(浸有铁粉)、
溶液(浸有铁粉)、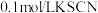 溶液、石蕊试液、
溶液、石蕊试液、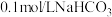 ;溶液、
;溶液、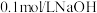 溶液。
溶液。

(1)仪器m的名称是
 的离子方程式为
的离子方程式为a.酸性 b.氧化性 c.还原性 d.挥发性
(2)装置B的作用是除去混在
 中的
中的(3)尾气处理装置D可模拟制备
(4)①实验开始后,装置C中的溶液迅速出现棕色。此时,若生成
 物质的量为
物质的量为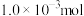 ,则理论上装置A中发生反应的HCl有
,则理论上装置A中发生反应的HCl有②继续通气一段时间,装置C溶液先变深棕褐色,后变浅,当褪至无色时立即结束实验。据文献报道,碘元素生成碘酸(
 ,中强酸),
,中强酸), 和
和 在溶液中反应生成碘酸的化学方程式为:
在溶液中反应生成碘酸的化学方程式为:限选试剂:
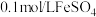 溶液(浸有铁粉)、
溶液(浸有铁粉)、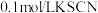 溶液、石蕊试液、
溶液、石蕊试液、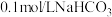 ;溶液、
;溶液、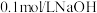 溶液。
溶液。| 操作 | 预期现象 | 结论 |
实验结束后,取少量装置C的溶液到试管中,除去过剩 和HClO后, 和HClO后, |
您最近一年使用:0次
2023-04-11更新
|
231次组卷
|
2卷引用:广东省广州市第四中学2022-2023学年高一上学期期末考试化学试题
8 .  及其盐都是重要的化工原料。
及其盐都是重要的化工原料。
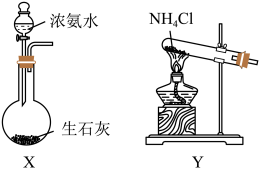
(1)向生石灰中滴加浓氨水,可以快速制取氨气,发生反应的化学方程式为_____ ;盛放浓氨水的仪器名称为_____ ,选用下图中的装置制备干燥的 ,连接顺序为a→
,连接顺序为a→_____ →尾气吸收(按气流方向,用小写字母表示)。

“尾气吸收”装置,可选择_____ 。

(2)进行 性质实验的装置如图。
性质实验的装置如图。

先打开活塞1,瓶Ⅱ中的现象是_____ ,稳定后,关闭活塞1;再打开活塞2,瓶Ⅱ中的现象是_____ 。
(3)某研究小组用磷酸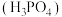 吸收氨气制备干粉灭火剂磷酸氢二铵
吸收氨气制备干粉灭火剂磷酸氢二铵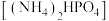 ,装置如图所示。当溶液
,装置如图所示。当溶液 为8.0~9.0时,停止通
为8.0~9.0时,停止通 ,即可制得
,即可制得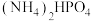 溶液,装置中活塞
溶液,装置中活塞 的作用为
的作用为_____ 。实验过程中,当出现_____ 现象时,应及时关闭 ,打开
,打开 。
。

(4)将氨气通入一定量硫酸中可得 和
和 混合物,称取该混合物固体样品
混合物,称取该混合物固体样品 ,加入足量
,加入足量 溶液,充分反应,生成
溶液,充分反应,生成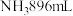 (标准状况),则
(标准状况),则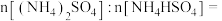
_____ 。
 及其盐都是重要的化工原料。
及其盐都是重要的化工原料。(1)向生石灰中滴加浓氨水,可以快速制取氨气,发生反应的化学方程式为
 ,连接顺序为a→
,连接顺序为a→
“尾气吸收”装置,可选择

(2)进行
 性质实验的装置如图。
性质实验的装置如图。
先打开活塞1,瓶Ⅱ中的现象是
(3)某研究小组用磷酸
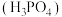 吸收氨气制备干粉灭火剂磷酸氢二铵
吸收氨气制备干粉灭火剂磷酸氢二铵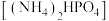 ,装置如图所示。当溶液
,装置如图所示。当溶液 为8.0~9.0时,停止通
为8.0~9.0时,停止通 ,即可制得
,即可制得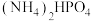 溶液,装置中活塞
溶液,装置中活塞 的作用为
的作用为 ,打开
,打开 。
。
(4)将氨气通入一定量硫酸中可得
 和
和 混合物,称取该混合物固体样品
混合物,称取该混合物固体样品 ,加入足量
,加入足量 溶液,充分反应,生成
溶液,充分反应,生成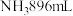 (标准状况),则
(标准状况),则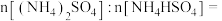
您最近一年使用:0次
2023-07-12更新
|
187次组卷
|
2卷引用:山东省聊城市2022-2023学年高一下学期期末考试化学试题
名校
9 . 某学习小组对硝酸工业活性炭脱硝工艺进行探究。回答下列问题:
Ⅰ.硝酸工业产生的烟气中含有大量 ,工艺如图所示:
,工艺如图所示:
(1)该流程中活性炭是催化剂,加入催化剂的目的是___________ 。
(2)若要使 和
和 恰好充分反应。则反应混合物中
恰好充分反应。则反应混合物中 与
与 的体积比为
的体积比为___________ (用含x的式子表示)。
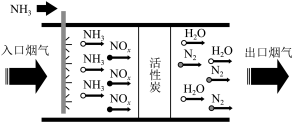
Ⅱ.某同学为了探究干燥条件下 与
与 的反应,设计如图所示实验装置进行实验。
的反应,设计如图所示实验装置进行实验。

(3)装置A为氨气的发生装置,应选用___________ (填“X”或“Y”)为此实验制备氨气的装置,相关反应的化学方程式为___________ 。
(4)该实验设计中存在缺陷,请写出解决方案:___________ 。
(5)装置D用于制备 气体。
气体。
①有同学推测反应过程中有可能产生NO,该同学做此推测的理由为___________ 。
②装置D中发生反应的实验现象为___________ 。
③ 能与碱液反应,故在拆装置之前,应该怎么操作
能与碱液反应,故在拆装置之前,应该怎么操作___________ 。
Ⅰ.硝酸工业产生的烟气中含有大量
 ,工艺如图所示:
,工艺如图所示:
(1)该流程中活性炭是催化剂,加入催化剂的目的是
(2)若要使
 和
和 恰好充分反应。则反应混合物中
恰好充分反应。则反应混合物中 与
与 的体积比为
的体积比为Ⅱ.某同学为了探究干燥条件下
 与
与 的反应,设计如图所示实验装置进行实验。
的反应,设计如图所示实验装置进行实验。
(3)装置A为氨气的发生装置,应选用

(4)该实验设计中存在缺陷,请写出解决方案:
(5)装置D用于制备
 气体。
气体。①有同学推测反应过程中有可能产生NO,该同学做此推测的理由为
②装置D中发生反应的实验现象为
③
 能与碱液反应,故在拆装置之前,应该怎么操作
能与碱液反应,故在拆装置之前,应该怎么操作
您最近一年使用:0次
名校
解题方法
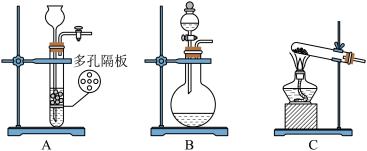
10 . 氯气是一种重要的化工原料,某学习小组对氯气的制备及性质进行了实验探究活动。
(1)实验室常用 与浓盐酸反应制备
与浓盐酸反应制备 ,发生装置应选择下图三种装置中的
,发生装置应选择下图三种装置中的___________ (填标号),选择的依据是___________ 。若要制取常温常压下 ,理论上需要
,理论上需要 的质量为
的质量为___________ (已知:常温常压下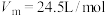 )。
)。
A.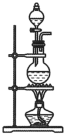 B.
B.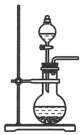 C.
C.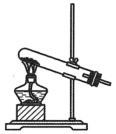
(2)设计如图所示装置探究 能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的
能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的 。
。
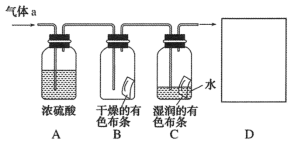
①证明 和水发生了反应的实验现象为
和水发生了反应的实验现象为___________ 。
②该实验设计存在的缺陷是___________ ,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为___________ 。
(3)用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH稀溶液中,当滴到一定量时,红色突然褪去。
①产生上述现象的原因可能有两种:a___________ ;b___________ 。
②设计实验证明红色褪去的原因是a或b:___________ 。
(1)实验室常用
 与浓盐酸反应制备
与浓盐酸反应制备 ,发生装置应选择下图三种装置中的
,发生装置应选择下图三种装置中的 ,理论上需要
,理论上需要 的质量为
的质量为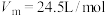 )。
)。A.
 B.
B. C.
C.
(2)设计如图所示装置探究
 能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的
能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的 。
。
①证明
 和水发生了反应的实验现象为
和水发生了反应的实验现象为②该实验设计存在的缺陷是
(3)用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH稀溶液中,当滴到一定量时,红色突然褪去。
①产生上述现象的原因可能有两种:a
②设计实验证明红色褪去的原因是a或b:
您最近一年使用:0次
2023-03-16更新
|
413次组卷
|
2卷引用:广东省广州市六区2022-2023学年高一上学期期末教学质量监测化学试题



