解题方法
1 . I.为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置。实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部。预热后在大试管底部加热。
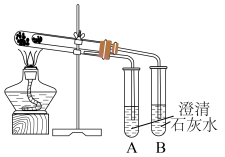
回答下列问题:
(1)小试管中放置___________ 药品(填化学名称)。
(2)开始加热一段时间后,试管___________ (填“A”或“B”)中会出现浑浊现象。实验现象证明,加热条件下,Na2CO3比NaHCO3更___________ (填“稳定”或“不稳定”)。
II.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:
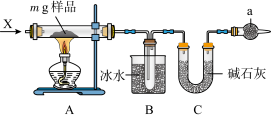
(3)仪器a的名称是___________ 。
(4)装置B中冰水的作用是___________ 。
(5)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是___________。

回答下列问题:
(1)小试管中放置
(2)开始加热一段时间后,试管
II.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:

(3)仪器a的名称是
(4)装置B中冰水的作用是
(5)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是___________。
| A.样品分解不完全 |
| B.装置B、C之间缺少CO2的干燥装置 |
| C.产生CO2气体的速率太快,没有被碱石灰完全吸收 |
| D.反应完全后停止加热,通入过量的空气 |
您最近一年使用:0次
名校
2 . 某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略),以验证 Fe3+、Cl2、SO2氧化性的强弱。根据题目要求回答下列问题:___________ 。检查装置气密性后,关闭K1、K3、K4,打开K2,旋开旋塞a,A中发生反应的化学方程式为___________ ,B中发生反应的离子方程式为___________ 。
(2)B中溶液变黄时,关闭K2.打开旋塞b,使约2 mL的溶液流入试管D中,关闭旋塞b,检验实验中B生成离子的方法是___________ 。
(3)甲、乙、丙三位同学分别完成了上述实验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序:Cl2>Fe3+>SO2的是___________ (填“甲”“乙”或“丙”)。
(4)验证结束后,将D换成盛有NaOH溶液的烧杯,旋开K1、K2、K3和K4,关闭旋塞a、c,打开旋塞b,从两端鼓入N2,这样做的目的是___________ 。
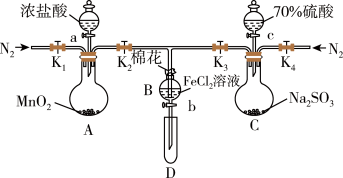
(2)B中溶液变黄时,关闭K2.打开旋塞b,使约2 mL的溶液流入试管D中,关闭旋塞b,检验实验中B生成离子的方法是
(3)甲、乙、丙三位同学分别完成了上述实验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序:Cl2>Fe3+>SO2的是
| 过程(2)中溶液含有的离子 | 过程(3)中溶液含有的离子 | |
| 甲 | 既有Fe3+又有Fe2+ | 有 |
| 乙 | 有Fe3+无Fe2+ | 有 |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(4)验证结束后,将D换成盛有NaOH溶液的烧杯,旋开K1、K2、K3和K4,关闭旋塞a、c,打开旋塞b,从两端鼓入N2,这样做的目的是
您最近一年使用:0次
解题方法
3 . Ⅰ.某兴趣小组的同学制备了氯气并探究其性质。试回答下列问题:
(1)写出实验室制取氯气的化学方程式:___________ 。
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应,
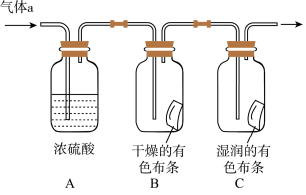
气体a是含有少量空气和水蒸气的氯气。请回答下列问题:
(2)浓硫酸的作用是___________ 。
(3)证明氯气和水反应的实验现象为___________ 。
(4)ICl的性质与 类似,写出ICl与水反应的化学方程式
类似,写出ICl与水反应的化学方程式___________ 。
(1)写出实验室制取氯气的化学方程式:
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应,

气体a是含有少量空气和水蒸气的氯气。请回答下列问题:
(2)浓硫酸的作用是
(3)证明氯气和水反应的实验现象为
(4)ICl的性质与
 类似,写出ICl与水反应的化学方程式
类似,写出ICl与水反应的化学方程式
您最近一年使用:0次
名校
解题方法
4 . KI溶液在酸性条件下能被氧气氧化。现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为______________________ ;
(2)为了便于观察实验,实验试剂除了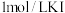 溶液,
溶液,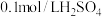 溶液外,还需要的试剂是
溶液外,还需要的试剂是_______ ,实验现象为____________ ;
(3)上述实验操作中除了需要(2)的条件外,还必须控制不变的是__________ (填字母);
a.温度 b.试剂的浓度 c.试剂的用量(体积) d.试剂添加的顺序
(4)由上述实验记录可得出的结论是__________ ;
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是__________ 。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为
(2)为了便于观察实验,实验试剂除了
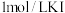 溶液,
溶液,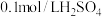 溶液外,还需要的试剂是
溶液外,还需要的试剂是(3)上述实验操作中除了需要(2)的条件外,还必须控制不变的是
a.温度 b.试剂的浓度 c.试剂的用量(体积) d.试剂添加的顺序
(4)由上述实验记录可得出的结论是
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是
您最近一年使用:0次
名校
解题方法
5 . 著名化学反应“法老之蛇”曾令无数人叹服。某兴趣小组为探究 分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。
分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。

回答下列问题:
(1)仪器a的名称为___________ 。
(2)待A中固体充分分解后,取下B装置,B瓶中有无色液体,并有类似氯仿的芳香甜味,与酯混合能够互溶,经查证,B中液体为 ,请举出一种其在实验室中的用途
,请举出一种其在实验室中的用途__________ 。
(3)取下C装置,点燃C中气体,气体燃烧火焰呈紫红色,边缘略带蓝色,则E中反应的化学方程式为___________ 。
(4)取下D装置,将燃着的镁条伸入瓶中,镁条继续燃烧。取出燃烧产物,加入少量热水,产生的气体能使湿润的红色石蕊试纸变蓝,可证明 分解产物中含有
分解产物中含有___________ 。
(5)充分反应后A中剩余固体经证实为HgS。结合以上推断写出 分解的化学方程式
分解的化学方程式_____ 。
(6)用王水溶解A中剩余固体,记溶解后的溶液为X。可用 滴定法测定溶液X中离子浓度以测定
滴定法测定溶液X中离子浓度以测定 的分解率。
的分解率。
已知:① ;
;
② ;
;
③ 标准溶液中含有
标准溶液中含有 指示液。
指示液。
若取上述溶液X,用浓度为cmol/L的 标准溶液进行滴定,消耗VmL,忽略反应前后溶液体积变化,滴定终点的现象为
标准溶液进行滴定,消耗VmL,忽略反应前后溶液体积变化,滴定终点的现象为___________ ;原 固体质量为mg,
固体质量为mg, 的摩尔质量记为M,则
的摩尔质量记为M,则 的分解率为
的分解率为___________ 。(用含M、c、V、m的式子表示)
 分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。
分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。
 | 沸点为-21.2℃,熔点为-34.4℃,化学性质与卤素单质相似,有剧毒,燃烧时火焰呈紫红色,边缘略带蓝色 |
 | 沸点为46.5℃,熔点为-111.9℃,能与酯互溶 |
(1)仪器a的名称为
(2)待A中固体充分分解后,取下B装置,B瓶中有无色液体,并有类似氯仿的芳香甜味,与酯混合能够互溶,经查证,B中液体为
 ,请举出一种其在实验室中的用途
,请举出一种其在实验室中的用途(3)取下C装置,点燃C中气体,气体燃烧火焰呈紫红色,边缘略带蓝色,则E中反应的化学方程式为
(4)取下D装置,将燃着的镁条伸入瓶中,镁条继续燃烧。取出燃烧产物,加入少量热水,产生的气体能使湿润的红色石蕊试纸变蓝,可证明
 分解产物中含有
分解产物中含有(5)充分反应后A中剩余固体经证实为HgS。结合以上推断写出
 分解的化学方程式
分解的化学方程式(6)用王水溶解A中剩余固体,记溶解后的溶液为X。可用
 滴定法测定溶液X中离子浓度以测定
滴定法测定溶液X中离子浓度以测定 的分解率。
的分解率。已知:①
 ;
;②
 ;
;③
 标准溶液中含有
标准溶液中含有 指示液。
指示液。若取上述溶液X,用浓度为cmol/L的
 标准溶液进行滴定,消耗VmL,忽略反应前后溶液体积变化,滴定终点的现象为
标准溶液进行滴定,消耗VmL,忽略反应前后溶液体积变化,滴定终点的现象为 固体质量为mg,
固体质量为mg, 的摩尔质量记为M,则
的摩尔质量记为M,则 的分解率为
的分解率为
您最近一年使用:0次
2023-12-21更新
|
66次组卷
|
2卷引用:福建省“德化一中、永安一中、漳平一中”三校协作2023-2024学年高三上学期12月联考化学试题
名校
6 . 某学习小组探究潮湿的 与
与 反应的产物,进行如图实验:
反应的产物,进行如图实验:
(1)试剂Y的名称是________ 。
(2)请写出装置A中的化学方程式________ 。
(3)装置C中潮湿的 与
与 以等物质的量反应,生成
以等物质的量反应,生成 、气体
、气体 和另一种盐,试写出该反应的化学方程式
和另一种盐,试写出该反应的化学方程式________ 。
(4)若将上述装置中的C、D、E部分换成下图所述装置,其中I与Ⅲ是干燥的有色布条,E中盛装 溶液,请回答下列问题:
溶液,请回答下列问题:________ 。
②D中应装入的物质是________ (填序号)。
a.浓硫酸 b.生石灰 c. 固体 d.
固体 d. 固体
固体
 与
与 反应的产物,进行如图实验:
反应的产物,进行如图实验:
(1)试剂Y的名称是
(2)请写出装置A中的化学方程式
(3)装置C中潮湿的
 与
与 以等物质的量反应,生成
以等物质的量反应,生成 、气体
、气体 和另一种盐,试写出该反应的化学方程式
和另一种盐,试写出该反应的化学方程式(4)若将上述装置中的C、D、E部分换成下图所述装置,其中I与Ⅲ是干燥的有色布条,E中盛装
 溶液,请回答下列问题:
溶液,请回答下列问题:
②D中应装入的物质是
a.浓硫酸 b.生石灰 c.
 固体 d.
固体 d. 固体
固体
您最近一年使用:0次
2023-12-12更新
|
63次组卷
|
2卷引用:福建省福州市福建师范大学附属中学2023-2024学年高一上学期期中考试化学试题
7 . 探究 与水的反应,实验如下(实验中加入的溶液均过量):
与水的反应,实验如下(实验中加入的溶液均过量):

已知:i.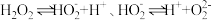
ⅱ.②中发生反应:
下列分析不正确 的是
 与水的反应,实验如下(实验中加入的溶液均过量):
与水的反应,实验如下(实验中加入的溶液均过量):
已知:i.
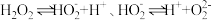
ⅱ.②中发生反应:

下列分析
| A.①、⑤中产生的气体能使带火星的木条复燃 |
| B.①、④中均发生了氧化还原反应和复分解反应 |
C.②、⑤中 与 与 的作用不同,反应消耗等量 的作用不同,反应消耗等量 时产生 时产生 的量也不同 的量也不同 |
D.通过③能比较酸性: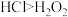 |
您最近一年使用:0次
解题方法
8 . ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图装置(夹持装置略)对制备ClO2、并在吸收、释放和应用进行了研究。

(1)仪器B的名称是___________ 。安装F中导管时,应选用如图中的___________ 。

(2)打开B的活塞,A中发生反应生成ClO2和Cl2,其氧化产物和还原产物的物质的量之比为___________ ,为使产生的ClO2气流稳定,在D中被充分吸收,应___________ 。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________ ,在ClO2释放实验中,打开E中的活塞,D中发生反应,则装置F的作用是___________ 。
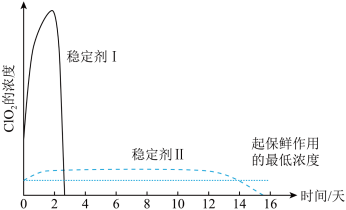
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是___________ ,原因是___________ 。

(1)仪器B的名称是

(2)打开B的活塞,A中发生反应生成ClO2和Cl2,其氧化产物和还原产物的物质的量之比为
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是

您最近一年使用:0次
名校
解题方法
9 . 三星堆出土的青铜面具,由于时间久远,表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、 、
、 作用产生的,其化学式为
作用产生的,其化学式为 ,请用学过的方法对其展开探究。
,请用学过的方法对其展开探究。
(1)根据以上信息可知 的物理性质(写“色、态”)
的物理性质(写“色、态”)___________ 。
(2)为了探究物质的性质,先要了解物质所属的类别,从不同分类标准分析“铜绿”不属于_______ 。
A.铜盐 B.碳酸盐 C.碱式盐 D.碱 E.含氧酸盐 F.无氧酸盐
(3)你从“铜绿”的组成和类别预测它可能具有的性质是___________ (如热稳定性或与哪些物质反应,任写2点)。
(4)经过实验探究,以“铜绿”为反应物可以实现以下物质转化:
“铜绿 ”
”
经观察反应①固体物质溶解,有气泡产生,写出反应方程式___________ 。写出②可能的化学方程式___________ 。
③反应属于___________ 反应(填基本反应类型)。写出④可能的化学方程式___________ 。
 、
、 作用产生的,其化学式为
作用产生的,其化学式为 ,请用学过的方法对其展开探究。
,请用学过的方法对其展开探究。(1)根据以上信息可知
 的物理性质(写“色、态”)
的物理性质(写“色、态”)(2)为了探究物质的性质,先要了解物质所属的类别,从不同分类标准分析“铜绿”不属于
A.铜盐 B.碳酸盐 C.碱式盐 D.碱 E.含氧酸盐 F.无氧酸盐
(3)你从“铜绿”的组成和类别预测它可能具有的性质是
(4)经过实验探究,以“铜绿”为反应物可以实现以下物质转化:
“铜绿
 ”
”经观察反应①固体物质溶解,有气泡产生,写出反应方程式
③反应属于
您最近一年使用:0次
名校
10 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为______ 。
②除杂装置B中盛装的试剂为________ 。
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为_________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
I.由方案I中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl—氧化,该离子还可能由反应_______ 产生(用离子方程式表示)。
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除______ 的干扰。
②根据K2FeO4的制备实验得出:氧化性Cl2______ FeO (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为
②除杂装置B中盛装的试剂为
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次



