21-22高三上·江苏南通·期中
1 . 将金属纳米颗粒与铁氧体一起来制成复合物的研究逐渐成为热点。Fe/Fe3O4复合物材料在很多领域都具有应用。一种制取Fe/Fe3O4复合物的实验装置如图所示,实验过程如下:
步骤1:向三颈烧瓶中通入氮气,将10mLFeCl2溶液以2mL·min-1的速度滴入20mLKOH溶液中,控制温度为100℃,回流3h。
步骤2:待三颈烧瓶冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,40℃干燥,300℃焙烧,得Fe/Fe3O4复合物粗品。

(1)步骤1中反应生成了Fe和Fe3O4,该反应的离子方程式为___________ 。
(2)步骤2中用热水洗涤沉淀时,检验沉淀是否洗净的方法是___________ 。
(3)步骤2中用乙醇洗涤的目的是___________ 。
(4)步骤2中干燥、焙烧时,可能有部分Fe或Fe3O4被氧化为Fe2O3,为测定所得Fe/Fe3O4复合物粗品中Fe3O4的含量,现进行如下实验:准确称量0.4000g粗品,将粗品中的Fe分离出去,向剩余固体中加入足量稀H2SO4,待固体完全溶解后,将溶液转移至锥形瓶中,滴加2滴二苯胺磺酸钠溶液作指示剂,用0.01000mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL。
已知:Ⅰ.二苯胺磺酸钠溶液遇Fe2+显紫色,遇Fe3+不显色;
Ⅱ.Cr2O 可发生转化:Gr2O
可发生转化:Gr2O
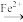 Cr3+。
Cr3+。
①滴定终点的现象是___________ 。
②计算粗品中Fe3O4的质量分数,并写出计算过程___________ 。
步骤1:向三颈烧瓶中通入氮气,将10mLFeCl2溶液以2mL·min-1的速度滴入20mLKOH溶液中,控制温度为100℃,回流3h。
步骤2:待三颈烧瓶冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,40℃干燥,300℃焙烧,得Fe/Fe3O4复合物粗品。

(1)步骤1中反应生成了Fe和Fe3O4,该反应的离子方程式为
(2)步骤2中用热水洗涤沉淀时,检验沉淀是否洗净的方法是
(3)步骤2中用乙醇洗涤的目的是
(4)步骤2中干燥、焙烧时,可能有部分Fe或Fe3O4被氧化为Fe2O3,为测定所得Fe/Fe3O4复合物粗品中Fe3O4的含量,现进行如下实验:准确称量0.4000g粗品,将粗品中的Fe分离出去,向剩余固体中加入足量稀H2SO4,待固体完全溶解后,将溶液转移至锥形瓶中,滴加2滴二苯胺磺酸钠溶液作指示剂,用0.01000mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL。
已知:Ⅰ.二苯胺磺酸钠溶液遇Fe2+显紫色,遇Fe3+不显色;
Ⅱ.Cr2O
 可发生转化:Gr2O
可发生转化:Gr2O
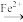 Cr3+。
Cr3+。①滴定终点的现象是
②计算粗品中Fe3O4的质量分数,并写出计算过程
您最近一年使用:0次
名校
解题方法
2 . 亚硝酸钠(NaNO2)是一种工业盐,实验室可用如图装置(略去部分夹持仪器)制备。

已知:
① ;
;
② ;
;
③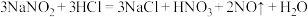 ;
;
④酸性条件下,NO和 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______ ;
(2)装置A中发生反应的化学方程式为_______ ;
(3)实验结束后,B瓶溶液中溶质的主要成分是_______ (填化学式)。
(4)仪器C中盛放的药品为_______ (填名称)。
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,_______ ,则产物是NaNO2 (注明试剂、现象)。
(6)装置F的作用是_______ ;
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数_______ 。(写出计算过程)

已知:
①
 ;
;②
 ;
;③
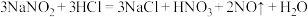 ;
;④酸性条件下,NO和
 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。(1)加热装置A前,先通一段时间N2,目的是
(2)装置A中发生反应的化学方程式为
(3)实验结束后,B瓶溶液中溶质的主要成分是
(4)仪器C中盛放的药品为
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,
(6)装置F的作用是
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
2021-04-28更新
|
449次组卷
|
4卷引用:江苏省常熟市2020-2021学年高一下学期期中化学试题
名校
解题方法
3 . 碘酸钙Ca(IO3)2是新型食品添加剂。实验室制取Ca(IO3)2·2H2O的实验流程如图:
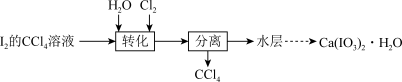
已知:碘酸是易溶于水的强酸,不溶于有机溶剂。碘酸钙晶体溶解度随温度降低而减小。
(1)实验流程“转化”步骤是为了制得碘酸,该过程在下图所示的装置中进行。
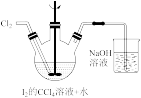
①当观察到三颈瓶中溶液___________ 现象时,停止通入氯气。
②“转化”时发生反应的离子方程式 为___________
(2)除去HIO3水溶液中少量 单质的实验操作为
单质的实验操作为___________ (填字母)。
a. 萃取分液 b. 趁热过滤 c. 冷却结晶
实验中用___________ 溶液检验碘单质的存在与否。
(3)对水层的处理是先用KOH调节pH至10,再在冰水浴中加入CaCl2溶液。
①用KOH溶液调节pH=10的目的是___________
②采用冰水浴的目的是___________
(4)准确称取产品0.6000g于烧杯中,高氯酸微热溶解后,冷却,配成250.00ml溶液。移取上述溶液50.00ml置于250ml碘量瓶中,加入高氯酸2mL、3g KI(足量)(发生: + 5I- + 6H+ = 3I2 + 3H2O),盖上瓶盖,暗处放置3min,加50mL水,加入淀粉溶液,用0.1000mol/L Na2S2O3溶液滴定(发生:I2 +2
+ 5I- + 6H+ = 3I2 + 3H2O),盖上瓶盖,暗处放置3min,加50mL水,加入淀粉溶液,用0.1000mol/L Na2S2O3溶液滴定(发生:I2 +2 =2I-+
=2I-+ )到终点时消耗12.00ml,试计算产品中Ca(IO3)2的质量分数
)到终点时消耗12.00ml,试计算产品中Ca(IO3)2的质量分数___________ (写出计算过程)。

已知:碘酸是易溶于水的强酸,不溶于有机溶剂。碘酸钙晶体溶解度随温度降低而减小。
(1)实验流程“转化”步骤是为了制得碘酸,该过程在下图所示的装置中进行。

①当观察到三颈瓶中溶液
②“转化”时发生反应的
(2)除去HIO3水溶液中少量
 单质的实验操作为
单质的实验操作为a. 萃取分液 b. 趁热过滤 c. 冷却结晶
实验中用
(3)对水层的处理是先用KOH调节pH至10,再在冰水浴中加入CaCl2溶液。
①用KOH溶液调节pH=10的目的是
②采用冰水浴的目的是
(4)准确称取产品0.6000g于烧杯中,高氯酸微热溶解后,冷却,配成250.00ml溶液。移取上述溶液50.00ml置于250ml碘量瓶中,加入高氯酸2mL、3g KI(足量)(发生:
 + 5I- + 6H+ = 3I2 + 3H2O),盖上瓶盖,暗处放置3min,加50mL水,加入淀粉溶液,用0.1000mol/L Na2S2O3溶液滴定(发生:I2 +2
+ 5I- + 6H+ = 3I2 + 3H2O),盖上瓶盖,暗处放置3min,加50mL水,加入淀粉溶液,用0.1000mol/L Na2S2O3溶液滴定(发生:I2 +2 =2I-+
=2I-+ )到终点时消耗12.00ml,试计算产品中Ca(IO3)2的质量分数
)到终点时消耗12.00ml,试计算产品中Ca(IO3)2的质量分数
您最近一年使用:0次
名校
解题方法
4 . 一种以生石灰(CaO)为原料制备KClO3的流程如下:
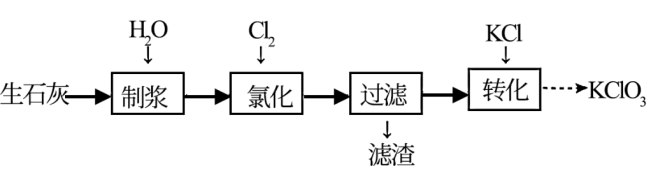
注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(1)制浆过程中发生的化学反应方程式为___________ 。
(2)氯化过程中须缓慢通入Cl2。
①缓慢通入Cl2的目的是___________ 。
②生成Ca(ClO)2的化学方程式为___________ 。
③氯化过程中会有少量无色无味气体生成,该气体可能是___________ (填化学式)。
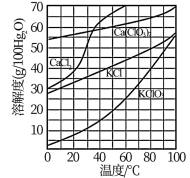
(3)根据如图的溶解度曲线,回答下列问题。
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是___________ 。若溶液中KClO3的含量为100g∙L−1,从该溶液中尽可能多地析出KClO3固体的方法是___________ 。

注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(1)制浆过程中发生的化学反应方程式为
(2)氯化过程中须缓慢通入Cl2。
①缓慢通入Cl2的目的是
②生成Ca(ClO)2的化学方程式为
③氯化过程中会有少量无色无味气体生成,该气体可能是
(3)根据如图的溶解度曲线,回答下列问题。
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是

您最近一年使用:0次
2021-01-27更新
|
278次组卷
|
2卷引用:江苏省盐城市田家炳中学2021-2022学年高一上学期期中考试化学试题
5 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
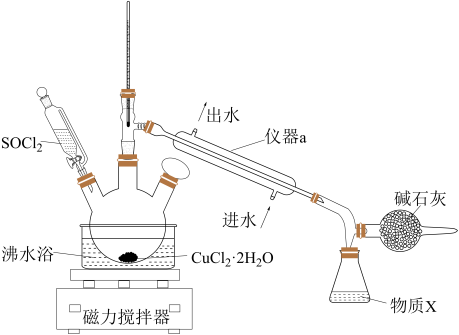
已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑
(1)仪器a的名称是______ ,锥形瓶中得到的物质X的化学式为______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是______ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2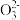 =S4
=S4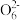 +2I-)。
+2I-)。
①滴定到终点时的现象是______ 。
②该试样中铜元素的百分含量为______ 。

已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2
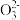 =S4
=S4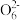 +2I-)。
+2I-)。①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近一年使用:0次
2020-12-30更新
|
189次组卷
|
3卷引用:江苏省马坝高级中学2021-2022学年高二上学期期中考试化学(必修)试题



