解题方法
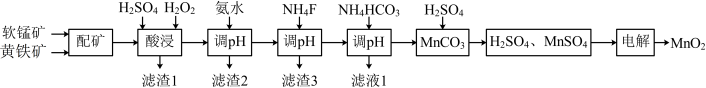
1 . 高品质MnO2可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原料采用“两矿一步浸出法”制备高品质MnO2的某工艺流程如图所示:
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
回答下列问题:
(1)“酸浸”操作中需先后分批加入H2SO4、H2O2。加入H2SO4后发生酸浸过程的主要反应离子方程式为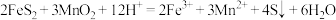 ,
,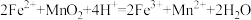 。
。
已知滤渣1的主要成分为S、SiO2、CaSO4等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致H2O2迅速分解的因素是____ 。
(2)加氨水“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为____ (填化学式)。
(3)加NH4F“调pH”时,溶液体系中的Ca2+和Mg2+形成氟化物沉淀。
①若沉淀后上层清液中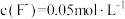 ,则
,则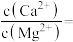
____ 。
②可以用MnF2代替NH4F,以Mg2+为例,结合反应的平衡常数解释能用MnF2除去Mg2+(和Ca2+)的原因是____ 。
(已知:Ksp(MnF2)=5×10-3,Ksp(MgF2)=5×10-11,Ksp(CaF2)=2.5×10-9)
(4)NH4HCO3“调pH”时,发生主要反应的离子方程式为____ 。
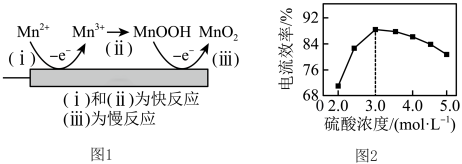
(5)利用惰性电极电解H2SO4—MnSO4—H2O体系获得MnO2的机理(部分)如图1所示,硫酸浓度与电流效率的关系如图2所示。硫酸浓度超过3.0 mol·L−1时,电流效率降低的原因是____ 。 +I2=2I-+
+I2=2I-+ ,计算粗品中MnO2的质量分数
,计算粗品中MnO2的质量分数_______ (写出计算过程)。
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全(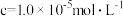 )的pH )的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
(1)“酸浸”操作中需先后分批加入H2SO4、H2O2。加入H2SO4后发生酸浸过程的主要反应离子方程式为
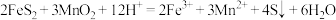 ,
,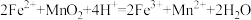 。
。已知滤渣1的主要成分为S、SiO2、CaSO4等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致H2O2迅速分解的因素是
(2)加氨水“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为
(3)加NH4F“调pH”时,溶液体系中的Ca2+和Mg2+形成氟化物沉淀。
①若沉淀后上层清液中
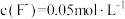 ,则
,则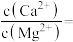
②可以用MnF2代替NH4F,以Mg2+为例,结合反应的平衡常数解释能用MnF2除去Mg2+(和Ca2+)的原因是
(已知:Ksp(MnF2)=5×10-3,Ksp(MgF2)=5×10-11,Ksp(CaF2)=2.5×10-9)
(4)NH4HCO3“调pH”时,发生主要反应的离子方程式为
(5)利用惰性电极电解H2SO4—MnSO4—H2O体系获得MnO2的机理(部分)如图1所示,硫酸浓度与电流效率的关系如图2所示。硫酸浓度超过3.0 mol·L−1时,电流效率降低的原因是
 +I2=2I-+
+I2=2I-+ ,计算粗品中MnO2的质量分数
,计算粗品中MnO2的质量分数
您最近一年使用:0次
名校
2 . 以黄铁矿(主要成分FeS2))为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如下图所示。
(1)煅烧前,黄铁矿需要研磨,目的是___________ 。
(2)煅烧黄铁矿的化学方程式是___________ 。
(3)过程①中处理尾气SO2的离子反应方程式为___________ 。
(4)已知1molSO2(g) 完全转化为1molSO3(g) 放热99kJ,写出SO2催化氧化的热化学方程式___________ 。
(5)因为Na2S2O5在保存过程中易被氧化,导致商品Na2S2O5中存在Na2SO4.欲检验Na2S2O5已变质的实验方法为___________ 。
(6)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):
Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为___________ 。(请写出计算过程)

(1)煅烧前,黄铁矿需要研磨,目的是
(2)煅烧黄铁矿的化学方程式是
(3)过程①中处理尾气SO2的离子反应方程式为
(4)已知1molSO2(g) 完全转化为1molSO3(g) 放热99kJ,写出SO2催化氧化的热化学方程式
(5)因为Na2S2O5在保存过程中易被氧化,导致商品Na2S2O5中存在Na2SO4.欲检验Na2S2O5已变质的实验方法为
(6)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):
Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为
您最近一年使用:0次
3 . 碳酸亚铁(FeCO3)难溶于水,常用于制取铁盐或补血剂。一种FeCO3的制备装置如图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得FeCO3沉淀。______________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是___________ 。
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:__________________ 。
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程_________ 。
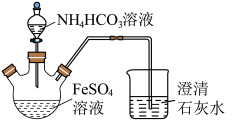
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O
 =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
您最近一年使用:0次
名校
解题方法
4 . 实验室利用 和亚硫酰氯
和亚硫酰氯 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 沸点为
沸点为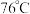 ,遇水极易反应生成两种酸性气体。
,遇水极易反应生成两种酸性气体。
(1)①实验开始先通 ,一段时间后,先加热装置
,一段时间后,先加热装置___________ (填“ ”或“
”或“ ”)。
”)。
装置 内发生反应的化学方程式为
内发生反应的化学方程式为___________ 。
装置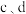 共同起到的作用是
共同起到的作用是___________ 。
②现有含少量杂质的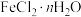 ,为测定
,为测定 值进行如下实验:
值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,滴入
样品,用足量稀硫酸溶解后,滴入 标准溶液
标准溶液 与
与 恰好完全反应(反应过程中
恰好完全反应(反应过程中 化为
化为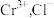 不反应)。
不反应)。
实验Ⅱ:另取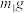 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为 。
。
则
___________ ;下列情况会导致 测量值偏小的是
测量值偏小的是___________ (填标号)。
A.样品中含少量 杂质
杂质
B.样品与 反应时失水不充分
反应时失水不充分
 实验Ⅰ中,称重后样品发生了潮解
实验Ⅰ中,称重后样品发生了潮解
(2)①用上述装置,根据反应 制备
制备 (已知:
(已知: 与
与 互溶,遇水极易反应)。写出
互溶,遇水极易反应)。写出 的电子式
的电子式___________ ,选择合适仪器并组装蒸馏装置对 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧___________ (填序号)。 在焦炭、
在焦炭、 作用下高温煅烧也可制备
作用下高温煅烧也可制备 ,在
,在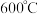 的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
该温度下, 与
与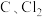 ,反应的总化学方程式为
,反应的总化学方程式为___________ ;
随着温度升高,尾气中 的含量升高,原因是
的含量升高,原因是___________ 。
 和亚硫酰氯
和亚硫酰氯 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 沸点为
沸点为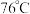 ,遇水极易反应生成两种酸性气体。
,遇水极易反应生成两种酸性气体。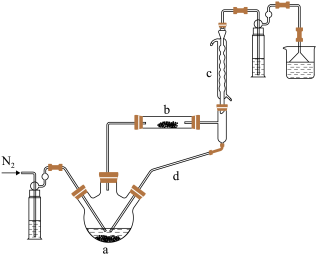
(1)①实验开始先通
 ,一段时间后,先加热装置
,一段时间后,先加热装置 ”或“
”或“ ”)。
”)。装置
 内发生反应的化学方程式为
内发生反应的化学方程式为装置
 共同起到的作用是
共同起到的作用是②现有含少量杂质的
 ,为测定
,为测定 值进行如下实验:
值进行如下实验:实验Ⅰ:称取
 样品,用足量稀硫酸溶解后,滴入
样品,用足量稀硫酸溶解后,滴入 标准溶液
标准溶液 与
与 恰好完全反应(反应过程中
恰好完全反应(反应过程中 化为
化为 不反应)。
不反应)。实验Ⅱ:另取
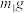 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为 。
。则

 测量值偏小的是
测量值偏小的是A.样品中含少量
 杂质
杂质B.样品与
 反应时失水不充分
反应时失水不充分 实验Ⅰ中,称重后样品发生了潮解
实验Ⅰ中,称重后样品发生了潮解(2)①用上述装置,根据反应
 制备
制备 (已知:
(已知: 与
与 互溶,遇水极易反应)。写出
互溶,遇水极易反应)。写出 的电子式
的电子式 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧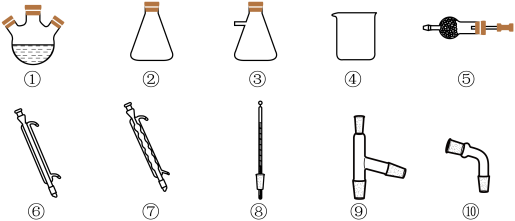
 在焦炭、
在焦炭、 作用下高温煅烧也可制备
作用下高温煅烧也可制备 ,在
,在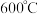 的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:| 物质 |  |  |  |  |
| 体积分数 |  | 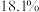 |  |  |
 与
与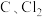 ,反应的总化学方程式为
,反应的总化学方程式为随着温度升高,尾气中
 的含量升高,原因是
的含量升高,原因是
您最近一年使用:0次
名校
5 . 废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得 Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3•(NH4) 2SO4•24H2O]流程设计如下:
回答以下问题:
(1)反应②中H2O2的作用是___________ 。
(2)反应③的离子方程式是________ 。
(3)已知有机物 HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是
2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是_______ 。
(4)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是___________ 。
(5)用滴定法测定制得的 Ce(OH)4 产品纯度。____ 。(填“偏大”、“偏小”或“无影响”)。

回答以下问题:
(1)反应②中H2O2的作用是
(2)反应③的离子方程式是
(3)已知有机物 HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)
 2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是
2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是(4)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是
(5)用滴定法测定制得的 Ce(OH)4 产品纯度。

您最近一年使用:0次
2019-07-17更新
|
215次组卷
|
2卷引用:江苏省无锡市江阴市三校联考2023-2024学年高二下学期4月期中联考化学试题



