1 . 地球海洋是巨大的物质资源宝库,有待于人们进一步开发、利用和保护。氯化钠在海水中的质量分数为2.72%,是海水中含量最多的盐。从远古时代开始,人们就掌握了从海水中获取食盐的方法。近代以来,随着科学技术和化学工业的发展,人们在工业上以氯化钠为原料进一步制备金属钠、氯气、烧碱、碳酸氢钠和碳酸钠,并以氯气、烧碱等为原料进一步从海洋中提取出溴、碘、镁。这些海洋化工产品为化学工业生产体系输送了大量的基础原料,为人类的可持续发展做出了重要贡献。用下列装置模拟侯氏制碱法的部分工艺。下列对于该实验方案的说法不正确 的是
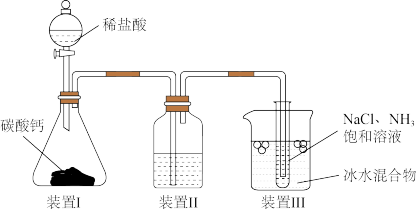

A.装置Ⅰ中使用小颗粒 可加快气体生成 可加快气体生成 |
B.装置Ⅱ中的试剂可使用饱和 溶液 溶液 |
C.装置Ⅲ中使用冰水可促进 析出 析出 |
D.侯氏制碱法可以实现 的循环利用 的循环利用 |
您最近一年使用:0次
名校
解题方法
2 . 工业上电解精炼铜的阳极泥是重要的二次资源,从中间产物分金渣(主要成分为:AgCl、 Ag2S、PbSO4、 BaSO4)中获取高纯银的流程如图所示:
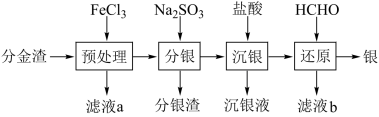
已知:在上述反应的温度下Ksp(AgCl)=1.8×10-10,Ksp(Ag2s)=6.38×10-50,
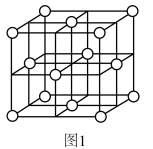
(1)银的一种晶胞如图1所示,银原子周围距离最近且相等的银原子为_______ 。
(2)“预处理”加入FeCl3溶液将Ag2S转化为AgCl。若将AgCl放在KI溶液中振荡,则有部分AgCl转化为AgI。 AgI有α、β、γ三种晶型,其中α- AgI在电场作用下,Ag+不需要克服太大的阻力,就可以发生迁移。因此α- AgI晶体在电池中,可作为_______ 。
(3)已知: Ag+ +2SO = [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=
= [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=_______ 。
(4)“分银”时,[Ag(SO3)2]3-的浓度与溶液pH的关系如图2; SO 及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
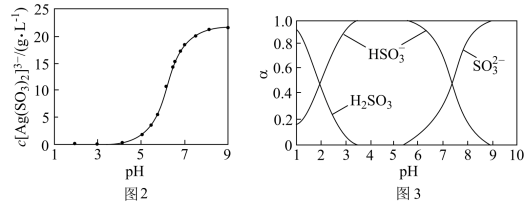
“沉银”时的终点pH需控制在3.5-5.5范围内,不能过低的原因是_______ 。
(5)“还原"时HCHO转化为HCOOH,其化学方程式为_______ 。
(6)已如Ag+ +SCN- =AgSCN↓ (白色),实验室可通过如下过程测定所制银样品的纯度(杂质不参与反应):
①称取制备的银样品1.000g,加适量稀硝酸溶解,定容到100mL容量瓶中。
②准确称取25.00 mL溶液置于锥形瓶中,般化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol / L NH4SCN标准溶液滴定,滴定终点的实验现象为溶液变为(血)红色。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为22. 00mL。则样品中银的质量分数为_______ 。(写出计算过程)

已知:在上述反应的温度下Ksp(AgCl)=1.8×10-10,Ksp(Ag2s)=6.38×10-50,
(1)银的一种晶胞如图1所示,银原子周围距离最近且相等的银原子为

(2)“预处理”加入FeCl3溶液将Ag2S转化为AgCl。若将AgCl放在KI溶液中振荡,则有部分AgCl转化为AgI。 AgI有α、β、γ三种晶型,其中α- AgI在电场作用下,Ag+不需要克服太大的阻力,就可以发生迁移。因此α- AgI晶体在电池中,可作为
(3)已知: Ag+ +2SO
 = [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=
= [Ag(SO3)2]3-, K = 1.0 ×108.68,“分银”时,AgCl与Na2SO3反应生成[Ag(SO3)2]3-,该反应的平衡常数K=(4)“分银”时,[Ag(SO3)2]3-的浓度与溶液pH的关系如图2; SO
 及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
及其与H+形成的微粒的浓度分数α随溶液pH变化的关系如图3。
“沉银”时的终点pH需控制在3.5-5.5范围内,不能过低的原因是
(5)“还原"时HCHO转化为HCOOH,其化学方程式为
(6)已如Ag+ +SCN- =AgSCN↓ (白色),实验室可通过如下过程测定所制银样品的纯度(杂质不参与反应):
①称取制备的银样品1.000g,加适量稀硝酸溶解,定容到100mL容量瓶中。
②准确称取25.00 mL溶液置于锥形瓶中,般化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol / L NH4SCN标准溶液滴定,滴定终点的实验现象为溶液变为(血)红色。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为22. 00mL。则样品中银的质量分数为
您最近一年使用:0次
2022-12-29更新
|
409次组卷
|
3卷引用:江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题
江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(17-20)陕西师范大学附属中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
3 . 高氯酸铵 是复合火箭推进剂的重要成分,实验室可通过下列反应制取。
是复合火箭推进剂的重要成分,实验室可通过下列反应制取。

(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为___________ 。

(2)反应得到的混合溶液中 和
和 的质量分数分别为
的质量分数分别为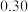 和
和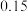 ,从混合溶液中获得较多
,从混合溶液中获得较多 晶体的实验操作依次为(填操作名称)
晶体的实验操作依次为(填操作名称)___________ 、___________ 、___________ 、冰水洗涤、干燥。用冰水洗涤的目的是___________ 。
若氯化铵溶液用氨气和浓盐酸代替,则该反应不需要加热就能进行,其原因是___________ 。
 是复合火箭推进剂的重要成分,实验室可通过下列反应制取。
是复合火箭推进剂的重要成分,实验室可通过下列反应制取。
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为

(2)反应得到的混合溶液中
 和
和 的质量分数分别为
的质量分数分别为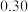 和
和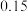 ,从混合溶液中获得较多
,从混合溶液中获得较多 晶体的实验操作依次为(填操作名称)
晶体的实验操作依次为(填操作名称)若氯化铵溶液用氨气和浓盐酸代替,则该反应不需要加热就能进行,其原因是
您最近一年使用:0次
名校
解题方法
4 . 草酸及其化合物在工业中有重要作用,例如:草酸可用于除铁锈,反应的离子方程式为: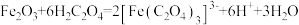 ;草酸铁铵
;草酸铁铵 是一种常用的金属着色剂。
是一种常用的金属着色剂。
(1)草酸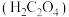 是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示

① 时,装置A中生成
时,装置A中生成 ,同时生成
,同时生成 。写出该反应的化学方程式
。写出该反应的化学方程式_____________ 。
②该实验中催化剂浓硫酸用量不宜过量的原因是_____________ 。
(2)草酸铁铵晶体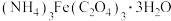 易溶于水,常温下其水溶
易溶于水,常温下其水溶 为4.0~5.0。制备草酸铁铵晶体的实验方案为:边搅拌边向
为4.0~5.0。制备草酸铁铵晶体的实验方案为:边搅拌边向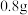 氧化铁中
氧化铁中_____________ 。(须用的试剂为 、
、 氨水、无水乙醇)
氨水、无水乙醇)
(3)为测定草酸铁铵晶体 的纯度,进行下列实验:称取样品
的纯度,进行下列实验:称取样品 ,加稀硫酸溶解后,配成
,加稀硫酸溶解后,配成 溶液。取
溶液。取 配制的溶液,用浓度为
配制的溶液,用浓度为 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知: (未配平)
(未配平)
通过计算,确定样品中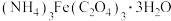 的质量分数
的质量分数_____________ (写出计算过程)。
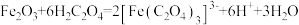 ;草酸铁铵
;草酸铁铵 是一种常用的金属着色剂。
是一种常用的金属着色剂。(1)草酸
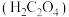 是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
是一种弱酸,不稳定,受热或遇浓硫酸会发生分解。在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,实验装置如图所示
①
 时,装置A中生成
时,装置A中生成 ,同时生成
,同时生成 。写出该反应的化学方程式
。写出该反应的化学方程式②该实验中催化剂浓硫酸用量不宜过量的原因是
(2)草酸铁铵晶体
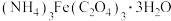 易溶于水,常温下其水溶
易溶于水,常温下其水溶 为4.0~5.0。制备草酸铁铵晶体的实验方案为:边搅拌边向
为4.0~5.0。制备草酸铁铵晶体的实验方案为:边搅拌边向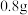 氧化铁中
氧化铁中 、
、 氨水、无水乙醇)
氨水、无水乙醇)(3)为测定草酸铁铵晶体
 的纯度,进行下列实验:称取样品
的纯度,进行下列实验:称取样品 ,加稀硫酸溶解后,配成
,加稀硫酸溶解后,配成 溶液。取
溶液。取 配制的溶液,用浓度为
配制的溶液,用浓度为 的
的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:
 (未配平)
(未配平)通过计算,确定样品中
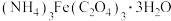 的质量分数
的质量分数
您最近一年使用:0次
2022-11-06更新
|
291次组卷
|
2卷引用:江苏省南京市南京第一中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
5 . 三氯化铬( )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以 为原料制备
为原料制备 和
和 。
。
(1)制备 。取一定质量的
。取一定质量的 和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。
①上述反应的化学方程式为_______ 。
②上述反应中的乙醇与 投料的物质的量比例大约为3:8,原因是
投料的物质的量比例大约为3:8,原因是_______ 。
(2)测定 的质量分数。
的质量分数。
Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。
Ⅲ.加入1mL淀粉溶液,用0.0250 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。
已知反应:
 (未配平)
(未配平)
 (未配平)
(未配平)
①滴定终点的现象是_______ 。
②计算 的质量分数(写出计算过程)
的质量分数(写出计算过程)_______ 。
(3)制备 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。

请补充完整由 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液,_______ ,低温烘干,得到 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
 )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以 为原料制备
为原料制备 和
和 。
。(1)制备
 。取一定质量的
。取一定质量的 和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。①上述反应的化学方程式为
②上述反应中的乙醇与
 投料的物质的量比例大约为3:8,原因是
投料的物质的量比例大约为3:8,原因是(2)测定
 的质量分数。
的质量分数。Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的
 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。Ⅲ.加入1mL淀粉溶液,用0.0250
 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。已知反应:
 (未配平)
(未配平) (未配平)
(未配平)①滴定终点的现象是
②计算
 的质量分数(写出计算过程)
的质量分数(写出计算过程)(3)制备
 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
请补充完整由
 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液, 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
您最近一年使用:0次
2022-11-04更新
|
331次组卷
|
2卷引用:江苏省苏州市2022-2023学年高三上学期期中调研化学试题
解题方法
6 . 以废锌铁合金(含Zn、ZnO及少量Fe、 、Cu、CuO和油污)为原料制备
、Cu、CuO和油污)为原料制备 的流程如下:
的流程如下:
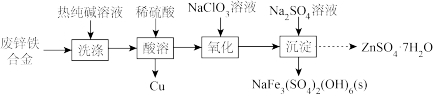
(1)“洗涤”的目的是_______ 。
(2)“酸溶”所得滤液中不含 ,证明滤液中不含
,证明滤液中不含 的实验操作为
的实验操作为_______ 。
(3)“氧化”过程控制体系温度为80℃的方法是_______ 。“氧化”后的溶液中,阳离子有_______ 。
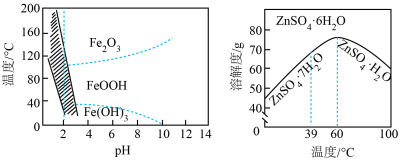
(4)三价铁在不同温度和pH下沉淀的形式如左图所示,图中阴影部分是黄铁矾钠[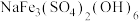 ]稳定存在的区域;硫酸锌溶解度曲线如右图所示。
]稳定存在的区域;硫酸锌溶解度曲线如右图所示。
已知: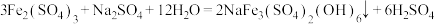
以“氧化”后所得溶液制备 的方案如下:
的方案如下:
在80℃下,用pH计测定“氧化”后所得溶液的pH为4.1,滴加_______ 调节溶液pH至2.0;边搅拌边向溶液中滴加1.0
 溶液同时用1.0
溶液同时用1.0 NaOH溶液控制溶液pH保持在2.0左右,产生大量沉淀;
NaOH溶液控制溶液pH保持在2.0左右,产生大量沉淀;_______ ,停止滴加1.0
 溶液;趁热过滤;将滤液在80℃下蒸发浓缩至有晶膜出现,降温至60℃,
溶液;趁热过滤;将滤液在80℃下蒸发浓缩至有晶膜出现,降温至60℃,_______ ,冷却至室温,过滤,冷水洗涤,低温干燥得产品 。
。
实验中可选用的试剂:1.0
 溶液、1.0
溶液、1.0 HCl溶液、1.0
HCl溶液、1.0 NaOH溶液、1.0
NaOH溶液、1.0
 溶液。
溶液。
(5)取1.800g 样品配成100.00mL溶液,准确量取10.00mL溶液于锥形瓶中,加30mL蒸馏水稀释;然后滴加氨水调节溶液pH=10,用0.01500
样品配成100.00mL溶液,准确量取10.00mL溶液于锥形瓶中,加30mL蒸馏水稀释;然后滴加氨水调节溶液pH=10,用0.01500 EDTA(
EDTA( )标准溶液滴定至终点(滴定反应为
)标准溶液滴定至终点(滴定反应为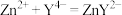 ,平行滴定3次,平均消耗EDTA溶液35.00mL。计算
,平行滴定3次,平均消耗EDTA溶液35.00mL。计算 样品中
样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)_______ 。
 、Cu、CuO和油污)为原料制备
、Cu、CuO和油污)为原料制备 的流程如下:
的流程如下:
(1)“洗涤”的目的是
(2)“酸溶”所得滤液中不含
 ,证明滤液中不含
,证明滤液中不含 的实验操作为
的实验操作为(3)“氧化”过程控制体系温度为80℃的方法是
(4)三价铁在不同温度和pH下沉淀的形式如左图所示,图中阴影部分是黄铁矾钠[
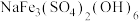 ]稳定存在的区域;硫酸锌溶解度曲线如右图所示。
]稳定存在的区域;硫酸锌溶解度曲线如右图所示。
已知:
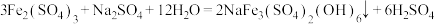
以“氧化”后所得溶液制备
 的方案如下:
的方案如下:在80℃下,用pH计测定“氧化”后所得溶液的pH为4.1,滴加

 溶液同时用1.0
溶液同时用1.0 NaOH溶液控制溶液pH保持在2.0左右,产生大量沉淀;
NaOH溶液控制溶液pH保持在2.0左右,产生大量沉淀;
 溶液;趁热过滤;将滤液在80℃下蒸发浓缩至有晶膜出现,降温至60℃,
溶液;趁热过滤;将滤液在80℃下蒸发浓缩至有晶膜出现,降温至60℃, 。
。实验中可选用的试剂:1.0

 溶液、1.0
溶液、1.0 HCl溶液、1.0
HCl溶液、1.0 NaOH溶液、1.0
NaOH溶液、1.0
 溶液。
溶液。(5)取1.800g
 样品配成100.00mL溶液,准确量取10.00mL溶液于锥形瓶中,加30mL蒸馏水稀释;然后滴加氨水调节溶液pH=10,用0.01500
样品配成100.00mL溶液,准确量取10.00mL溶液于锥形瓶中,加30mL蒸馏水稀释;然后滴加氨水调节溶液pH=10,用0.01500 EDTA(
EDTA( )标准溶液滴定至终点(滴定反应为
)标准溶液滴定至终点(滴定反应为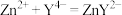 ,平行滴定3次,平均消耗EDTA溶液35.00mL。计算
,平行滴定3次,平均消耗EDTA溶液35.00mL。计算 样品中
样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次
解题方法
7 . 过氧化钙是一种优良供氧剂。工业用储量丰富的大理石(主要成分 ,含有少量的
,含有少量的 、
、 、
、 、
、 等杂质)制备
等杂质)制备 的过程如下:
的过程如下:

Ⅰ.过氧化钙的制取
(1)滤渣1的主要成分是_______ (填写物质名称)。
(2)“沉淀1”加入氨水的主要目的是_______ 。
(3)“沉淀2”生成 的离子方程式为
的离子方程式为_______ ;此反应常用冰水浴控制温度在 左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高
左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高 的产率;其二,
的产率;其二,_______ 。
(4)用冰水洗涤 的方法是
的方法是_______ 。
Ⅱ.过氧化钙含量的测定
(5)称量 样品加入一定量
样品加入一定量 硫酸配成溶液,并立即与
硫酸配成溶液,并立即与 酸性
酸性 标准溶液反应。消耗
标准溶液反应。消耗 ,计算样品中
,计算样品中 的质量分数。(已知:
的质量分数。(已知: ,
,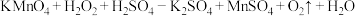 )
)_______ (请写出解题过程)。
 ,含有少量的
,含有少量的 、
、 、
、 、
、 等杂质)制备
等杂质)制备 的过程如下:
的过程如下:
Ⅰ.过氧化钙的制取
(1)滤渣1的主要成分是
(2)“沉淀1”加入氨水的主要目的是
(3)“沉淀2”生成
 的离子方程式为
的离子方程式为 左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高
左右,其可能的原因分析:其一,该反应是放热反应,温度低有利于提高 的产率;其二,
的产率;其二,(4)用冰水洗涤
 的方法是
的方法是Ⅱ.过氧化钙含量的测定
(5)称量
 样品加入一定量
样品加入一定量 硫酸配成溶液,并立即与
硫酸配成溶液,并立即与 酸性
酸性 标准溶液反应。消耗
标准溶液反应。消耗 ,计算样品中
,计算样品中 的质量分数。(已知:
的质量分数。(已知: ,
,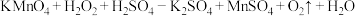 )
)
您最近一年使用:0次
解题方法
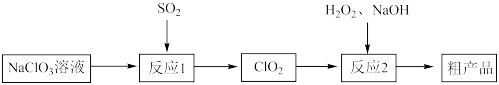
8 . 以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下:_______ (填化学式)。
②每有1mol NaClO3参加反应,理论上可生成ClO2的物质的量为_______ mol。
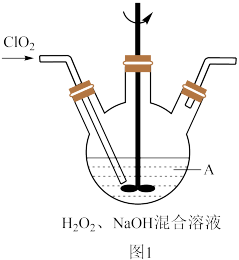
(2)反应2在如图1装置中发生(该反应放出大量的热,且温度高于60℃时NaClO2分解生成NaClO3和NaCl)_______ 。
②实际反应中发现消耗的NaOH比理论值偏少,原因可能是_______ 。
③通常会将该装置放置于冰水浴中,其目的是_______ 。
a.提高ClO2吸收率 b.防止NaClO2分解 c.提高反应速度
(3)ClO2是一种广谱型消毒剂,对一切经水体传播的病原微生物均有很好的杀灭效果。用ClO2处理过的水中ClO2、 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 或Cl-的转化率与溶液的
或Cl-的转化率与溶液的 关系如图2所示。
关系如图2所示。
滴定步骤:①准确量取100mL水样加到碘量瓶中,调节水样的 为
为 ,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0,
,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0, 可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
根据上述数据,测得该水样中的 浓度是多少
浓度是多少_____ ?
②每有1mol NaClO3参加反应,理论上可生成ClO2的物质的量为
(2)反应2在如图1装置中发生(该反应放出大量的热,且温度高于60℃时NaClO2分解生成NaClO3和NaCl)
②实际反应中发现消耗的NaOH比理论值偏少,原因可能是
③通常会将该装置放置于冰水浴中,其目的是
a.提高ClO2吸收率 b.防止NaClO2分解 c.提高反应速度
(3)ClO2是一种广谱型消毒剂,对一切经水体传播的病原微生物均有很好的杀灭效果。用ClO2处理过的水中ClO2、
 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 或Cl-的转化率与溶液的
或Cl-的转化率与溶液的 关系如图2所示。
关系如图2所示。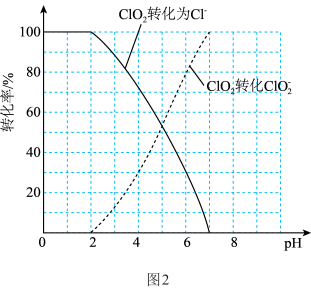
滴定步骤:①准确量取100mL水样加到碘量瓶中,调节水样的
 为
为 ,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0,
,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0, 可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。根据上述数据,测得该水样中的
 浓度是多少
浓度是多少
您最近一年使用:0次
9 . 过二硫酸盐具有强氧化性,可作氧化剂和漂白剂。MnO2是一种重要的化工试剂,在合成工业用途广泛。
Ⅰ.过二硫酸钠(Na2S2O8)也叫做高硫酸钠,可用于废气处理及有害物质氧化降解。用过二硫酸铵[(NH4)2S2O8]溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体。同时还会放出氨气。某化学兴趣小组在实验室模拟制备Na2S2O8晶体(装置如图-1所示)。

已知:反应过程中发生的副反应为:2NH3+3Na2S2O8+ 6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)反应过程中持续通入N2目的是_______ 。
(2)过二硫酸盐的性质及应用。
①Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,该物质的电子式为_______ 。
②过二硫酸铵可用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(Cr2O ) ,写出该反应的离子方程式:
) ,写出该反应的离子方程式:_______ 。
Ⅱ.由软锰矿(主要成分为MnO2,主要杂质有Al2O3和SiO2),制备MnO2的一种工艺流程如图:

已知:该工艺条件下,MnO2和H2SO4不反应,MnO2的氧化性随酸性的减弱而减弱。
(3)上述流程中可循环利用的物有_______ 。 (写化学式)
(4)纯化时需要加入的试剂有MnO2和NH3·H2O。加入的顺序为_______ 。
A.先加入MnO2,后加入NH3·H2O B.先加入NH3·H2O,后加入MnO2
(5)已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量( )与NaOH和MnSO4物质的量比值之间的关系如图-2所示:
)与NaOH和MnSO4物质的量比值之间的关系如图-2所示:

根据信息,补充完整制取纯净MnO2的实验方案:将40mL 1.0mol / L的MnSO4溶液和40mL 1.0mol / L的K2S2O8溶液混合,_______ ,干燥,得到纯净的MnO2(实验中须使用的试剂是1.0mol / L NaOH溶液、1.0 mol / L H2SO4溶液、1.0mol / L BaCl2溶液、蒸馏水)
Ⅰ.过二硫酸钠(Na2S2O8)也叫做高硫酸钠,可用于废气处理及有害物质氧化降解。用过二硫酸铵[(NH4)2S2O8]溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体。同时还会放出氨气。某化学兴趣小组在实验室模拟制备Na2S2O8晶体(装置如图-1所示)。

已知:反应过程中发生的副反应为:2NH3+3Na2S2O8+ 6NaOH
 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2(1)反应过程中持续通入N2目的是
(2)过二硫酸盐的性质及应用。
①Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,该物质的电子式为
②过二硫酸铵可用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(Cr2O
 ) ,写出该反应的离子方程式:
) ,写出该反应的离子方程式:Ⅱ.由软锰矿(主要成分为MnO2,主要杂质有Al2O3和SiO2),制备MnO2的一种工艺流程如图:

已知:该工艺条件下,MnO2和H2SO4不反应,MnO2的氧化性随酸性的减弱而减弱。
(3)上述流程中可循环利用的物有
(4)纯化时需要加入的试剂有MnO2和NH3·H2O。加入的顺序为
A.先加入MnO2,后加入NH3·H2O B.先加入NH3·H2O,后加入MnO2
(5)已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量(
 )与NaOH和MnSO4物质的量比值之间的关系如图-2所示:
)与NaOH和MnSO4物质的量比值之间的关系如图-2所示:
根据信息,补充完整制取纯净MnO2的实验方案:将40mL 1.0mol / L的MnSO4溶液和40mL 1.0mol / L的K2S2O8溶液混合,
您最近一年使用:0次
名校
10 . 高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:K2FeO4为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下:

(1) KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
①浓盐酸在反应中显示出来的性质是_______ 。
②如图装置中有一处明显的错误是_______ 。
(2)C中得到紫色固体和溶液。C中Cl2发生的反应有2Fe(OH)3+3Cl2+10KOH =2K2FeO4+6KCl+8H2O。另外还有_______ 。(用离子方程式表示)
(3)探究 K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计如下方案:
方案一:取少量a,滴加KSCN溶液至过量,溶液呈血红色
方案二:用KOH溶液充分洗涤C中所得固体,除去固体表面附着的ClO-,防止其氧化Cl-,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。
①由方案一中溶液变红可知a中含有Fe3+,但该离子的产生不能判断一定是K2FeO4将Cl-氧化所得,还可能由_______ 产生(文字描述)。
②根据K2FeO4的制备实验得出:氧化性Cl2大于 ,而方案二实验中Cl2和
,而方案二实验中Cl2和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是_______ 。
(4)有一种“地康法”制取氯气的反应原理如图所示:

①在450℃条件下,反应II的化学方程式为_______ 。
②工业生产中常用氨气(NH3)检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式____ 。

(1) KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
①浓盐酸在反应中显示出来的性质是
②如图装置中有一处明显的错误是
(2)C中得到紫色固体和溶液。C中Cl2发生的反应有2Fe(OH)3+3Cl2+10KOH =2K2FeO4+6KCl+8H2O。另外还有
(3)探究 K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计如下方案:
方案一:取少量a,滴加KSCN溶液至过量,溶液呈血红色
方案二:用KOH溶液充分洗涤C中所得固体,除去固体表面附着的ClO-,防止其氧化Cl-,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。
①由方案一中溶液变红可知a中含有Fe3+,但该离子的产生不能判断一定是K2FeO4将Cl-氧化所得,还可能由
②根据K2FeO4的制备实验得出:氧化性Cl2大于
 ,而方案二实验中Cl2和
,而方案二实验中Cl2和 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是(4)有一种“地康法”制取氯气的反应原理如图所示:

①在450℃条件下,反应II的化学方程式为
②工业生产中常用氨气(NH3)检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式
您最近一年使用:0次



