名校
1 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
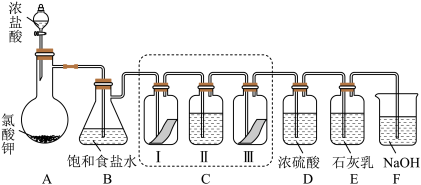
(1)用“双线桥”标出A中反应电子转移的方向和数目_______ 。
(2)B装置作用_______ 。
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III依次放入的物质正确的是_______ (填编号)。
(4)为测定所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_______ ,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_______ (用含a、b的式子表示)。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)用“双线桥”标出A中反应电子转移的方向和数目
(2)B装置作用
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III依次放入的物质正确的是
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
您最近一年使用:0次
名校
2 . 以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:_________ 。
(2)向溶液1中加入过量铁粉的目的是_____________ 。
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是___________ 。
(4)实验室制备乳酸亚铁的装置如图1所示。________ 。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是______________ 。
(5)已知:①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图2、3所示。______ 。
(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。

(2)向溶液1中加入过量铁粉的目的是
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是
(4)实验室制备乳酸亚铁的装置如图1所示。
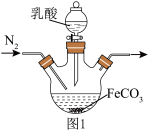
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是
(5)已知:①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图2、3所示。
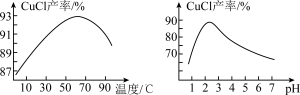
(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。
您最近一年使用:0次
2019-03-28更新
|
703次组卷
|
5卷引用:【全国百强校】江苏省启东中学2018-2019学年高二(创新班)下学期期中考试化学试题
名校
解题方法
3 . 常温下,青蒿素是一种无色针状晶体,易溶于有机溶剂,难溶于水,熔点约为156.5℃,易受湿、热的影响而分解。某实验小组对青蒿素的提取和组成进行了探究。
Ⅰ.提取流程:

(1)“破碎”的目的是________________ 。
(2) 操作a和操作b的名称分别是____________ 、____________ 。
Ⅱ.燃烧法测定最简式:
实验室用如图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。
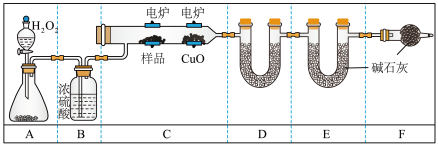
(3) A装置是提供实验所需的O2,B装置中浓硫酸的作用是_______________ ;C中CuO的作用是______________________ 。
(4) 燃烧m g青蒿素,图中D(装无水CaCl2)、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为_________ (只写计算式,用含有m、a、b的符号来表示,可不化简)。
(5)该装置也可以用来测其他有机物的最简式。
准确称取9.0 g某烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加9.0g,E管质量增加17.6 g,则该有机物的实验式是_______ ,能不能确定分子式 ___________ (能确定写出分子式,不能确定填“否”)
Ⅰ.提取流程:

(1)“破碎”的目的是
(2) 操作a和操作b的名称分别是
Ⅱ.燃烧法测定最简式:
实验室用如图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。

(3) A装置是提供实验所需的O2,B装置中浓硫酸的作用是
(4) 燃烧m g青蒿素,图中D(装无水CaCl2)、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为
(5)该装置也可以用来测其他有机物的最简式。
准确称取9.0 g某烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加9.0g,E管质量增加17.6 g,则该有机物的实验式是
您最近一年使用:0次
2020-11-19更新
|
253次组卷
|
2卷引用:云南省玉溪第一中学2020-2021学年高二上学期期中考试化学试题
4 . 亚硝基硫酸(NOSO4H)是染料工艺中重要的原料。
Ⅰ.实验室将SO2通入浓硝酸和浓硫酸的混酸中可制备亚硝基硫酸,装置如图。C中主要发生反应:SO2+HNO3===SO3+HNO2;SO3+HNO2===NOSO4H。

(1)为了使C中反应充分,通入SO2的速率不能过快,可采取的措施是__________________ 。
(2)D装置的作用是____________________ 。
Ⅱ.产品中亚硝基硫酸质量分数的测定
称取1.700g产品放入250mL的锥形瓶中,加入100.00mL0.1000mol/L的KMnO4溶液和少量稀H2SO4,发生反应:2KMnO4+5NOSO4H+2H2O===K2SO4+2MnSO4+5HNO3+2H2SO4,产品中其他杂质不与KMnO4反应。反应完全后,用0.5000mol/L的Na2C2O4标准溶液滴定过量的KMnO4,发生反应:2 +5
+5 +16H+===2Mn2++8H2O+10CO2↑,消耗Na2C2O4标准溶液30.00mL.
+16H+===2Mn2++8H2O+10CO2↑,消耗Na2C2O4标准溶液30.00mL.
(1)配制100mL0.1000mol/L的KMnO4溶液所需要的玻璃仪器有量筒、烧杯、胶头滴管、玻璃棒、________ 。
(2)Na2C2O4标准溶液应盛放在如图所示的滴定管____________ 中(填“A”或“B”)。滴定终点的现象是________________ 。

(3)若滴定终点时俯视滴定管刻度,则由此测得产品中亚硝基硫酸的质量分数会______________ (填“偏大”、“偏小”或“不变”)。
(4)确定产品中亚硝基硫酸的质量分数______________ ,写出计算过程。
Ⅰ.实验室将SO2通入浓硝酸和浓硫酸的混酸中可制备亚硝基硫酸,装置如图。C中主要发生反应:SO2+HNO3===SO3+HNO2;SO3+HNO2===NOSO4H。

(1)为了使C中反应充分,通入SO2的速率不能过快,可采取的措施是
(2)D装置的作用是
Ⅱ.产品中亚硝基硫酸质量分数的测定
称取1.700g产品放入250mL的锥形瓶中,加入100.00mL0.1000mol/L的KMnO4溶液和少量稀H2SO4,发生反应:2KMnO4+5NOSO4H+2H2O===K2SO4+2MnSO4+5HNO3+2H2SO4,产品中其他杂质不与KMnO4反应。反应完全后,用0.5000mol/L的Na2C2O4标准溶液滴定过量的KMnO4,发生反应:2
 +5
+5 +16H+===2Mn2++8H2O+10CO2↑,消耗Na2C2O4标准溶液30.00mL.
+16H+===2Mn2++8H2O+10CO2↑,消耗Na2C2O4标准溶液30.00mL.(1)配制100mL0.1000mol/L的KMnO4溶液所需要的玻璃仪器有量筒、烧杯、胶头滴管、玻璃棒、
(2)Na2C2O4标准溶液应盛放在如图所示的滴定管

(3)若滴定终点时俯视滴定管刻度,则由此测得产品中亚硝基硫酸的质量分数会
(4)确定产品中亚硝基硫酸的质量分数
您最近一年使用:0次
2020-11-18更新
|
382次组卷
|
5卷引用:江苏省南京市 2020-2021学年高二上学期期中调研考试化学试题
名校
5 . 实验室模拟工业上用直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4) ](n>2,m≤10)的实验流程如图:
](n>2,m≤10)的实验流程如图:

已知:盐基度 ×100%,式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为8.0%~16.0%。
×100%,式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为8.0%~16.0%。
(1)聚合硫酸铁中,铁元素价态_____ ,实验中 FeSO4·7H2O溶解时加入硫酸的作用是__________ 。
(2)调pH时,如将pH试纸先润湿,则测得pH值____________ ;若溶液的pH偏低,将导致聚合硫酸铁中铁元素质量分数___________ (均填“偏高”、“偏低”、“无影响”“不确定”)。
(3)聚合反应的原理为m[Fe2(OH)n(SO4) ]⇌[Fe2(OH)n(SO4)
]⇌[Fe2(OH)n(SO4) ]m,则Fe2(SO4)3通过水解反应生成Fe2(OH)n(SO4)
]m,则Fe2(SO4)3通过水解反应生成Fe2(OH)n(SO4) 的化学方程式为
的化学方程式为___________ 。
(4)产品盐基度的测定方法:
I.称取m g固体试样,置于40 mL聚乙场烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿;
II.室温下放置l0 min,再加入l0 mL氟化钾宿波,摇匀,掩蔽Fe3+, 形成白色沉淀;
III.加入了酚酞指示剂,立即用物质的最浓度为c mol/L的凯氧化钠标准液清定至终点,消耗体积为V mL;
IV.向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上衣面血然后重复II、III做空白试验,消耗氢氧化钠标准准液的体积为V0 mL。已知试样中Fe3+的质量分数为a,则该试样的盐那度的计算表达式为_________ 。
 ](n>2,m≤10)的实验流程如图:
](n>2,m≤10)的实验流程如图:
已知:盐基度
 ×100%,式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为8.0%~16.0%。
×100%,式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为8.0%~16.0%。(1)聚合硫酸铁中,铁元素价态
(2)调pH时,如将pH试纸先润湿,则测得pH值
(3)聚合反应的原理为m[Fe2(OH)n(SO4)
 ]⇌[Fe2(OH)n(SO4)
]⇌[Fe2(OH)n(SO4) ]m,则Fe2(SO4)3通过水解反应生成Fe2(OH)n(SO4)
]m,则Fe2(SO4)3通过水解反应生成Fe2(OH)n(SO4) 的化学方程式为
的化学方程式为(4)产品盐基度的测定方法:
I.称取m g固体试样,置于40 mL聚乙场烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿;
II.室温下放置l0 min,再加入l0 mL氟化钾宿波,摇匀,掩蔽Fe3+, 形成白色沉淀;
III.加入了酚酞指示剂,立即用物质的最浓度为c mol/L的凯氧化钠标准液清定至终点,消耗体积为V mL;
IV.向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上衣面血然后重复II、III做空白试验,消耗氢氧化钠标准准液的体积为V0 mL。已知试样中Fe3+的质量分数为a,则该试样的盐那度的计算表达式为
您最近一年使用:0次
名校
解题方法
6 . 某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___ (填元素符号)。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___ 。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___ 。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___ (“偏大”、“偏小”或“无影响”),原因是___ 。
②通过计算,该样品中NaNO2的质量分数是___ ,可能含有的杂质有___ (写出其中一种即可)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___ 。

Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度
②通过计算,该样品中NaNO2的质量分数是
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是
您最近一年使用:0次
2020-06-05更新
|
126次组卷
|
3卷引用:【市级联考】江苏省高邮市2018-2019学年高一下学期期中考试调研(选修)化学试题
名校
7 . 聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。该过程中反应温度不宜过高,原因是_______ ;H2O2氧化Fe2+的离子方程式为________ 。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2mol·L−1K2Cr2O7溶液滴定至终点(滴定过程中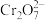 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将_______ (填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____________ 。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。该过程中反应温度不宜过高,原因是
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2mol·L−1K2Cr2O7溶液滴定至终点(滴定过程中
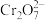 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将
②计算该样品中铁的质量分数(写出计算过程)
您最近一年使用:0次
8 . 水是生命之源。从某些方面看,NH3与H2O 相当,NH4+ 和H3O+(常简写为 H+ )相当;NH2-和OH-相当;NH2-(有时还包括 N3-)和 O2-相当。
(1)已知 Ca + 2H2O = Ca (OH)2 + H2↑,Ca 与液氨反应生成 H2 和______ (填生成物的化学式)。
(2)-78℃时,NH3 和 PCl3 在某种溶剂中发生复分解反应生成一种含磷化合物 A(摩尔质量 为 79 g/mol)。A 不稳定,易分解为黄色物质B,B中磷的质量分数为 68.89%。写出 A 分解为 B 的化学方程式:______________ 。
(1)已知 Ca + 2H2O = Ca (OH)2 + H2↑,Ca 与液氨反应生成 H2 和
(2)-78℃时,NH3 和 PCl3 在某种溶剂中发生复分解反应生成一种含磷化合物 A(摩尔质量 为 79 g/mol)。A 不稳定,易分解为黄色物质B,B中磷的质量分数为 68.89%。写出 A 分解为 B 的化学方程式:
您最近一年使用:0次
名校
9 . 废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得 Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3•(NH4) 2SO4•24H2O]流程设计如下:
回答以下问题:
(1)反应②中H2O2的作用是___________ 。
(2)反应③的离子方程式是________ 。
(3)已知有机物 HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是
2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是_______ 。
(4)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是___________ 。
(5)用滴定法测定制得的 Ce(OH)4 产品纯度。____ 。(填“偏大”、“偏小”或“无影响”)。

回答以下问题:
(1)反应②中H2O2的作用是
(2)反应③的离子方程式是
(3)已知有机物 HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)
 2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是
2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是(4)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是
(5)用滴定法测定制得的 Ce(OH)4 产品纯度。

您最近一年使用:0次
2019-07-17更新
|
215次组卷
|
2卷引用:江苏省无锡市江阴市三校联考2023-2024学年高二下学期4月期中联考化学试题
名校
10 . 纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:

请回答下列问题:
①析出的NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是_______________________________________________________________________ 。
②向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是_______________________________________________________________________ 。
③该工艺流程中可回收再利用的物质是________________ 。
④若制得的纯碱中只含有杂质NaCl。测定该纯碱的纯度,下列方案中可行 的是________ (填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
(2)常温下在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液20 mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。

根据图示回答下列问题:
①在同一溶液中,CO32-、HCO3-、H2CO3________ (填“能”或“不能”)大量共存。
②在滴加盐酸的过程中HCO3-的物质的量先增加后减少的原因是_____________ 、________ (请分别用离子方程式表示)。
③将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.10 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是___________ (填字母)。
A. B.
B. 
C. D.
D. 
(3)若称取10.5 g纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为8.02 g。如果把剩余的固体全部加入到100 mL 2 mol·L-1的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度(设溶液的体积变化及盐酸的挥发忽略不计)(写出计算过程)。___________
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O
 NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
请回答下列问题:
①析出的NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是
②向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是
③该工艺流程中可回收再利用的物质是
④若制得的纯碱中只含有杂质NaCl。测定该纯碱的纯度,下列方案中
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
(2)常温下在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液20 mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。

根据图示回答下列问题:
①在同一溶液中,CO32-、HCO3-、H2CO3
②在滴加盐酸的过程中HCO3-的物质的量先增加后减少的原因是
③将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.10 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
A.
 B.
B. 
C.
 D.
D. 
(3)若称取10.5 g纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为8.02 g。如果把剩余的固体全部加入到100 mL 2 mol·L-1的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度(设溶液的体积变化及盐酸的挥发忽略不计)(写出计算过程)。
您最近一年使用:0次



