名校
1 . 某实验小组用两种不同的方法测定已部分变质的亚硫酸钠样品的纯度。
方案一:实验流程如下
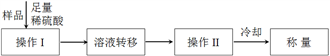
(1)简述检验亚硫酸钠样品已经变质的方法________________________________ 。
(2)操作Ⅱ的名称是________ ,整个实验过程中需要用到的仪器主要有烧杯、玻璃棒、干燥器、酒精灯、石棉网、_________ 、________ (固定、夹持仪器除外)。
(3)能证明冷却后称量的质量已达恒重的依据是_______________________________ 。
方案二:下图,Y管左侧装亚硫酸钠样品,右侧装较浓硫酸,相互接触即可反应产生SO2,通过测定SO2体积来测定样品中Na2SO3含量。
(4)如图,加入试剂之前须进行的操作是________ ;反应不用稀硫酸原因_________ ,为减小实验误差,量气管中液体M可用_________ 。
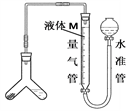
(5)若样品的质量为ag,加入10mL较浓硫酸充分反应后,测得排出液体的体积为VL(标准状况下),则样品中Na2SO3的质量分数的计算式为_________________________ 。
(6)若实验结果测得该样品中Na2SO3含量偏低,原因可能是_________ (选填编号)
a.硫酸不足量
b.测定气体体积时未冷却至室温
c.Y形管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
方案一:实验流程如下

(1)简述检验亚硫酸钠样品已经变质的方法
(2)操作Ⅱ的名称是
(3)能证明冷却后称量的质量已达恒重的依据是
方案二:下图,Y管左侧装亚硫酸钠样品,右侧装较浓硫酸,相互接触即可反应产生SO2,通过测定SO2体积来测定样品中Na2SO3含量。
(4)如图,加入试剂之前须进行的操作是

(5)若样品的质量为ag,加入10mL较浓硫酸充分反应后,测得排出液体的体积为VL(标准状况下),则样品中Na2SO3的质量分数的计算式为
(6)若实验结果测得该样品中Na2SO3含量偏低,原因可能是
a.硫酸不足量
b.测定气体体积时未冷却至室温
c.Y形管中留有反应生成的气体
d.测定气体体积时水准管的液面高于量气管的液面
您最近一年使用:0次
2018-01-11更新
|
169次组卷
|
3卷引用:上海市闵行区2018届高三上学期质量调研化学试题
上海市闵行区2018届高三上学期质量调研化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题25 产物检验型实验探究评价题上海市复兴高级中学2022-2023学年高二上学期10月质量检测练习化学试卷
2012·江苏·二模
2 . 谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡:

(1)当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。实验室中检验淀粉水解产物可选用的试剂是______ 。
A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(2)“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量。其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:R—NH2+HCHO→R—N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定。
①上述测定过程中加入甲醛的目的是______ 。
②滴定终点的实验现象为______ 。
(3)味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,______ (填写操作步骤),称量沉淀质量。
②乙方案:取mg味精溶于水,加入过量浓度为c1mol·L-1的AgNO3溶液,再加入少量______ 溶液做指示剂,用浓度为c2mol·L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。已知:AgSCN是难溶于水的沉淀。
设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是______ 。

(1)当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。实验室中检验淀粉水解产物可选用的试剂是
A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(2)“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量。其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:R—NH2+HCHO→R—N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定。
①上述测定过程中加入甲醛的目的是
②滴定终点的实验现象为
(3)味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,
②乙方案:取mg味精溶于水,加入过量浓度为c1mol·L-1的AgNO3溶液,再加入少量
设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是
您最近一年使用:0次
名校
解题方法
3 . 过氧化钠保存不当容易变质,生成Na2CO3.
(1)某过氧化钠样品已经部分变质,请你将实验过程填写完整,证明过氧化钠已经变质 (试剂:a.水b.盐酸溶液c.氯化钡溶液)取少量样品于试管中,滴加___________ (选填试剂)若看到试管中有___________ (填现象)则说明过氧化钠已变质
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
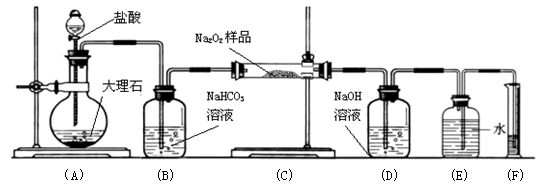
上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置A和C中发生反应的化学方程式:
装置A:___________
装置C:___________
②NaOH的作用是___________
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________ (用字母表示)
(1)某过氧化钠样品已经部分变质,请你将实验过程填写完整,证明过氧化钠已经变质 (试剂:a.水b.盐酸溶液c.氯化钡溶液)取少量样品于试管中,滴加
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置A和C中发生反应的化学方程式:
装置A:
装置C:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
2021-04-15更新
|
199次组卷
|
2卷引用:福建省南平市浦城县2019-2020学年高一上学期第一次月考化学试题
解题方法
4 . 铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
【方案一】
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验步骤〗
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥_______ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_______ (填“偏高”、“偏低”或“无影响”)。
【方案二】
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗
(1)同学们拟选用下列实验装置完成实验:_______ 。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因_______ 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是_______ 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与液体的凹面相平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。_______ 。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_______ mL。
【方案一】
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验步骤〗
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
【方案二】
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗
(1)同学们拟选用下列实验装置完成实验:

②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与液体的凹面相平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
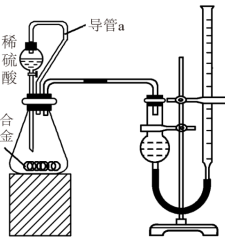
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为
您最近一年使用:0次
5 . I.化学兴趣小组的同学为测定Na2CO3和NaCl混合物中Na2CO3的质量分数,进行了如图实验。

(1)甲同学取一定质量(x g)的样品,用上图示装置测定CO2的质量。反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为m g的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2.然后取下干燥管称得其质量为n g。
①仪器a的名称是___________ ,洗气瓶b中盛放的液体是___________ 。(写名称)
②锥形瓶中发生的反应的化学方程式为___________ 。
③两次通入N2的作用分别是___________ 、___________ 。
(2)乙同学用图中所示方法和步骤进行实验:

乙同学测得样品中Na2CO3的质量分数为___________ 。
II.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A中反应的化学方程式为___________ 。装置C的作用是___________ ,反应的化学方程式为___________ 。
(2)漂白粉将在U形管中产生,此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,需控制B的温度在0~5℃,可采取的措施是___________ 。
②为避免另一副反应的发生,可将装置作何改进___________ 。

(1)甲同学取一定质量(x g)的样品,用上图示装置测定CO2的质量。反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为m g的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2.然后取下干燥管称得其质量为n g。
①仪器a的名称是
②锥形瓶中发生的反应的化学方程式为
③两次通入N2的作用分别是
(2)乙同学用图中所示方法和步骤进行实验:

乙同学测得样品中Na2CO3的质量分数为
II.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A中反应的化学方程式为
(2)漂白粉将在U形管中产生,此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,需控制B的温度在0~5℃,可采取的措施是
②为避免另一副反应的发生,可将装置作何改进
您最近一年使用:0次
15-16高一上·江西九江·阶段练习
名校
6 . 化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:________________________
(2)实验中需加热至恒重的目的是:________________________ -
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_________________
(2)实验中判断沉淀是否完全的方法是___________________________________
方案三:按如图装置进行实验:
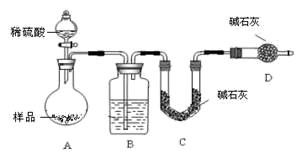
(1)B装置内所盛试剂是_____________ ;D装置的作用是________________ ;分液漏斗中_______ (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为________________ 。
(3)此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:___________________________
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中需加热至恒重的目的是:
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)实验中判断沉淀是否完全的方法是
方案三:按如图装置进行实验:

(1)B装置内所盛试剂是
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为
(3)此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:
您最近一年使用:0次
名校
7 . 在用氨气饱和的食盐水中通入足量二氧化碳可生成NaHCO3固体,反应原理如下: NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl,化学兴趣小组同学根据该原理和如下装置在实验室制备NaHCO3。

实验步骤如下:
Ⅰ、连接好如图装置,检查气密性后,在仪器内装入相应药品。
Ⅱ、在丙装置制备氨气,并通入到丁中饱和食盐水中,直至不再溶解时,然后在饱和食盐水中通入二氧化碳气体,片刻后,丁装置广口瓶中出现固体。继续向广口瓶中通入两种气体,直到不再有固体产生。
Ⅲ、过滤丁中广口瓶中所得的混合物,洗涤、干燥,得到NaHCO3固体。
(1)盛装盐酸的仪器名称是_____________ 。
(2)乙中溶液是_______ (填字母代号)。
A.浓硫酸 B.饱和Na2CO3溶液 C.饱和NaHCO3溶液
(3)装置的部分连接顺序是:a接________ (填“c”或“d”);丁装置中球形干燥管的作用是_________________________________ 。
(4)请解释在实验步骤Ⅱ中,先通入氨气的理由是________________________________________ 。
(5)取m g NaHCO3样品(杂质只含有少量NaCl)溶于足量盐酸,蒸干后称得固体质量为n g,则样品中NaHCO3的质量分数为_____________ (用含m、n的代数式表示,不用化简)。

实验步骤如下:
Ⅰ、连接好如图装置,检查气密性后,在仪器内装入相应药品。
Ⅱ、在丙装置制备氨气,并通入到丁中饱和食盐水中,直至不再溶解时,然后在饱和食盐水中通入二氧化碳气体,片刻后,丁装置广口瓶中出现固体。继续向广口瓶中通入两种气体,直到不再有固体产生。
Ⅲ、过滤丁中广口瓶中所得的混合物,洗涤、干燥,得到NaHCO3固体。
(1)盛装盐酸的仪器名称是
(2)乙中溶液是
A.浓硫酸 B.饱和Na2CO3溶液 C.饱和NaHCO3溶液
(3)装置的部分连接顺序是:a接
(4)请解释在实验步骤Ⅱ中,先通入氨气的理由是
(5)取m g NaHCO3样品(杂质只含有少量NaCl)溶于足量盐酸,蒸干后称得固体质量为n g,则样品中NaHCO3的质量分数为
您最近一年使用:0次
解题方法
8 . 兴趣小组设计实验,测定 与
与 混合物中
混合物中 的质量分数.
的质量分数.
甲方案:
实验步骤为:
 称量空坩埚的质量为
称量空坩埚的质量为 ;
; 称量装有试样的坩埚质量为
称量装有试样的坩埚质量为 ;
;
 加热;
加热;
 冷却;
冷却;
 称量坩埚和残余物的质量为
称量坩埚和残余物的质量为 ;
;
 重复
重复 至
至 操作,直至恒重,质量为
操作,直至恒重,质量为 。
。
(1)坩埚中发生反应的化学方程式___________________________ 。
(2)计算 质量分数为
质量分数为 _____________________________  表达式
表达式 。
。
乙方案:
准确称取 样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用
样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为
的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为 ,即
,即 。重复上述操作两次。
。重复上述操作两次。
 配制上述盐酸标准溶液100ml,若用
配制上述盐酸标准溶液100ml,若用 进行配制,需用量筒量取该HCl溶液
进行配制,需用量筒量取该HCl溶液________ ml;定容时俯视刻度线,将导致配制的溶液浓度________ 。 填“偏高”、“偏低”或“没有影响”
填“偏高”、“偏低”或“没有影响”
(4)根据下表数据,样品中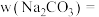
_________ 。 保留三位有效数字
保留三位有效数字
丙方案:称取 样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。

(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?________  填“漏气”、“不漏气”或“无法确定”
填“漏气”、“不漏气”或“无法确定” 。实验时,装置A中c的作用
。实验时,装置A中c的作用_____________________ ,________________ 。
(6)为了提高测定的准确性,应选用装置A和_____  填写字母标号
填写字母标号 进行实验。
进行实验。
 与
与 混合物中
混合物中 的质量分数.
的质量分数.甲方案:
实验步骤为:
 称量空坩埚的质量为
称量空坩埚的质量为 ;
; 称量装有试样的坩埚质量为
称量装有试样的坩埚质量为 ;
;  加热;
加热; 冷却;
冷却;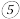 称量坩埚和残余物的质量为
称量坩埚和残余物的质量为 ;
;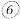 重复
重复 至
至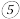 操作,直至恒重,质量为
操作,直至恒重,质量为 。
。(1)坩埚中发生反应的化学方程式
(2)计算
 质量分数为
质量分数为  表达式
表达式 。
。乙方案:
准确称取
 样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用
样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为
的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为 ,即
,即 。重复上述操作两次。
。重复上述操作两次。 配制上述盐酸标准溶液100ml,若用
配制上述盐酸标准溶液100ml,若用 进行配制,需用量筒量取该HCl溶液
进行配制,需用量筒量取该HCl溶液 填“偏高”、“偏低”或“没有影响”
填“偏高”、“偏低”或“没有影响”
(4)根据下表数据,样品中
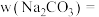
 保留三位有效数字
保留三位有效数字
| 滴定次数 | 样品的质量 | 稀盐酸的体积 | |
滴定前刻度 | 滴定后刻度 | ||
| 1 | 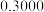 |  |  |
| 2 | 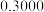 |  | 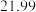 |
| 3 | 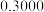 | 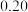 | 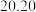 |
丙方案:称取
 样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?
 填“漏气”、“不漏气”或“无法确定”
填“漏气”、“不漏气”或“无法确定” 。实验时,装置A中c的作用
。实验时,装置A中c的作用(6)为了提高测定的准确性,应选用装置A和
 填写字母标号
填写字母标号 进行实验。
进行实验。
您最近一年使用:0次
名校
解题方法
9 . 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
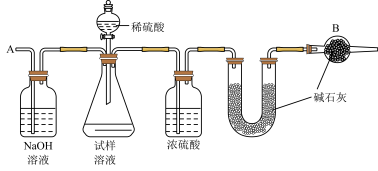
主要实验步骤如下:
①按图组装仪器,并检验装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到b g
④从分液漏斗滴入6mol·L—1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请回答下列有关问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明________________ 。
(2)装置中干燥管B的作用是______________________________________________ 。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________ 。(选填偏高、偏低或不变)。
(4)步骤⑤的目的是__________________________________________ 。
(5)步骤⑦的目的是__________________________________________ 。
(6)试样中纯碱的质量分数的计算式为__________________________ 。
(7)写出纯碱与稀硫酸反应的离子方程式为________________________ 。

主要实验步骤如下:
①按图组装仪器,并检验装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到b g
④从分液漏斗滴入6mol·L—1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请回答下列有关问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)试样中纯碱的质量分数的计算式为
(7)写出纯碱与稀硫酸反应的离子方程式为
您最近一年使用:0次
10-11高三上·上海浦东新·期末
解题方法
10 . 现有氧化铜和碳粉组成的混合物,为通过实验确定氧化铜的质量分数,某同学设计的实验方案中装置如下:

分析上述装置,回答下列问题:
(1)本实验中,酒精灯加热也可达到反应所需的温度,改用电热丝加热的优点是有利于____ 。
a.加快反应速率 b.氢气流动
c.加热温度更高 d.精确测定数据
(2)U形管中可以加入的物质是______ 。
a.无水硫酸铜 b.硅胶 c.浓硫酸 d.无水氯化钙
(3)为确保能准确测定到必要的数据,下列步骤按实验操作顺序排列应为:___________________ (填字母)。
a.停止通氢气;b.电热丝通电;c.通入氢气;d.装置气密性检查;e.电热丝停止通电。
(4)为准确测定数据,你认为本装置________ (是/否)完整?若需要改进,请在虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称___________ 。
(5)实验结束后,该同学交给老师的实验报告主要栏目如图(具体内容已略)。
请你根据实验报告的撰写要求,对此份报告作出评价,若有不完整,请在下面的空格中写出,若已完整,则无需填写___________________________________________________ 。
(6)老师看完实验报告后指出,改变实验原理可以设计出更加简便的实验方案。请你用化学方程式来表示新方案的反应原理,并指出需要测定的数据:
化学方程式___________________________ ;
需要测定的数据_________________________ 。

分析上述装置,回答下列问题:
(1)本实验中,酒精灯加热也可达到反应所需的温度,改用电热丝加热的优点是有利于
a.加快反应速率 b.氢气流动
c.加热温度更高 d.精确测定数据
(2)U形管中可以加入的物质是
a.无水硫酸铜 b.硅胶 c.浓硫酸 d.无水氯化钙
(3)为确保能准确测定到必要的数据,下列步骤按实验操作顺序排列应为:
a.停止通氢气;b.电热丝通电;c.通入氢气;d.装置气密性检查;e.电热丝停止通电。
(4)为准确测定数据,你认为本装置
(5)实验结束后,该同学交给老师的实验报告主要栏目如图(具体内容已略)。
| 实验目的:...... 实验原理:...... 实验仪器和药品:...... 实验装置:...... 实验数据处理:...... 实验误差分析:...... 实验问题讨论:...... |
(6)老师看完实验报告后指出,改变实验原理可以设计出更加简便的实验方案。请你用化学方程式来表示新方案的反应原理,并指出需要测定的数据:
化学方程式
需要测定的数据
您最近一年使用:0次



