名校
1 . (1)NaHCO3是氨碱法和联合制碱法制纯碱的中间产物,在滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤
②不通入氨,冷却、加食盐,过滤。两种方法中___________ (填编号) 析出的氯化铵纯度更高
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏。则白烟的主要成份是___________ (填化学式)。写出产生白烟化学方程式___________ 。
(3)TiO2的熔沸点远高于CO2的原因是___________ ,MgTiO3的熔点高于BaTiO3的原因是___________ 。
(4)
②不通入氨,冷却、加食盐,过滤。两种方法中
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏。则白烟的主要成份是
(3)TiO2的熔沸点远高于CO2的原因是
(4)
| 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| H2O(Br2) | ||
| 氯化镁溶液(氯化铁) |
您最近一年使用:0次
2 . 以黄铁矿(主要成分FeS2)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示。
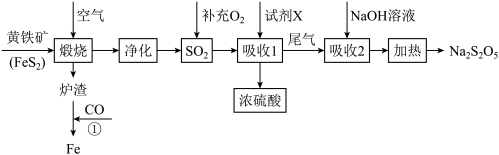
已知:S2O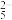 与Ba2+反应生成沉淀,与盐酸反应生成SO2。
与Ba2+反应生成沉淀,与盐酸反应生成SO2。
(1)Na2S2O5中硫元素的化合价为______ 。
(2)煅烧时主要发生的反应为4FeS2+11O2 2Fe2O3+8SO2,则反应①化学方程式为
2Fe2O3+8SO2,则反应①化学方程式为______ 。
(3)试剂X是______ 。
(4)尾气中某种气体可用品红溶液检验,则该气体是______ ,利用了该气体______ (填性质)。
(5)吸收2后得NaHSO3溶液,加热后得Na2S2O5和水,写出加热反应的化学方程式______ 。
(6)Na2S2O5在保存过程中易变质生成Na2SO4。欲检验Na2S2O5是否变质的实验方法为:______ 。
(7)环保部门为了测定某硫酸厂周围空气中的SO2含量进行了如下实验。取标准状况下1.000L空气(含N2、O2、CO2、SO2)。在所得溶液中通入过量的H2S气体,至不再产生黄色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.096g。则空气样品中SO2的体积分数为______ 。

已知:S2O
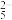 与Ba2+反应生成沉淀,与盐酸反应生成SO2。
与Ba2+反应生成沉淀,与盐酸反应生成SO2。(1)Na2S2O5中硫元素的化合价为
(2)煅烧时主要发生的反应为4FeS2+11O2
 2Fe2O3+8SO2,则反应①化学方程式为
2Fe2O3+8SO2,则反应①化学方程式为(3)试剂X是
(4)尾气中某种气体可用品红溶液检验,则该气体是
(5)吸收2后得NaHSO3溶液,加热后得Na2S2O5和水,写出加热反应的化学方程式
(6)Na2S2O5在保存过程中易变质生成Na2SO4。欲检验Na2S2O5是否变质的实验方法为:
(7)环保部门为了测定某硫酸厂周围空气中的SO2含量进行了如下实验。取标准状况下1.000L空气(含N2、O2、CO2、SO2)。在所得溶液中通入过量的H2S气体,至不再产生黄色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.096g。则空气样品中SO2的体积分数为
您最近一年使用:0次
3 . 某小组在实验室中模拟侯氏制碱法制备NaHCO3,并探究钠及其常见化合物的相关性质和应用,实验流程如图所示:
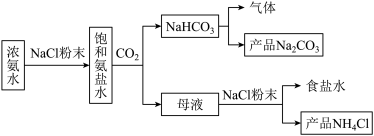
(1)写出由浓氨水生成NaHCO3的总反应的离子方程式:______ 。
(2)侯氏制碱法中NH3和CO2的通入顺序为先通入______ (填化学式,下同),后通入_____ 。
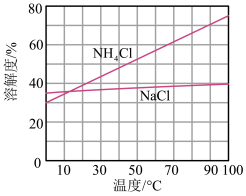
(3)向母液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程,为了充分析出并分离出NH4Cl,根据如图中物质溶解度曲线知,需采取的操作为_____ 、过滤、洗涤、干燥。
(4)NaHCO3长期放置在空气中会变质(部分转变为Na2CO3),现欲测定某NaHCO3样品中NaHCO3的质量分数,设计如下实验方案(假设产生的气体全部与Na2O2反应):
i.取一定质量的样品加水溶解后与如图所示的硫酸VmL恰好反应。
ii.将i中产生的气体用浓硫酸干燥后缓慢地通入足量的Na2O2粉末中充分反应,Na2O2粉末增重mg
①图中硫酸的物质的量浓度是______ 。
②标准状况下i中产生气体的体积为______ L(用含m的代数式表示)。样品中小苏打的物质的量是______ mol(用含m、V的代数式表示)。

(1)写出由浓氨水生成NaHCO3的总反应的离子方程式:
(2)侯氏制碱法中NH3和CO2的通入顺序为先通入
(3)向母液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程,为了充分析出并分离出NH4Cl,根据如图中物质溶解度曲线知,需采取的操作为

(4)NaHCO3长期放置在空气中会变质(部分转变为Na2CO3),现欲测定某NaHCO3样品中NaHCO3的质量分数,设计如下实验方案(假设产生的气体全部与Na2O2反应):
i.取一定质量的样品加水溶解后与如图所示的硫酸VmL恰好反应。
ii.将i中产生的气体用浓硫酸干燥后缓慢地通入足量的Na2O2粉末中充分反应,Na2O2粉末增重mg
| 名称:硫酸 分子式:H2SO4 密度:1.84 g·cm-3 质量分数:98% |
②标准状况下i中产生气体的体积为
您最近一年使用:0次
4 . Ⅰ.钠是典型的金属元素,钠的化合物具有广泛的用途。请回答以下问题:
(1)15.6g 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中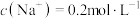 ,则X的摩尔质量为
,则X的摩尔质量为______ 。
(2) 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: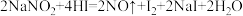 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为______ 。标况下,每生成11.2L的NO气体,转移的电子数约为______ 个。
(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO______  (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为______ (填字母序号)。
A. B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClO
Ⅱ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为______ 。
(5)流程中可循环利用的物质为______ (填化学式)。
(6)产品分析:把5.8g含有少量NaCl杂质的 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为______ (用百分数表示,保留到小数点后1位)。
(1)15.6g
 溶于水中配制成2L的溶液,其中
溶于水中配制成2L的溶液,其中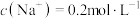 ,则X的摩尔质量为
,则X的摩尔质量为(2)
 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒.已知 能发生如下反应:
能发生如下反应: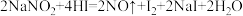 。上述反应中HI在反应中体现的性质为
。上述反应中HI在反应中体现的性质为(3)某届奥运会期间,由于工作人员将84消毒液(有效成分NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与
 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当参加反应的NaClO和
(填“>”或“<”);当参加反应的NaClO和 的个数比为1∶1时,该反应的还原产物为
的个数比为1∶1时,该反应的还原产物为A.
 B.
B. C.
C. D.NaCl E.NaClO
D.NaCl E.NaClOⅡ.化工专家侯德榜发明的侯氏制碱法为我国经济发展做出了重要贡献。侯氏制碱法的工艺流程图如下:

(4)工艺流程中“碳酸化”时发生主要反应的化学方程式为
(5)流程中可循环利用的物质为
(6)产品分析:把5.8g含有少量NaCl杂质的
 样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量
样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重1.4g,则产品纯度为
增重1.4g,则产品纯度为
您最近一年使用:0次
解题方法
5 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为________ ;
装置乙中反应的化学方程式为________
(2)一段时间后,装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和一种铵盐,装置丙中反应的化学方程式为________ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________ 、洗涤固体、灼烧,最后一步发生反应的化学方程式为________ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置(尽量少选)设计实验,并完成下表:

(5)测定该纯碱样品的纯度:称取 样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为
样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为 。则该纯碱样品的纯度为
。则该纯碱样品的纯度为________ 。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为
装置乙中反应的化学方程式为
(2)一段时间后,装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和一种铵盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置(尽量少选)设计实验,并完成下表:

选择的装置(填编号) | 实验现象 | 实验结论 |
样品中含NaHCO3 |
(5)测定该纯碱样品的纯度:称取
 样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为
样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为 。则该纯碱样品的纯度为
。则该纯碱样品的纯度为
您最近一年使用:0次
名校
6 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。回答下列相关问题。
(1) 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。
并检验其纯度的实验流程如图所示。

回答下列问题:
①生成 的化学方程式
的化学方程式 ___________ 。
②写出 样品加水溶解的离子方程式,并用单线桥标出电子转移的方向和数目
样品加水溶解的离子方程式,并用单线桥标出电子转移的方向和数目___________ 。
③样液中加入 后产生能使带火星木条复燃的气体,说明
后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
与水反应的过程中还生成了 ___________ (填写化学式)
④滤液中加入BaCl2溶液产生白色沉淀,说明 样品中含有
样品中含有___________ 杂质(填写化学式)。若20.0g  样品可消耗0.1 mol∙L−1的 BaCl2溶液 10.0mL,该样品的纯度为
样品可消耗0.1 mol∙L−1的 BaCl2溶液 10.0mL,该样品的纯度为 ___________ (保留2位小数)。
(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 能溶于水)的工艺流程如图所示:
能溶于水)的工艺流程如图所示:

①溶液 Y 中含有阳离子
__________ (填写离子符号)。
②关于该流程,下列说法不正确的是___________ (填字母) 。
a. 反应Ⅱ属于氧化还原反应
b. 溶液 Y 中不存在
c. 该流程中,气体X 可以循环使用
d. 溶液Z 的结晶产物是硫酸铜晶体
③反应Ⅲ包含多步反应:
第一步:∙∙∙∙∙∙
第二步:
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为___________ 。
(1)
 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。
并检验其纯度的实验流程如图所示。
回答下列问题:
①生成
 的化学方程式
的化学方程式 ②写出
 样品加水溶解的离子方程式,并用单线桥标出电子转移的方向和数目
样品加水溶解的离子方程式,并用单线桥标出电子转移的方向和数目③样液中加入
 后产生能使带火星木条复燃的气体,说明
后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
与水反应的过程中还生成了 ④滤液中加入BaCl2溶液产生白色沉淀,说明
 样品中含有
样品中含有 样品可消耗0.1 mol∙L−1的 BaCl2溶液 10.0mL,该样品的纯度为
样品可消耗0.1 mol∙L−1的 BaCl2溶液 10.0mL,该样品的纯度为 (2)工业上以侯氏制碱法为基础生产焦亚硫酸钠(

 能溶于水)的工艺流程如图所示:
能溶于水)的工艺流程如图所示:
①溶液 Y 中含有阳离子

②关于该流程,下列说法不正确的是
a. 反应Ⅱ属于氧化还原反应
b. 溶液 Y 中不存在

c. 该流程中,气体X 可以循环使用
d. 溶液Z 的结晶产物是硫酸铜晶体
③反应Ⅲ包含多步反应:
第一步:∙∙∙∙∙∙
第二步:

为了减少产品
 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
您最近一年使用:0次
7 . 钠是非常重要的一种元素,其化合物在生产、生活中有非常重要的用途。
(1)碳酸钠俗称苏打,又名纯碱,是一种重要的无机化工原料,主要用于平板玻璃、玻璃制品和陶瓷釉的生产。还广泛用于生活洗涤、酸类中和以及食品加工等。纯碱的生产历史悠久,先后经历了:路布兰制碱法、索尔维制碱法、侯德榜制碱法等历程。其中侯德榜制碱法又称联合制碱法,其关键反应步骤是:依次将___________ 和___________ (都填名称)两种气体通入精制饱和食盐水得到中间产物,该步骤涉及的离子方程式为___________
(2)焦亚硫酸钠( )在医药、橡胶、印染、食品等方面应用广泛。
)在医药、橡胶、印染、食品等方面应用广泛。
①生产 ,通常是由
,通常是由 过饱和溶液经结晶脱水制得。写出该过程的化学方程式
过饱和溶液经结晶脱水制得。写出该过程的化学方程式___________ 。
② 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留是时,取
残留是时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗
的碘标准液滴定至终点,消耗 、滴定反应的离子方程式为
、滴定反应的离子方程式为___________ ,该样品中 的残留量为
的残留量为___________  (以
(以 计)
计)
(3)氢化钠是厨房最常见的调味品之一,而亚硝酸钠是一种重要的化工原料,有毒。由于亚硝酸钠外观与氯化钠类似且具有成味,因此偶有发生误食而中毒的事件。业上可以通过用 溶液吸收NO和
溶液吸收NO和 的方法得到亚硝酸钠,已知该反应进行时两种氮氧化物消耗量相等且只生产一种盐,生成
的方法得到亚硝酸钠,已知该反应进行时两种氮氧化物消耗量相等且只生产一种盐,生成 亚硝酸钠时理论上转移电子的数目为
亚硝酸钠时理论上转移电子的数目为___________  。
。
(1)碳酸钠俗称苏打,又名纯碱,是一种重要的无机化工原料,主要用于平板玻璃、玻璃制品和陶瓷釉的生产。还广泛用于生活洗涤、酸类中和以及食品加工等。纯碱的生产历史悠久,先后经历了:路布兰制碱法、索尔维制碱法、侯德榜制碱法等历程。其中侯德榜制碱法又称联合制碱法,其关键反应步骤是:依次将
(2)焦亚硫酸钠(
 )在医药、橡胶、印染、食品等方面应用广泛。
)在医药、橡胶、印染、食品等方面应用广泛。①生产
 ,通常是由
,通常是由 过饱和溶液经结晶脱水制得。写出该过程的化学方程式
过饱和溶液经结晶脱水制得。写出该过程的化学方程式②
 可用作食品的抗氧化剂。在测定某葡萄酒中
可用作食品的抗氧化剂。在测定某葡萄酒中 残留是时,取
残留是时,取 葡萄酒样品,用
葡萄酒样品,用 的碘标准液滴定至终点,消耗
的碘标准液滴定至终点,消耗 、滴定反应的离子方程式为
、滴定反应的离子方程式为 的残留量为
的残留量为 (以
(以 计)
计)(3)氢化钠是厨房最常见的调味品之一,而亚硝酸钠是一种重要的化工原料,有毒。由于亚硝酸钠外观与氯化钠类似且具有成味,因此偶有发生误食而中毒的事件。业上可以通过用
 溶液吸收NO和
溶液吸收NO和 的方法得到亚硝酸钠,已知该反应进行时两种氮氧化物消耗量相等且只生产一种盐,生成
的方法得到亚硝酸钠,已知该反应进行时两种氮氧化物消耗量相等且只生产一种盐,生成 亚硝酸钠时理论上转移电子的数目为
亚硝酸钠时理论上转移电子的数目为 。
。
您最近一年使用:0次
名校
8 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为_______ ;装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为_______ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、_______ ,最后一步发生反应的化学方程式为_______ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:
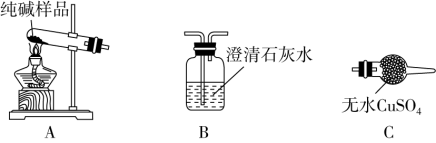
(5)测定该纯碱样品的纯度:称取m1 g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2 g。则该纯碱样品的纯度为_______ 。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置甲中反应的离子方程式为
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3.装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤固体、
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成表格:

| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
名校
9 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
(1)装置甲中反应的离子方程式 为_________ ;装置乙的作用是_________ ,反应的化学方程式为________ 。
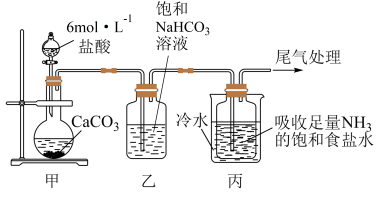
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的离子方程式为__________ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有__________ 、洗涤固体、__________ ,最后一步发生反应的化学方程式为_______________ 。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

(5)测定该纯碱样品的纯度:称取m1g样品,置于试管中,充分加热,得到固体的质量为m2 g。则该纯碱样品的纯度为_______ 。(填字母代号)
A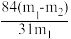 B
B 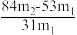 C
C  D
D 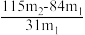
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
(1)装置甲中反应的

(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的离子方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
A
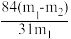 B
B 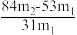 C
C  D
D 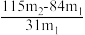
您最近一年使用:0次
名校
解题方法
10 . 技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低。生产流程可简要表示如图:

(1)向沉淀池中通入CO2和氨气,应先通入___________ (填化学式)。
(2)沉淀池中发生反应的化学方程式___________ 。
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是___________ ,加入细小食盐颗粒的作用是___________ 。
(4)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为___________ (填化学式)。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________ 。
(5)侯氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中碳酸钠的纯度为:___________ 。

(1)向沉淀池中通入CO2和氨气,应先通入
(2)沉淀池中发生反应的化学方程式
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是
(4)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为
(5)侯氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中碳酸钠的纯度为:
您最近一年使用:0次



