1 . 海洋中有丰富的资源,下图为海水资源利用的部分过程。下列有关说法正确的是
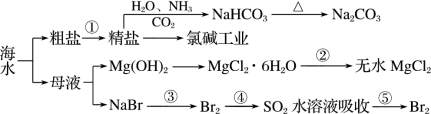
A.在第①步中除去粗盐中的 、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.操作④的目的是对溴进行富集 |
| C.工业上通过电解饱和 MgCl2溶液制取金属镁 |
D.反应④的离子方程式为:Br2+SO2+2H2O=2HBr+2H++SO |
您最近一年使用:0次
解题方法
2 . 浩瀚的大海中蕴藏着丰富的化学资源,等待着人们去开发和利用。
Ⅰ.通过海水晾晒可得粗盐,粗盐中除 外,还含有
外,还含有 、
、 、
、 以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂
以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂 溶液、
溶液、 溶液、
溶液、 溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
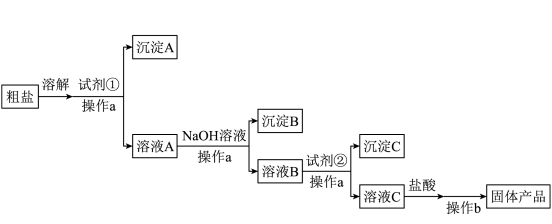
(1)操作a和操作b的名称依次是___________ 、___________ 。
(2)加入 溶液后,得到的沉淀B是
溶液后,得到的沉淀B是___________ (填化学式)。
(3)加入试剂②后,发生反应的离子方程式有___________ 。
(4)加入盐酸的作用是___________ ,
(5)如果加入试剂②后直接加盐酸,产生的后果是___________ (用离子方程式表示)。
Ⅱ. 是一种催化剂,某校学习小组用下面装置制备少量
是一种催化剂,某校学习小组用下面装置制备少量 。已知:
。已知: 遇到空气中的水蒸气时能剧烈反应生成
遇到空气中的水蒸气时能剧烈反应生成 和
和 ;
; 在180℃时升华。根据要求完成问题:
在180℃时升华。根据要求完成问题:

(6)A装置中反应的离子方程式为___________ 。
(7)试剂b为___________ 。
(8)所用d导管较粗的原因是___________ 。
(9)F装置的作用为___________ 。
Ⅰ.通过海水晾晒可得粗盐,粗盐中除
 外,还含有
外,还含有 、
、 、
、 以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂
以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂 溶液、
溶液、 溶液、
溶液、 溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
(1)操作a和操作b的名称依次是
(2)加入
 溶液后,得到的沉淀B是
溶液后,得到的沉淀B是(3)加入试剂②后,发生反应的离子方程式有
(4)加入盐酸的作用是
(5)如果加入试剂②后直接加盐酸,产生的后果是
Ⅱ.
 是一种催化剂,某校学习小组用下面装置制备少量
是一种催化剂,某校学习小组用下面装置制备少量 。已知:
。已知: 遇到空气中的水蒸气时能剧烈反应生成
遇到空气中的水蒸气时能剧烈反应生成 和
和 ;
; 在180℃时升华。根据要求完成问题:
在180℃时升华。根据要求完成问题:
(6)A装置中反应的离子方程式为
(7)试剂b为
(8)所用d导管较粗的原因是
(9)F装置的作用为
您最近一年使用:0次
3 . 海水是巨大的资源宝库,人类从海水中提取某些化工原料的简单流程如下:

已知:溴单质的沸点为 ,氧化镁的熔点为
,氧化镁的熔点为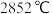 ,氯化镁的熔点为
,氯化镁的熔点为 。
。
请回答下列问题。
(1)流程中,试剂①和②适宜选用___________ 。
(2)工业上采用电解熔融氯化镁而不用电解熔融氧化镁制金属镁,其原因是___________ 。
(3)工业上利用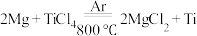 制备金属Ti,该方法属于
制备金属Ti,该方法属于___________ 。
A.热分解法 B.热还原法 C.电解法
(4)“吹出塔”中通入热空气吹出 ,利用了
,利用了
___________ 的性质。
(5)“吸收塔”中发生反应的离子方程式为___________ 。
(6)“蒸馏塔”中温度应控制在___________ 。
A.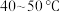 B.
B.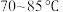 C.100℃以上
C.100℃以上

已知:溴单质的沸点为
 ,氧化镁的熔点为
,氧化镁的熔点为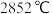 ,氯化镁的熔点为
,氯化镁的熔点为 。
。请回答下列问题。
(1)流程中,试剂①和②适宜选用
| 试剂① | 试剂② | |
| A | NaOH溶液 | 盐酸 |
| B | NaOH溶液 | 硫酸 |
| C | 石灰乳 | 盐酸 |
| D | 澄清石灰水 | 硝酸 |
(3)工业上利用
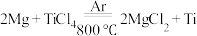 制备金属Ti,该方法属于
制备金属Ti,该方法属于A.热分解法 B.热还原法 C.电解法
(4)“吹出塔”中通入热空气吹出
 ,利用了
,利用了
(5)“吸收塔”中发生反应的离子方程式为
(6)“蒸馏塔”中温度应控制在
A.
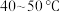 B.
B.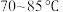 C.100℃以上
C.100℃以上
您最近一年使用:0次
4 . 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。如图是海水综合利用的部分流程图,据图回答问题:
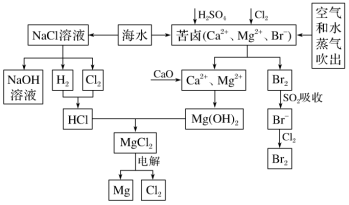
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、 等离子,为分别除去这些离子,所加试剂及有关操作的先后顺序为(试剂写化学式):
等离子,为分别除去这些离子,所加试剂及有关操作的先后顺序为(试剂写化学式):_______ 、_______ 、NaOH、过滤、HCl。
(2)电解饱和食盐水的离子方程式为____________ 。
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2+6H2O,该反应要在HCl气氛中进行,原因是
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_________________________ 。
(4)金属镁着火不能用泡沫灭火器、干粉灭火器灭火,其原因是_____ 。(用化学方程式解释说明)
(5)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,发生反应生成H2SO4和HBr,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为______ 。
(6)也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是_____________________ ;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用________ 方法得到单质Br2。

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、
 等离子,为分别除去这些离子,所加试剂及有关操作的先后顺序为(试剂写化学式):
等离子,为分别除去这些离子,所加试剂及有关操作的先后顺序为(试剂写化学式):(2)电解饱和食盐水的离子方程式为
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O
 MgCl2+6H2O,该反应要在HCl气氛中进行,原因是
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是(4)金属镁着火不能用泡沫灭火器、干粉灭火器灭火,其原因是
(5)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,发生反应生成H2SO4和HBr,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为
(6)也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是
您最近一年使用:0次
名校
5 . 以苦卤(海水晒盐后得到的母液,含 )为原料,利用空气吹出法进行“海水提溴”的工艺流程如图。
)为原料,利用空气吹出法进行“海水提溴”的工艺流程如图。

请回答下列问题:
(1)步骤②苦卤中的 被
被 氧化的离子方程式为
氧化的离子方程式为___________ 。
(2)若步骤④使用 和
和 吸收吹出的
吸收吹出的 ,则化学方程式为
,则化学方程式为___________ ,接着骤⑤再次用 氧化吸收液,重新生成
氧化吸收液,重新生成 。
。
(3)若步骤④使用 溶液吸收吹出的
溶液吸收吹出的 ,请配平补全以下化学方程式:
,请配平补全以下化学方程式:___________ 。
___________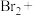 ___________
___________ ___________
___________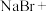 ___________
___________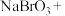 ___________
___________
则步骤⑤用硫酸酸化吸收液,得到 和
和 的混合溶液。相同条件下,若用盐酸酸化,则所得
的混合溶液。相同条件下,若用盐酸酸化,则所得 的质量减少,原因是
的质量减少,原因是___________ 。
(4)该工艺流程中,不直接对“含 的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得
的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得 单质,“步骤③④⑤”的作用是
单质,“步骤③④⑤”的作用是___________ 。
 )为原料,利用空气吹出法进行“海水提溴”的工艺流程如图。
)为原料,利用空气吹出法进行“海水提溴”的工艺流程如图。
请回答下列问题:
(1)步骤②苦卤中的
 被
被 氧化的离子方程式为
氧化的离子方程式为(2)若步骤④使用
 和
和 吸收吹出的
吸收吹出的 ,则化学方程式为
,则化学方程式为 氧化吸收液,重新生成
氧化吸收液,重新生成 。
。(3)若步骤④使用
 溶液吸收吹出的
溶液吸收吹出的 ,请配平补全以下化学方程式:
,请配平补全以下化学方程式:___________
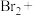 ___________
___________ ___________
___________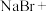 ___________
___________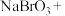 ___________
___________
则步骤⑤用硫酸酸化吸收液,得到
 和
和 的混合溶液。相同条件下,若用盐酸酸化,则所得
的混合溶液。相同条件下,若用盐酸酸化,则所得 的质量减少,原因是
的质量减少,原因是(4)该工艺流程中,不直接对“含
 的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得
的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得 单质,“步骤③④⑤”的作用是
单质,“步骤③④⑤”的作用是
您最近一年使用:0次
2022-11-16更新
|
253次组卷
|
4卷引用:湖南省株洲市第八中学2023届高三上学期第一次月考化学试题
湖南省株洲市第八中学2023届高三上学期第一次月考化学试题福建省厦门第一中学2022-2023学年高一上学期期中考试化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)云南省玉溪市第二中学2022-2023学年高一下学期期末考试 化学试题
解题方法
6 . 下列有关金属的工业制法中,正确的是
A.用海水、石灰乳等为原料,经一系列过程制得氧化镁,用 还原氧化镁制得镁 还原氧化镁制得镁 |
| B.以海水为原料制得精盐,再电解熔融的食盐制取钠 |
| C.用金属钠置换氯化钛溶液中的钛 |
D.电解精炼黄铜矿(主要成分为 )得到纯度为99.9%的铜 )得到纯度为99.9%的铜 |
您最近一年使用:0次
名校
7 . 海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)。

下列有关说法正确的是

下列有关说法正确的是
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B.结晶出的MgCl2·6H2O在过程②中直接加热脱水即可制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
D.过程①中除去粗盐中的Ca2+、Mg2+、SO 等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
您最近一年使用:0次
2022-10-12更新
|
168次组卷
|
2卷引用:湖南省邵阳市第二中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
8 . 海洋是一个巨大的化学资源宝库,下图是海水资源综合利用的部分流程图。

(1)由海水提取的粗盐中常含有 等,可以加入
等,可以加入_______ (填化学式)除去。
(2)步骤①反应的离子方程式为_______ 。
(3)步骤④为无水MgCl2电解制取金属镁的过程。若生成11.2L(标准状况下)Cl2,则消耗无水MgCl2的质量为_______ g。

(1)由海水提取的粗盐中常含有
 等,可以加入
等,可以加入(2)步骤①反应的离子方程式为
(3)步骤④为无水MgCl2电解制取金属镁的过程。若生成11.2L(标准状况下)Cl2,则消耗无水MgCl2的质量为
您最近一年使用:0次
解题方法
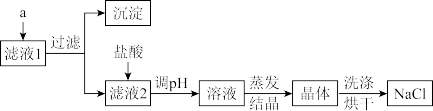
9 . 氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过如图操作流程:

(1)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是_______
(2)实验结束后称量获得的“精盐”,并计算“精盐”的制得率,发现制得率较低,其可能原因是_______(填字母)。
(3)小明查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的 、
、 、
、 等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
提供的试剂: 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 和
和 溶液。
溶液。
①从提供的试剂中选择,a所代表的试剂是_______ 、_______ 、 溶液(各试剂均稍过量)。
溶液(各试剂均稍过量)。
②判断“滤液I中 是否已除尽操作是
是否已除尽操作是_______ .
③在“滤液2”中加盐酸的作用是_______ 、_______ (用化学方程式表示)。

(1)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是
(2)实验结束后称量获得的“精盐”,并计算“精盐”的制得率,发现制得率较低,其可能原因是_______(填字母)。
| A.粗盐没有全部溶解即过滤 |
| B.蒸发时有液滴飞溅 |
| C.蒸发后所得“精盐”很潮湿 |
| D.蒸发皿上粘有的“精盐”没有全部转移到称量纸上 |
 、
、 、
、 等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
提供的试剂:
 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 和
和 溶液。
溶液。①从提供的试剂中选择,a所代表的试剂是
 溶液(各试剂均稍过量)。
溶液(各试剂均稍过量)。②判断“滤液I中
 是否已除尽操作是
是否已除尽操作是③在“滤液2”中加盐酸的作用是
您最近一年使用:0次
2022-04-15更新
|
271次组卷
|
2卷引用:湖南省岳阳市临湘市2021-2022学年高一下学期期末教学质量检测化学试题
名校
解题方法
10 . 海水蕴藏着丰富的化学资源。仅通过物理方法就能从海水中获得的物质是
| A.食盐 | B.金属钠 | C.烧碱 | D.氢气 |
您最近一年使用:0次
2021-10-24更新
|
277次组卷
|
7卷引用:湖南省长沙市雨花区2021-2022学年高一上学期期末考试化学试题



