名校
解题方法
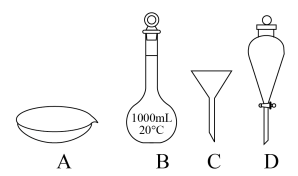
1 . 下列实验基本操作正确的是
| A.用苯萃取碘水中的碘单质,分液时应先放出有机相,再放出无机相 |
| B.提取海带中碘元素时,为保证I-完全氧化为I2,加入的氯水应过量 |
| C.配制质量分数10%的CuSO4溶液:称取5.0 g 胆矾,加入27.0 g水,搅拌溶解 |
| D.蒸馏开始时先开冷凝水,再开加热器;结束时先关冷凝水,再关加热器 |
您最近一年使用:0次
2022-08-20更新
|
634次组卷
|
2卷引用:广东省广州市六校2023届高三上学期8月第一次联考化学试题
2 . I.溴有“海洋元素”之称,海水中溴含量为65mg•L-1。空气吹出法工艺是目前“海水提溴”的最主要方法之一,其步骤如下:
(1)步骤①中获得Br2的离子方程式为___________ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是___________ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2,共有___________ 个电子转移(用a和 的代数式表示)。
的代数式表示)。
Ⅱ.碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的实验流程如下:___________ 、___________ 。
(5)“试剂a”通常应具有一定的___________ 性。
(6)由于“溶液B”中I2的含量较低,“操作Ⅱ”能将I2 “富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___________ (填试剂标号)。
(7)“操作Ⅱ”宜选用的装置是___________ (填标号)。___________ 。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2,共有
 的代数式表示)。
的代数式表示)。Ⅱ.碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的实验流程如下:

(5)“试剂a”通常应具有一定的
(6)由于“溶液B”中I2的含量较低,“操作Ⅱ”能将I2 “富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶,不与I2反应 | 与水不互溶,不与 I2反应 | 与水不互溶,不与I2反应 | 与水不互溶,与I2反应 |
(7)“操作Ⅱ”宜选用的装置是
您最近一年使用:0次
解题方法
3 . 碘是生物必需的一种微量元素,海带、海藻等食物含碘量最为丰富.某小组通过实验提取并测定干海带中碘的含量.回答下列问题:
Ⅰ.从海带中提取碘.该小组同学按如图实验流程进行实验:______ (填仪器名称)。______ (用离子方程式表示)。
Ⅱ.滴定法测海带中碘的含量。
用 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为:
的水溶液,淀粉溶液作指示剂。原理为: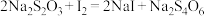 ,
,
(3)用酸式滴定管量取 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是__________ 。
(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。
猜想1:碘离子被______ 氧化;
猜想2:碘离子被步骤iii中过量的 氧化;
氧化;
②验证猜想
③查阅资料 小组同学认为可能是反应速率不同造成的, 氧化
氧化 的速率
的速率______ (填“快于”或“慢于”) 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。
④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案____________ 。
⑤完成实验 小组同学修正方案后,取5.000 g干海带进行测定,消耗15.75 mL
 溶液,则干海带中碘的含量为
溶液,则干海带中碘的含量为______ mg/g(保留2位有效数字)。
Ⅰ.从海带中提取碘.该小组同学按如图实验流程进行实验:

Ⅱ.滴定法测海带中碘的含量。
用
 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为:
的水溶液,淀粉溶液作指示剂。原理为: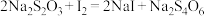 ,
,(3)用酸式滴定管量取
 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。

猜想1:碘离子被
猜想2:碘离子被步骤iii中过量的
 氧化;
氧化;②验证猜想
| 序号 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量原海带浸出液,加入硫酸酸化,再滴加几滴淀粉溶液,鼓入空气 | 待测液始终保持无色 | 猜想1不成立 |
| 2 | 将2mL KI溶液、2滴 KI溶液、2滴  溶液、2滴淀粉溶液和1滴 溶液、2滴淀粉溶液和1滴  溶液混合配制待测液,用 溶液混合配制待测液,用 溶液滴定 溶液滴定 | 猜想2不成立 |
 氧化
氧化 的速率
的速率 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案
⑤完成实验 小组同学修正方案后,取5.000 g干海带进行测定,消耗15.75 mL

 溶液,则干海带中碘的含量为
溶液,则干海带中碘的含量为
您最近一年使用:0次
2024-04-16更新
|
651次组卷
|
2卷引用:广东省佛山市2024届高三教学质量检测(一)化学试题
2023高三·全国·专题练习
4 . 全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。空气吹出法工艺是目前“海水提溴”的最主要方法之一、其工艺流程如图:
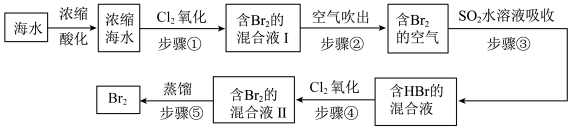
(1)步骤①中获得Br2的离子方程式为____ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收1molBr2共有___ 个电子转移(用NA的代数式表示)。
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤溶解和____ 。
(5)“试剂a”通常应具有一定的____ 性。利用H2O2完成“溶液A”向“溶液B”的转变。写出该反应的化学方程式:________________ 。
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ 。(选填编号)
(7)“操作II”宜选用的装置是 。(选填编号)
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:____ 。
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液50.0mL,恰好反应完全。则所测盐中碘的含量是____ mg•g-1(保留四位小数)。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收1molBr2共有
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤溶解和
(5)“试剂a”通常应具有一定的
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.溴水 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶不与反应 | 与水互溶与I2反应 | 与水不互溶不与I2反应 | 与水不互溶与I2反应 |
(7)“操作II”宜选用的装置是 。(选填编号)
A. | B. | C. | D. |
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液50.0mL,恰好反应完全。则所测盐中碘的含量是
您最近一年使用:0次
解题方法
5 . 下列实验操作与选用的部分仪器相匹配的是
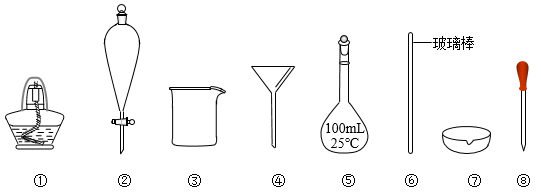

| A.将干海带灼烧成海带灰,选用①⑥⑦ |
B.从 的 的 溶液中分离出 溶液中分离出 ,选用②③ ,选用②③ |
C.用水来吸收 尾气,选用③④ 尾气,选用③④ |
D.配制100g质量分数 的 的 溶液,选用③⑤⑥⑧ 溶液,选用③⑤⑥⑧ |
您最近一年使用:0次
名校
解题方法
6 . 海带中既含有有机碘化合物又含有碘化钠等无机碘化合物。某课题组探究了海带提碘的优化条件,并用色度计测定了某海带样品中碘的含量。实验步骤:
I.预处理:将干海带刷净,剪成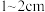 大小的方块,准确称量
大小的方块,准确称量 样品。
样品。
II.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
III.过滤:将冷却后的海带灰转移到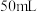 烧杯中,加入
烧杯中,加入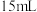 蒸馏水,静置后过滤。
蒸馏水,静置后过滤。
IV.氧化:向滤液中加入稀 和
和 溶液,充分反应后将滤液转移到分液漏斗中。
溶液,充分反应后将滤液转移到分液漏斗中。
V.萃取:向分液漏斗中加入 ,振荡,静置。待溶液完全分层后,取下层溶液。
,振荡,静置。待溶液完全分层后,取下层溶液。
VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的 溶液,回收
溶液,回收
已知:海带灰化后,碘元素以 的形式存在。
的形式存在。
回答下列问题:
(1)第II步中的仪器A是___________ 。
(2)证明第III步滤液中存在 的实验方法是
的实验方法是___________ ,实验现象是___________ 。
(3)第IV步氧化过程中发生反应的离子方程式为___________ 。
(4)第V步可得到 的
的 溶液,也可用如下流程从其中回收
溶液,也可用如下流程从其中回收 :
:
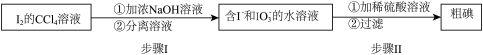
请写出步骤II的离子方程式:___________ 。
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标,碘浓度(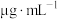 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取 碘单质,用
碘单质,用 容量瓶配成碘的
容量瓶配成碘的 溶液,取出
溶液,取出 加入一定量
加入一定量 中配得第一份碘的标准溶液
中配得第一份碘的标准溶液 。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是___________ 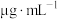 。
。
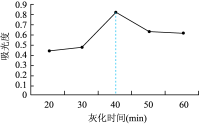
(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响,其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是___________ 。
I.预处理:将干海带刷净,剪成
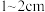 大小的方块,准确称量
大小的方块,准确称量 样品。
样品。II.灰化:在仪器A中加热干海带,并用玻璃棒不断搅拌,记录加热时间,停止加热,冷却。
III.过滤:将冷却后的海带灰转移到
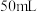 烧杯中,加入
烧杯中,加入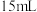 蒸馏水,静置后过滤。
蒸馏水,静置后过滤。IV.氧化:向滤液中加入稀
 和
和 溶液,充分反应后将滤液转移到分液漏斗中。
溶液,充分反应后将滤液转移到分液漏斗中。V.萃取:向分液漏斗中加入
 ,振荡,静置。待溶液完全分层后,取下层溶液。
,振荡,静置。待溶液完全分层后,取下层溶液。VI.含量测定:用色度计测定出所得溶液中碘的含量。
VII.回收处理:蒸馏碘的
 溶液,回收
溶液,回收
已知:海带灰化后,碘元素以
 的形式存在。
的形式存在。回答下列问题:
(1)第II步中的仪器A是
(2)证明第III步滤液中存在
 的实验方法是
的实验方法是(3)第IV步氧化过程中发生反应的离子方程式为
(4)第V步可得到
 的
的 溶液,也可用如下流程从其中回收
溶液,也可用如下流程从其中回收 :
:
请写出步骤II的离子方程式:
(5)碘浓度越大吸光度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标,碘浓度(
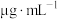 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取 碘单质,用
碘单质,用 容量瓶配成碘的
容量瓶配成碘的 溶液,取出
溶液,取出 加入一定量
加入一定量 中配得第一份碘的标准溶液
中配得第一份碘的标准溶液 。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是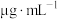 。
。(6)课题组在其他实验条件相同情况下,研究了不同灰化时间对碘提取效果的影响,其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是

您最近一年使用:0次
2023-07-03更新
|
149次组卷
|
2卷引用:山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期9月第一次月考化学试题
7 . 碘元素是人体的必需微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如图:
Ⅰ.海带中碘元素的确定
海带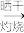 海带灰
海带灰
 海带灰浸取液
海带灰浸取液
(1)取海带灰浸取液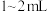 ,加入稀硫酸约
,加入稀硫酸约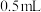 、5%的
、5%的 溶液约
溶液约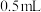 ,然后加入
,然后加入 约
约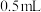 ,振荡后静置,可以观察到
,振荡后静置,可以观察到_______ ,证明海带中含有碘元素,该反应的离子方程式为_______ 。
Ⅱ.海带提碘
海带灰浸取液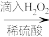 含I2的水溶液
含I2的水溶液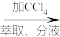 碘的有机溶液→晶体碘
碘的有机溶液→晶体碘
(2)若向 碘水L中加入
碘水L中加入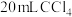 ,充分振荡、静置,此时碘在
,充分振荡、静置,此时碘在 中的物质的量浓度是水中的86倍,则萃取效率为
中的物质的量浓度是水中的86倍,则萃取效率为_______ %(结果保留小数点后两位)(萃取效率 )。
)。
(3)萃取实验中,若要使碘尽可能地完全转移到 中,可以采取的操作是
中,可以采取的操作是_______ 。
(4)某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是_______ 。
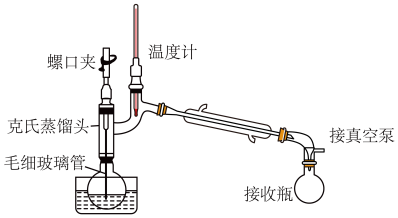
Ⅲ.海带中碘含量的测定
(5)若称取干海带 ,经灼烧、浸取、
,经灼烧、浸取、 氧化等过程后配制成
氧化等过程后配制成 溶液,移取
溶液,移取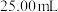 于锥形瓶中,用
于锥形瓶中,用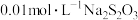 标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的
标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的 溶液的平均体积为
溶液的平均体积为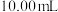 ,计算海带中含碘的质量分数为
,计算海带中含碘的质量分数为_______ %(结果保留小数点后两位)(已知 )。若滴定结束读数时俯视刻度线,会导致测定结果
)。若滴定结束读数时俯视刻度线,会导致测定结果_______ (填“偏高”“偏低”或“不影响”)。
Ⅰ.海带中碘元素的确定
海带
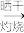 海带灰
海带灰
 海带灰浸取液
海带灰浸取液(1)取海带灰浸取液
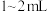 ,加入稀硫酸约
,加入稀硫酸约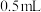 、5%的
、5%的 溶液约
溶液约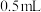 ,然后加入
,然后加入 约
约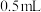 ,振荡后静置,可以观察到
,振荡后静置,可以观察到Ⅱ.海带提碘
海带灰浸取液
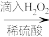 含I2的水溶液
含I2的水溶液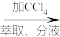 碘的有机溶液→晶体碘
碘的有机溶液→晶体碘(2)若向
 碘水L中加入
碘水L中加入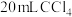 ,充分振荡、静置,此时碘在
,充分振荡、静置,此时碘在 中的物质的量浓度是水中的86倍,则萃取效率为
中的物质的量浓度是水中的86倍,则萃取效率为 )。
)。(3)萃取实验中,若要使碘尽可能地完全转移到
 中,可以采取的操作是
中,可以采取的操作是(4)某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是

Ⅲ.海带中碘含量的测定
(5)若称取干海带
 ,经灼烧、浸取、
,经灼烧、浸取、 氧化等过程后配制成
氧化等过程后配制成 溶液,移取
溶液,移取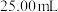 于锥形瓶中,用
于锥形瓶中,用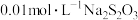 标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的
标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的 溶液的平均体积为
溶液的平均体积为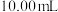 ,计算海带中含碘的质量分数为
,计算海带中含碘的质量分数为 )。若滴定结束读数时俯视刻度线,会导致测定结果
)。若滴定结束读数时俯视刻度线,会导致测定结果
您最近一年使用:0次
8 . 资源丰富的海水是工业生产中的重要原料。请按要求回答下列问题。
(1)海水中溴含量约为65 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:

①步骤ⅰ反应的化学方程式为_______ 。
②步骤ⅱ目的是_______ ;其中“通入热空气吹出 ”,利用了溴的性质是
”,利用了溴的性质是_______ 。步骤ⅱ 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
③步骤ⅲ氧化 的粒子为
的粒子为_______ ;
④步骤ⅳ分离提纯的方法是_______ ;其依据是_______ 。
(2)海带中碘含量丰富。从海带中提取碘的实验如下装置中,不能达到目的的有A_______ (填选项字母),解释A不能达到目的的原因:_______ 。
(3)海水电池在海洋能源领域备受关注。
①图1为一种锂-海水电池构造示意图。N极反应式为_______ 。
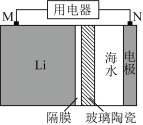
②欲用图2电解装置制得漂白液(NaClO为有效成分)可将其a极与锂-海水电池图1的_______ (填“M”或“N”)极连接;理论上该电解总反应的生成物中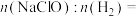
_______ 。
(1)海水中溴含量约为65
 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:
①步骤ⅰ反应的化学方程式为
②步骤ⅱ目的是
 ”,利用了溴的性质是
”,利用了溴的性质是 参与反应的离子方程式为
参与反应的离子方程式为③步骤ⅲ氧化
 的粒子为
的粒子为④步骤ⅳ分离提纯的方法是
(2)海带中碘含量丰富。从海带中提取碘的实验如下装置中,不能达到目的的有A
| A | B | C |
 | 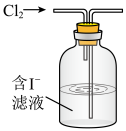 | 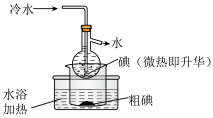 |
| 灼烧碎海带 | 获得碘水 | 提纯碘 |
(3)海水电池在海洋能源领域备受关注。
①图1为一种锂-海水电池构造示意图。N极反应式为

②欲用图2电解装置制得漂白液(NaClO为有效成分)可将其a极与锂-海水电池图1的
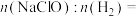

您最近一年使用:0次
名校
9 . I、海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如图:
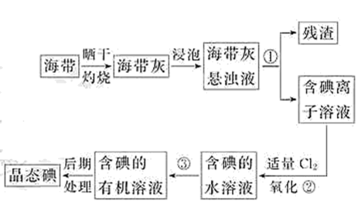
(1)指出提取碘的过程中有关的实验操作名称:①__________ ;③__________ 。
(2)提取碘的过程中,可供选择的有关试剂是__________ 。
A.甲苯,酒精 B.四氯化碳,苯 C.汽油,乙酸 D.汽油,甘油
(3)含碘的有机溶液后期处理得到晶态碘需要进行的操作为__________ ;最后,晶态碘在__________ 里聚集。
II、实验室用密度为1.18 g/mL,质量分数为36.5%浓盐酸配制250 mL 0.1 mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250 mL 0.1 mol/L的盐酸溶液。应量取盐酸体积__________ mL。
(2)配制时,其正确的操作顺序是__________ 。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
a.BCAFED b.BCFED c.BCAED
(3)操作B中,使用量筒量取液体时视线俯视会造成配制液体浓度_____ (偏高、偏低或无影响)。操作E中加水超过刻度线该如何处理?______

(1)指出提取碘的过程中有关的实验操作名称:①
(2)提取碘的过程中,可供选择的有关试剂是
A.甲苯,酒精 B.四氯化碳,苯 C.汽油,乙酸 D.汽油,甘油
(3)含碘的有机溶液后期处理得到晶态碘需要进行的操作为
II、实验室用密度为1.18 g/mL,质量分数为36.5%浓盐酸配制250 mL 0.1 mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250 mL 0.1 mol/L的盐酸溶液。应量取盐酸体积
(2)配制时,其正确的操作顺序是
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
a.BCAFED b.BCFED c.BCAED
(3)操作B中,使用量筒量取液体时视线俯视会造成配制液体浓度
您最近一年使用:0次
名校
10 . 从海产品中提取碘是我国工业上获取碘的重要途径,实验室证明海带中存在碘元素的方法如下:
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的_______ (填标号)。
a. b.
b.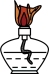 c.
c. d.
d.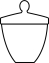
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。
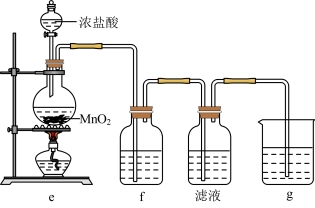
①装置e中发生反应的化学方程式是_______ 。
②装置f、g中所装的试剂分别是_______ 、_______ 。
③检验“滤液”中有碘单质生成的方法是_______ 。若通入 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是_______ 。
(3)“步骤Ⅲ”氧化剂氧化时,用 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是_______ 。
(4)若“步骤Ⅲ”所得溶液经过分离提纯获得 ,其物质的量是
,其物质的量是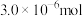 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是_______ mg/kg。
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的
a.
 b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。

①装置e中发生反应的化学方程式是
②装置f、g中所装的试剂分别是
③检验“滤液”中有碘单质生成的方法是
 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是(3)“步骤Ⅲ”氧化剂氧化时,用
 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是(4)若“步骤Ⅲ”所得溶液经过分离提纯获得
 ,其物质的量是
,其物质的量是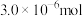 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是
您最近一年使用:0次
2022-07-20更新
|
515次组卷
|
3卷引用:山西省大同市第二中学校2023届高三上学期开学考试化学试题



