解题方法
1 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
Ⅰ.海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:_______ 中进行。
(2)操作Ⅰ中具体实验步骤:_______
(3)为寻找氯水的替代品,某同学设计了用 代替氯水。请写出此反应的离子方程式:
代替氯水。请写出此反应的离子方程式:_______ 。
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其流程如图所示,试回答下列问题:_______ 。
(5)步骤Ⅱ中涉及的离子方程式如下,请在下面横线上填入适当的化学计量数_______ 。
_______ _______
_______ _______
_______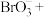 _______
_______ _______
_______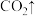
(6)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:_______ 。
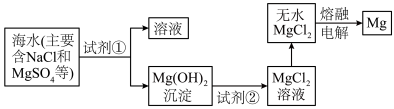
Ⅲ.镁及其合金是一种用途很广的金属材料,目前60%的镁是从海水中提取的。主要步骤如下: 转化为
转化为 ,试剂①工业上选用
,试剂①工业上选用_______ (填化学式)。
(8)熔融状态的无水 通电后会产生Mg和
通电后会产生Mg和 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:_______ 。
Ⅰ.海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(2)操作Ⅰ中具体实验步骤:
(3)为寻找氯水的替代品,某同学设计了用
 代替氯水。请写出此反应的离子方程式:
代替氯水。请写出此反应的离子方程式:Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其流程如图所示,试回答下列问题:

(5)步骤Ⅱ中涉及的离子方程式如下,请在下面横线上填入适当的化学计量数
_______
 _______
_______ _______
_______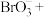 _______
_______ _______
_______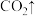
(6)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:
Ⅲ.镁及其合金是一种用途很广的金属材料,目前60%的镁是从海水中提取的。主要步骤如下:
 转化为
转化为 ,试剂①工业上选用
,试剂①工业上选用(8)熔融状态的无水
 通电后会产生Mg和
通电后会产生Mg和 ,试写出该反应的化学方程式:
,试写出该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 碘是生物必需的一种微量元素,海带、海藻等食物含碘量最为丰富.某小组通过实验提取并测定干海带中碘的含量.回答下列问题:
Ⅰ.从海带中提取碘.该小组同学按如图实验流程进行实验:______ (填仪器名称)。______ (用离子方程式表示)。
Ⅱ.滴定法测海带中碘的含量。
用 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为:
的水溶液,淀粉溶液作指示剂。原理为: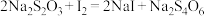 ,
,
(3)用酸式滴定管量取 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是__________ 。
(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。
猜想1:碘离子被______ 氧化;
猜想2:碘离子被步骤iii中过量的 氧化;
氧化;
②验证猜想
③查阅资料 小组同学认为可能是反应速率不同造成的, 氧化
氧化 的速率
的速率______ (填“快于”或“慢于”) 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。
④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案____________ 。
⑤完成实验 小组同学修正方案后,取5.000 g干海带进行测定,消耗15.75 mL
 溶液,则干海带中碘的含量为
溶液,则干海带中碘的含量为______ mg/g(保留2位有效数字)。
Ⅰ.从海带中提取碘.该小组同学按如图实验流程进行实验:

Ⅱ.滴定法测海带中碘的含量。
用
 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为:
的水溶液,淀粉溶液作指示剂。原理为: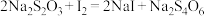 ,
,(3)用酸式滴定管量取
 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。

猜想1:碘离子被
猜想2:碘离子被步骤iii中过量的
 氧化;
氧化;②验证猜想
| 序号 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量原海带浸出液,加入硫酸酸化,再滴加几滴淀粉溶液,鼓入空气 | 待测液始终保持无色 | 猜想1不成立 |
| 2 | 将2mL KI溶液、2滴 KI溶液、2滴  溶液、2滴淀粉溶液和1滴 溶液、2滴淀粉溶液和1滴  溶液混合配制待测液,用 溶液混合配制待测液,用 溶液滴定 溶液滴定 | 猜想2不成立 |
 氧化
氧化 的速率
的速率 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案
⑤完成实验 小组同学修正方案后,取5.000 g干海带进行测定,消耗15.75 mL

 溶液,则干海带中碘的含量为
溶液,则干海带中碘的含量为
您最近一年使用:0次
2024-04-16更新
|
651次组卷
|
2卷引用:广东省佛山市2024届高三教学质量检测(一)化学试题
3 . Ⅰ.海水中的氯化钠被提纯和精制后,可通过电解饱和食盐水制取氯气、氢气和氢氧化钠。实验室电解饱和食盐水所用装置如下图所示:___________ 。
A.试管 B.离心试管 C.U形管 D.Y形试管
②在a的两端滴加酚酞试液,通电后左边电极周围出现红色,写出该电极的电极反应式说明溶液变红的原因___________ 。
(2)通电后试管b中淀粉KI溶液由无色变为蓝色,结合离子方程式说明变化原因。___________ 。
(3)c处出来的气体可以点燃,其燃烧的现象是___________ 。
Ⅱ.地球上99%的溴元素分布在海洋中。空气吹出法工艺是目前“海水提溴”的主要方法之一,工艺流程如下图所示:
(5)上述流程中热空气吹出已经得到了粗溴,为什么还要添加“SO2吸收、氧化、水蒸气吹出”三个步骤,其目的是___________ 。
Ⅲ.海洋中的海带等海藻类植物具有富集碘的能力,工业上获取碘的主要流程如下图所示:
Ⅳ.硫元素和氮元素也存在于海洋中。
(7) 是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是
是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是___________ 。
(8)氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环起始于氮的固定,过程可用下图表示。下列关于海洋氮循环的说法正确的是___________。
(9)N、O、S三种元素第一电离能由大到小的顺序为___________ 。
A.O > S > N B.S > N > O C.N > O > S D.O > N > S
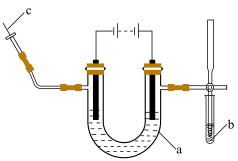
A.试管 B.离心试管 C.U形管 D.Y形试管
②在a的两端滴加酚酞试液,通电后左边电极周围出现红色,写出该电极的电极反应式说明溶液变红的原因
(2)通电后试管b中淀粉KI溶液由无色变为蓝色,结合离子方程式说明变化原因。
(3)c处出来的气体可以点燃,其燃烧的现象是
Ⅱ.地球上99%的溴元素分布在海洋中。空气吹出法工艺是目前“海水提溴”的主要方法之一,工艺流程如下图所示:
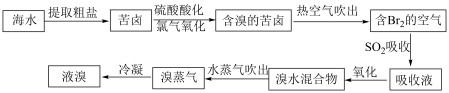
| A.溴离子的还原性 | B.溴单质的还原性 | C.溴的沸点高 | D.HBr极易溶于水 |
(5)上述流程中热空气吹出已经得到了粗溴,为什么还要添加“SO2吸收、氧化、水蒸气吹出”三个步骤,其目的是
Ⅲ.海洋中的海带等海藻类植物具有富集碘的能力,工业上获取碘的主要流程如下图所示:
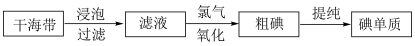
| A.酒精 | B.裂化汽油 | C.四氯化碳 | D.乙酸 |
Ⅳ.硫元素和氮元素也存在于海洋中。
(7)
 是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是
是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是(8)氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环起始于氮的固定,过程可用下图表示。下列关于海洋氮循环的说法正确的是___________。
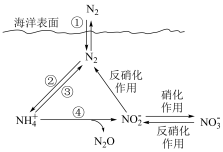
| A.海洋中的氮循环起始于氮的氧化 | B.海洋中的氮循环属于固氮作用的是③ |
| C.海洋中的硝化作用可能有氧气的参与 | D.NH4NO3中只含离子键 |
(9)N、O、S三种元素第一电离能由大到小的顺序为
A.O > S > N B.S > N > O C.N > O > S D.O > N > S
您最近一年使用:0次
2024-03-16更新
|
135次组卷
|
2卷引用:上海市宝山区2024届高三一模化学试题
23-24高一上·上海·期末
4 . 为了从海带浸取液中提取碘,某同学设计了如图实验方案,解答下列问题:
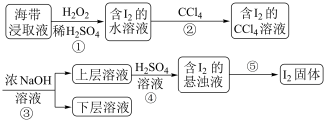
(1) 被称作绿色氧化剂的两个原因
被称作绿色氧化剂的两个原因_______ ;_______
(2)实验操作②的名称为_______ ,操作②需要的仪器除烧杯、玻璃棒外,尚缺少的玻璃仪器有_______ ,碘的 溶液位于
溶液位于_______ 层(填“上”或“下”),呈_______ 色。检验水层是否仍含碘单质的方法是_______ 。
(3)③是将富集在 中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为
中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为 ,接下来④发生的反应方程式为
,接下来④发生的反应方程式为_______ 。
(4)本实验中可以循环利用的物质是_______ 。

(1)
 被称作绿色氧化剂的两个原因
被称作绿色氧化剂的两个原因(2)实验操作②的名称为
 溶液位于
溶液位于(3)③是将富集在
 中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为
中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为 ,接下来④发生的反应方程式为
,接下来④发生的反应方程式为(4)本实验中可以循环利用的物质是
您最近一年使用:0次
5 . I.溴有“海洋元素”之称,海水中溴含量为65mg•L-1。空气吹出法工艺是目前“海水提溴”的最主要方法之一,其步骤如下:
(1)步骤①中获得Br2的离子方程式为___________ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是___________ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2,共有___________ 个电子转移(用a和 的代数式表示)。
的代数式表示)。
Ⅱ.碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的实验流程如下:___________ 、___________ 。
(5)“试剂a”通常应具有一定的___________ 性。
(6)由于“溶液B”中I2的含量较低,“操作Ⅱ”能将I2 “富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___________ (填试剂标号)。
(7)“操作Ⅱ”宜选用的装置是___________ (填标号)。___________ 。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2,共有
 的代数式表示)。
的代数式表示)。Ⅱ.碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的实验流程如下:

(5)“试剂a”通常应具有一定的
(6)由于“溶液B”中I2的含量较低,“操作Ⅱ”能将I2 “富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶,不与I2反应 | 与水不互溶,不与 I2反应 | 与水不互溶,不与I2反应 | 与水不互溶,与I2反应 |
(7)“操作Ⅱ”宜选用的装置是
您最近一年使用:0次
名校
解题方法
6 . 海洋中蕴含着丰富的化学元素,是人类资源的宝库。
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。

(1)海带灼烧的目的是___________ 。海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。上述实验流程中不需要用到的仪器是___________ (从下列图中选择,写出名称)。

(2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为___________ 。
(3)加碘食盐中的碘以KIO3形式存在,证明食盐中存在IO ,必须使用的物质是
,必须使用的物质是___________ (填序号)。
①pH试纸 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④蒸馏水 ⑤食醋 ⑥醇
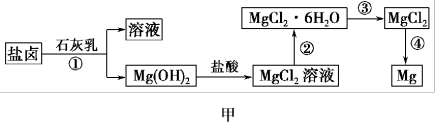
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含MgCl2、NaCl、KCl、MgSO4等)中模拟工业生产来提取镁,主要过程如图甲:
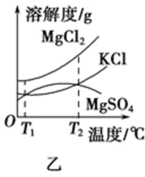
(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是___________ 。步骤③的具体操作为___________ 。
(5)写出步骤④制备金属镁的化学方程式:___________ 。该过程得到的镁蒸气需要在特定的循环中冷却,可选用___________ (填字母)作冷却剂。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。

(1)海带灼烧的目的是

(2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为
(3)加碘食盐中的碘以KIO3形式存在,证明食盐中存在IO
 ,必须使用的物质是
,必须使用的物质是①pH试纸 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④蒸馏水 ⑤食醋 ⑥醇
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含MgCl2、NaCl、KCl、MgSO4等)中模拟工业生产来提取镁,主要过程如图甲:

(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是

(5)写出步骤④制备金属镁的化学方程式:
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
您最近一年使用:0次
名校
解题方法
7 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:
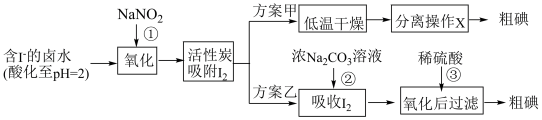
资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2;
Ⅱ.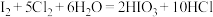 ;
;
Ⅲ.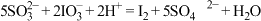 ;
;
(1)反应①生成一种无色气体,遇空气变为红棕色。则反应①的离子方程式是________ 。
(2)方案甲中,根据I2的特性,分离操作X的名称是________ 。
(3)已知I2在碱性溶液中反应生成I-和 。反应②的离子方程式是
。反应②的离子方程式是________ 。
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是________ 。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、 。请设计实验检验滤液中的
。请设计实验检验滤液中的 ,将实验方案补充完整。
,将实验方案补充完整。
可供选择的试剂:稀H2SO4、淀粉溶液、Na2SO3溶液
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B.________ 。

资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2;
Ⅱ.
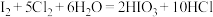 ;
;Ⅲ.
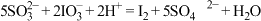 ;
;(1)反应①生成一种无色气体,遇空气变为红棕色。则反应①的离子方程式是
(2)方案甲中,根据I2的特性,分离操作X的名称是
(3)已知I2在碱性溶液中反应生成I-和
 。反应②的离子方程式是
。反应②的离子方程式是(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、
 。请设计实验检验滤液中的
。请设计实验检验滤液中的 ,将实验方案补充完整。
,将实验方案补充完整。可供选择的试剂:稀H2SO4、淀粉溶液、Na2SO3溶液
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B.
您最近一年使用:0次
名校
解题方法
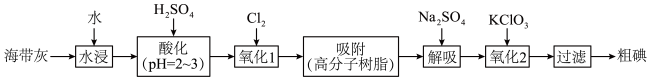
8 . 以海带为原料提取碘单质的流程如下:
(1)为提高“水浸”速率,宜采取的措施有:_____________ (任写两种);“氧化1”中 ,不宜过量的原因是
,不宜过量的原因是_____ 。
(2)“过滤”操作需要的玻璃仪器有______ (填仪器名称)。
(3)“吸附”的目的是______ 。
(4)“解吸”中氧化剂、还原剂的物质的量之比为______ 。
(5)“氧化2”中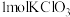 完全反应转移
完全反应转移 电子。与出该反应的离子方程式:
电子。与出该反应的离子方程式:______ 。
(6)利用如图装置提纯碘。
提纯 的原理是
的原理是______ ,棉花防止碘扩散到空气中造成污染。
(1)为提高“水浸”速率,宜采取的措施有:
 ,不宜过量的原因是
,不宜过量的原因是(2)“过滤”操作需要的玻璃仪器有
(3)“吸附”的目的是
(4)“解吸”中氧化剂、还原剂的物质的量之比为
(5)“氧化2”中
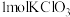 完全反应转移
完全反应转移 电子。与出该反应的离子方程式:
电子。与出该反应的离子方程式:(6)利用如图装置提纯碘。
提纯
 的原理是
的原理是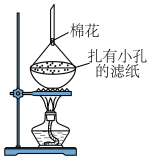
您最近一年使用:0次
2024-01-24更新
|
69次组卷
|
2卷引用:云南省楚雄东兴中学2023-2024学年高三上学期12月月考理综试题
2023高三·全国·专题练习
9 . 全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。空气吹出法工艺是目前“海水提溴”的最主要方法之一、其工艺流程如图:
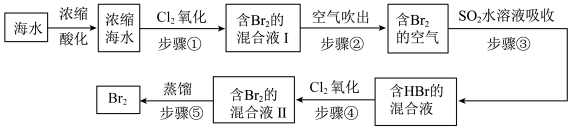
(1)步骤①中获得Br2的离子方程式为____ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收1molBr2共有___ 个电子转移(用NA的代数式表示)。
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤溶解和____ 。
(5)“试剂a”通常应具有一定的____ 性。利用H2O2完成“溶液A”向“溶液B”的转变。写出该反应的化学方程式:________________ 。
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ 。(选填编号)
(7)“操作II”宜选用的装置是 。(选填编号)
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:____ 。
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液50.0mL,恰好反应完全。则所测盐中碘的含量是____ mg•g-1(保留四位小数)。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收1molBr2共有
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤溶解和
(5)“试剂a”通常应具有一定的
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.溴水 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶不与反应 | 与水互溶与I2反应 | 与水不互溶不与I2反应 | 与水不互溶与I2反应 |
(7)“操作II”宜选用的装置是 。(选填编号)
A. | B. | C. | D. |
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液50.0mL,恰好反应完全。则所测盐中碘的含量是
您最近一年使用:0次
名校
10 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
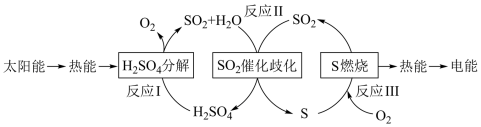
(1)已知反应 I:2H2SO4(l) 2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
反应 III:S(s) + O2 (g) SO2 (g) ΔH3 = −297 kJ/mol
SO2 (g) ΔH3 = −297 kJ/mol
所以反应 II 的热化学方程式为___________ 。
(2)试从绿色化学的角度列举该过程的优势与不足:___________ 。
上述过程中,I- 可以作为水溶液中 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO2 + 4I- + 4H+ = S↓+ 2I2 + 2H2O ⅱ.I2+ 2H2O + SO2 = + 4H+ + 2I-
+ 4H+ + 2I-
某同学为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系, 进行如下实验:分别将 18mL SO2饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2易溶解在 KI 溶液中)
(3)第 2 组是第 1 组实验的对比组,则 a=___________ 。
(4)通过比较第 1、2、3 组实验,可得出的结论是___________ 。
(5)该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是___________。

(1)已知反应 I:2H2SO4(l)
 2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol
2SO2(g) + O2 (g) + 2H2O(g) ΔH1 = 551 kJ/mol反应 III:S(s) + O2 (g)
 SO2 (g) ΔH3 = −297 kJ/mol
SO2 (g) ΔH3 = −297 kJ/mol所以反应 II 的热化学方程式为
(2)试从绿色化学的角度列举该过程的优势与不足:
上述过程中,I- 可以作为水溶液中 SO2歧化反应的催化剂,可能的催化过程如下:
ⅰ. SO2 + 4I- + 4H+ = S↓+ 2I2 + 2H2O ⅱ.I2+ 2H2O + SO2 =
 + 4H+ + 2I-
+ 4H+ + 2I-某同学为探究ⅰ、ⅱ反应速率与 SO2歧化反应速率的关系, 进行如下实验:分别将 18mL SO2饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2易溶解在 KI 溶液中)
| 序号 | 1 | 2 | 3 | 4 |
| 试剂组成 | 0.4 mol/L KI | amol/L KI、0.2 mol/L H2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI 、0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较组 1 快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较组 1 快 |
(3)第 2 组是第 1 组实验的对比组,则 a=
(4)通过比较第 1、2、3 组实验,可得出的结论是
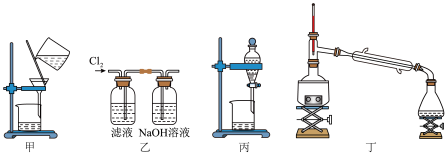
(5)该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是___________。

| A.图甲是过滤海带浸泡液 | B.图乙是向浸泡液中通入 Cl2 氧化 |
| C.图丙是含 I2 的 CCl4 溶液从下口放出 | D.图丁是提取 I2 的同时回收溶剂 |
您最近一年使用:0次



