名校
解题方法
1 . 下列劳动项目与所述的化学知识不相符的是
| 选项 | 劳动项目 | 化学知识 |
| A | 传统工艺:手工制作陶瓷 | CaCO3是陶瓷主要成分 |
| B | 学农活动:使用复合肥料培育植物 | 复合肥含N、P、K三种元素中的两种或三种 |
| C | 自主探究:海带提碘 | 通过灼烧将有机碘转化为碘离子 |
| D | 家务劳动:烹煮鱼时加入少量料酒和食醋可以去腥提鲜 | 食醋与料酒发生酯化反应,增加香味 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-24更新
|
712次组卷
|
3卷引用:广东省深圳市光明区高级中学2022届高三模拟测试(一)化学试题
2 . 下列原理或方法不能达到相应目的或现象的是
| 选项 | 目的或现象 | 原理或方法 |
| A | 去除汽车尾气中NO和CO | 催化转化: |
| B | 利用海带提取碘 | 经灼烧、溶解、过滤、氧化和萃取富集碘元素 |
| C | 维持血液的pH为7.35~7.45 | 血浆中 和 和 的浓度保持动态平衡 的浓度保持动态平衡 |
| D | 消除蚂蚁叮咬引起的皮肤不适 | 可涂抹饱和 溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 海洋资源的利用具有非常广阔的前景。
I.从海水中提取溴的过程如下:

(1)步骤“氧化”中已获得Br2.步骤“吸收”中又将Br2反应为Br-,其目的为_______ 。
(2)热空气吹出Br2,利用了溴的_______。
(3)步骤“吸收”用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为_______ 。
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
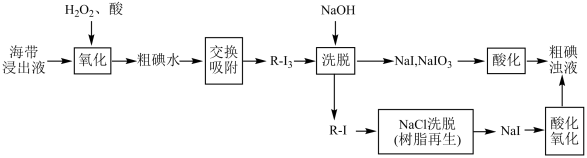
已知:①I2+I- I
I
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I )有很强的交换吸附能力。
)有很强的交换吸附能力。
③步骤“交换吸附”发生的反应:R-Cl+I =R-I3+Cl-。
=R-I3+Cl-。
试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
(5)酸性条件下,原料被H2O2氧化时发生的反应有:
①_______ ;
②I2+I- I
I 。
。
依据整个生产流程分析是否可以加过量H2O2;_______ (填“是”或“否”)。并说明理由:_______ 。
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于_______ 。
I.从海水中提取溴的过程如下:

(1)步骤“氧化”中已获得Br2.步骤“吸收”中又将Br2反应为Br-,其目的为
(2)热空气吹出Br2,利用了溴的_______。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(3)步骤“吸收”用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2+I-
 I
I
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I
 )有很强的交换吸附能力。
)有很强的交换吸附能力。③步骤“交换吸附”发生的反应:R-Cl+I
 =R-I3+Cl-。
=R-I3+Cl-。试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
| A.交换吸附 | B.洗脱 | C.酸化 | D.NaCl洗脱 |
(5)酸性条件下,原料被H2O2氧化时发生的反应有:
①
②I2+I-
 I
I 。
。依据整个生产流程分析是否可以加过量H2O2;
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于
您最近一年使用:0次
2022-04-24更新
|
1147次组卷
|
4卷引用:福建省厦门第一中学2021-2022学年高一下学期期中考试化学试题
福建省厦门第一中学2021-2022学年高一下学期期中考试化学试题(已下线)8.1.1 金属矿物和海水资源的开发利用-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省广州市第六中学2021-2022学年高一下学期综合考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期开学验收考试化学试题
名校
4 . 海水化学资源开发利用中的提碘、提溴的部分过程如图所示。下列说法正确的是
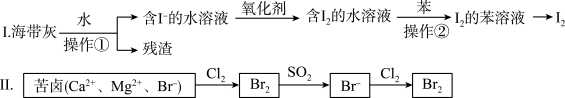
| A.I中操作①用到的玻璃仪器只有烧杯、玻璃棒、胶头滴管 |
| B.I中操作②的苯可用酒精代替 |
C.Ⅱ中SO2与Br2反应的化学方程式为: |
D.Ⅱ中还原性: |
您最近一年使用:0次
2023-04-08更新
|
635次组卷
|
3卷引用:山东省威海市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
5 . 海带灰富含以I-形式存在的碘元素。在实验室中,从海带灰浸取液中提取碘单质的流程如图:
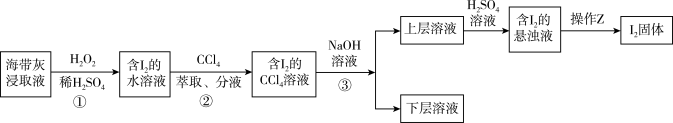
下列说法正确的是

下列说法正确的是
| A.为提高①中反应的速率,可增大硫酸浓度或在高温条件下进行 |
| B.操作②中CCl4,可用酒精、苯等代替 |
| C.操作③使用的是反萃取法,得到的上层溶液为紫红色 |
| D.操作Z所需的玻璃仪器有烧杯、玻璃棒、漏斗 |
您最近一年使用:0次
2022-07-07更新
|
584次组卷
|
4卷引用:山东省济南市2021-2022学年高一下学期期末考试化学试题
名校
解题方法
6 . 某同学检验海带中是否含有碘元素,进行了如下实验。
步骤Ⅰ:灼烧干海带得到海带灰;
步骤Ⅱ:将海带灰加蒸馏水溶解、过滤,得到海带灰浸取液;
步骤Ⅲ:取少量浸取液于试管中,加入淀粉溶液,溶液未变蓝;再加入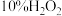 溶液(硫酸酸化),溶液变为蓝色;
溶液(硫酸酸化),溶液变为蓝色;
步骤Ⅳ:将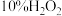 溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;
溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;
步骤Ⅴ:向步骤Ⅳ所得溶液中通入 ,溶液迅速变为蓝色。
,溶液迅速变为蓝色。
下列说法不正确的是
步骤Ⅰ:灼烧干海带得到海带灰;
步骤Ⅱ:将海带灰加蒸馏水溶解、过滤,得到海带灰浸取液;
步骤Ⅲ:取少量浸取液于试管中,加入淀粉溶液,溶液未变蓝;再加入
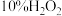 溶液(硫酸酸化),溶液变为蓝色;
溶液(硫酸酸化),溶液变为蓝色;步骤Ⅳ:将
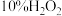 溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;
溶液(硫酸酸化)替换为氯水,重复步骤Ⅲ,溶液未变蓝;步骤Ⅴ:向步骤Ⅳ所得溶液中通入
 ,溶液迅速变为蓝色。
,溶液迅速变为蓝色。下列说法不正确的是
| A.步骤Ⅰ中,灼烧干海带的目的是除去有机化合物,获得可溶性碘化物 |
B.步骤Ⅲ中,反应的离子方程式: |
C.若将步骤Ⅴ中的 替换为 替换为 溶液,也可能观察到溶液变为蓝色 溶液,也可能观察到溶液变为蓝色 |
D.对比步骤Ⅲ、Ⅳ和Ⅴ中实验现象,说明该条件下 氧化性比氯水强 氧化性比氯水强 |
您最近一年使用:0次
2023-04-29更新
|
563次组卷
|
4卷引用:北京市丰台区2023届高三下学期二模考试化学试题
名校
解题方法
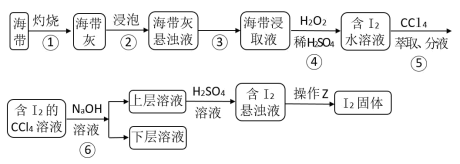
7 . 溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。从海带中提取碘单质,工艺流程如图。
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角外,还需用到的主要仪器是_____ (填名称)。
(2)海带中碘元素的存在形式为_____ (用化学符号表示)。
(3)步骤⑤的具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
①实验步骤的正确顺序为_____→_____→_____→A→H→_____→_____→_____。_____ 。
②静止、分层后,下层溶液的颜色为_____ 。
(4)步骤④中的H2O2可用以下_____ (填字母)试剂代替。
a.Cl2 b.Na2SO3 c.NaCl
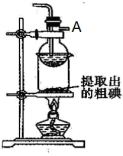
(5)步骤⑤中,某学生选择用CCl4来萃取碘的理由_____ 。
(6)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为_____ 。每消耗1molI2转移电子数为_____ 。
(7)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是_____ ;为得到较多较高纯度的单质碘,A容器中可盛放的试剂为_____ (填字母)。
a.冷水 b.热水 c.热氢氧化钠溶液
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角外,还需用到的主要仪器是
(2)海带中碘元素的存在形式为
(3)步骤⑤的具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
①实验步骤的正确顺序为_____→_____→_____→A→H→_____→_____→_____。
②静止、分层后,下层溶液的颜色为
(4)步骤④中的H2O2可用以下
a.Cl2 b.Na2SO3 c.NaCl
(5)步骤⑤中,某学生选择用CCl4来萃取碘的理由
(6)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为
(7)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是
a.冷水 b.热水 c.热氢氧化钠溶液
您最近一年使用:0次
2023-03-17更新
|
498次组卷
|
2卷引用:山东省德州市第一中学2022-2023学年高一3月月考化学试题
名校
8 . 从海产品中提取碘是我国工业上获取碘的重要途径,实验室证明海带中存在碘元素的方法如下:
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的_______ (填标号)。
a. b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。
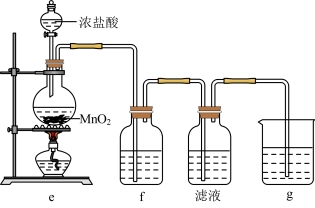
①装置e中发生反应的化学方程式是_______ 。
②装置f、g中所装的试剂分别是_______ 、_______ 。
③检验“滤液”中有碘单质生成的方法是_______ 。若通入 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是_______ 。
(3)“步骤Ⅲ”氧化剂氧化时,用 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是_______ 。
(4)若“步骤Ⅲ”所得溶液经过分离提纯获得 ,其物质的量是
,其物质的量是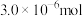 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是_______ mg/kg。
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的
a.
 b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。

①装置e中发生反应的化学方程式是
②装置f、g中所装的试剂分别是
③检验“滤液”中有碘单质生成的方法是
 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是(3)“步骤Ⅲ”氧化剂氧化时,用
 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是(4)若“步骤Ⅲ”所得溶液经过分离提纯获得
 ,其物质的量是
,其物质的量是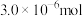 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是
您最近一年使用:0次
2022-07-20更新
|
525次组卷
|
3卷引用:辽宁省县级重点高中协作体2021-2022学年高一下学期期末考试化学试题
9 . 下列说法正确的是
| A.二氧化硅有很好的导电性,可用于制造光导纤维 |
| B.侯氏制碱法的原理是将氨通入二氧化碳的氯化钠饱和溶液中,使碳酸钠从溶液中析出 |
| C.生铁含碳2%-4.5%,将生铁进一步炼制,就可以得到用途更广泛的钢(含碳0.03%-2%) |
D.工业上以海带为原料制碘时,利用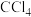 萃取碘水中的碘,分液、蒸馏获得粗碘 萃取碘水中的碘,分液、蒸馏获得粗碘 |
您最近一年使用:0次
2022-02-22更新
|
482次组卷
|
2卷引用:浙江省浙南名校联考2021-2022学年下学期高三返校联考化学试题
解题方法
10 . 浩瀚的海洋里蕴藏着丰富的化学资源,从海带中提取碘单质和从海水中提取溴单质的工艺流程如图。回答下列问题:
I.海带提碘
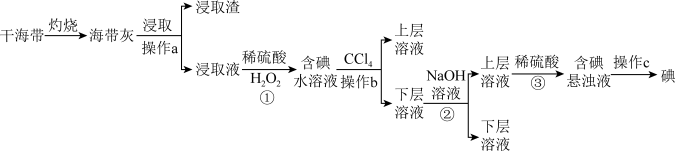
(1)在实验室进行干海带的灼烧操作时,需要用到的下列仪器有____ (填标号)。
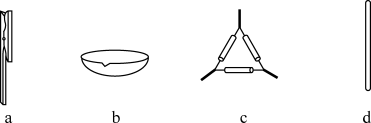
(2)浸取液中碘主要以I-存在,写出①发生反应的离子方程式____ 。
(3)操作b的名称为____ 。
(4)写出②加入NaOH溶液的目的____ ;写出③反应中氧化剂与还原剂物质的量之比为____ 。
II.海水提溴
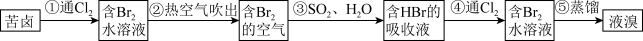
(5)流程中能说明同主族元素性质递变规律的反应为____ (写出离子方程式)。
(6)步骤③化学方程式为____ 。
I.海带提碘

(1)在实验室进行干海带的灼烧操作时,需要用到的下列仪器有

(2)浸取液中碘主要以I-存在,写出①发生反应的离子方程式
(3)操作b的名称为
(4)写出②加入NaOH溶液的目的
II.海水提溴
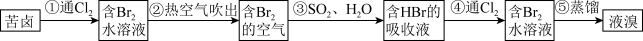
(5)流程中能说明同主族元素性质递变规律的反应为
(6)步骤③化学方程式为
您最近一年使用:0次
2022-05-23更新
|
452次组卷
|
2卷引用:山东省青岛地区2021-2022学年高一下学期期中考试化学试题



