名校
解题方法
1 . 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
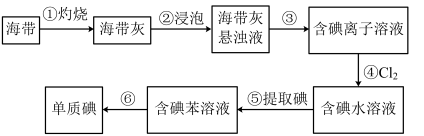
请填写下列空白:
(1)步骤③⑥的实验操作名称分别是_______ 和_______ 。步骤④反应的离子方程式是_______ 。除了氯水,从绿色化学角度考虑,最合适的试剂为_______ 。
A.浓硫酸 B.浓硝酸 C.KMnO4溶液 D.H2O2
(2)步骤⑤中,某学生选择用苯来提取碘的理由有:碘与苯不反应;苯与水不互溶:还有_______ 。从含碘水溶液中获得含碘苯溶液,该操作名称为_______ ,用到最主要仪器为_______ ,不能用酒精代替苯的理由是:_______
(3)向一容积为15 mL的试管中先加入3 mL碘水,再加入1 mL苯,充分振荡、静置后,下列图示现象正确的是_______

关于卤素氯、溴、碘的叙述,错误的是_______
a.单质易溶于有机溶剂中 b. X-的颜色逐渐加深
c.单质氧化性性逐渐减弱 d.X-的还原性逐渐增强

请填写下列空白:
(1)步骤③⑥的实验操作名称分别是
A.浓硫酸 B.浓硝酸 C.KMnO4溶液 D.H2O2
(2)步骤⑤中,某学生选择用苯来提取碘的理由有:碘与苯不反应;苯与水不互溶:还有
(3)向一容积为15 mL的试管中先加入3 mL碘水,再加入1 mL苯,充分振荡、静置后,下列图示现象正确的是

关于卤素氯、溴、碘的叙述,错误的是
a.单质易溶于有机溶剂中 b. X-的颜色逐渐加深
c.单质氧化性性逐渐减弱 d.X-的还原性逐渐增强
您最近一年使用:0次
2 . 海洋资源的利用具有非常广阔的前景。
I.从海水中提取溴的过程如下:

(1)步骤“氧化”中已获得Br2.步骤“吸收”中又将Br2反应为Br-,其目的为_______ 。
(2)热空气吹出Br2,利用了溴的_______。
(3)步骤“吸收”用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为_______ 。
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
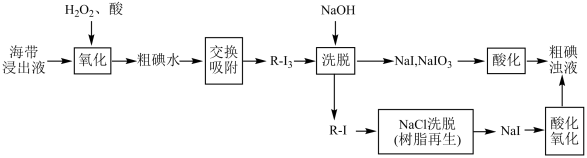
已知:①I2+I- I
I
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I )有很强的交换吸附能力。
)有很强的交换吸附能力。
③步骤“交换吸附”发生的反应:R-Cl+I =R-I3+Cl-。
=R-I3+Cl-。
试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
(5)酸性条件下,原料被H2O2氧化时发生的反应有:
①_______ ;
②I2+I- I
I 。
。
依据整个生产流程分析是否可以加过量H2O2;_______ (填“是”或“否”)。并说明理由:_______ 。
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于_______ 。
I.从海水中提取溴的过程如下:

(1)步骤“氧化”中已获得Br2.步骤“吸收”中又将Br2反应为Br-,其目的为
(2)热空气吹出Br2,利用了溴的_______。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(3)步骤“吸收”用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为
II.离子交换法从海带中提取碘是一种较为先进的制碘工艺。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2+I-
 I
I
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I
 )有很强的交换吸附能力。
)有很强的交换吸附能力。③步骤“交换吸附”发生的反应:R-Cl+I
 =R-I3+Cl-。
=R-I3+Cl-。试回答下列问题:
(4)下列各步反应中,属于氧化还原反应的有:_______(填序号)
| A.交换吸附 | B.洗脱 | C.酸化 | D.NaCl洗脱 |
(5)酸性条件下,原料被H2O2氧化时发生的反应有:
①
②I2+I-
 I
I 。
。依据整个生产流程分析是否可以加过量H2O2;
(6)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于
您最近一年使用:0次
2022-04-24更新
|
1131次组卷
|
4卷引用:福建省厦门第一中学2021-2022学年高一下学期期中考试化学试题
福建省厦门第一中学2021-2022学年高一下学期期中考试化学试题(已下线)8.1.1 金属矿物和海水资源的开发利用-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省广州市第六中学2021-2022学年高一下学期综合考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期开学验收考试化学试题
3 . 人类的生产、生活离不开化学。
(1)从海水中提取溴的工业流程如图:

①请列举两种海水淡化的方法:___________ 、___________ 。
②步骤Ⅰ中发生反应的离子方程式为___________ 。
③已知步骤Ⅰ中已获得游离态的溴,通过步骤Ⅱ在吸收塔中得到化合态的溴,其目的是___________ 。
④吹出塔中通入热空气吹出 ,利用了
,利用了 的
的___________ (填序号);吸收塔中吸收 ,利用了
,利用了 的
的___________ (填序号)。
a.氧化性b.还原性c.挥发性d.腐蚀性
(2)海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:

①由海带转化成海带灰,需要的主要仪器是___________ (填写序号并写出仪器名称)。

②若过程Ⅰ用 溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为
溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为___________
③过程Ⅱ采用的分离方法和操作是___________ 、___________ 。
此过程中可以选用的溶剂是___________ (填序号)。
a.乙醇b.四氯化碳c.水d.苯
(1)从海水中提取溴的工业流程如图:

①请列举两种海水淡化的方法:
②步骤Ⅰ中发生反应的离子方程式为
③已知步骤Ⅰ中已获得游离态的溴,通过步骤Ⅱ在吸收塔中得到化合态的溴,其目的是
④吹出塔中通入热空气吹出
 ,利用了
,利用了 的
的 ,利用了
,利用了 的
的a.氧化性b.还原性c.挥发性d.腐蚀性
(2)海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:

①由海带转化成海带灰,需要的主要仪器是

②若过程Ⅰ用
 溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为
溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为③过程Ⅱ采用的分离方法和操作是
此过程中可以选用的溶剂是
a.乙醇b.四氯化碳c.水d.苯
您最近一年使用:0次
4 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。工业上从含碘海水中制备 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性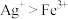 ,还原性
,还原性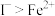 。回答下列问题:
。回答下列问题:
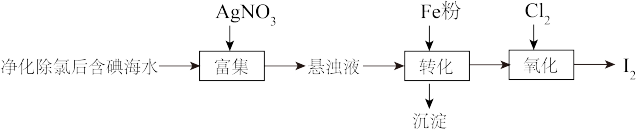
(1)海带中含有丰富的碘元素,处理时应将海带放入_______ (填仪器名称)中进行灼烧得含 的灰烬。
的灰烬。
(2)转化过程加入的Fe粉是过量的,发生的反应为: 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为_______ ;若要检验转化过程所加Fe粉是否过量,可取适量转化所得的溶液于试管中,加入_______ 溶液,观察现象。
(3)氧化过程可以用适量的酸化的 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为_______ 。用 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物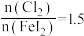 时,氧化产物为
时,氧化产物为 和
和_______ ,当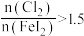 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。
(4)实验室从含碘废液(除 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
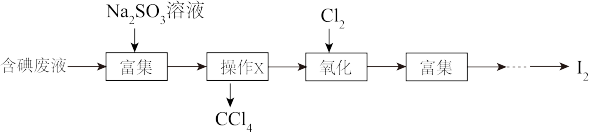
①操作X的名称为_______ 。
②向含碘废液中加入稍过量的 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是_______ 。
③氧化时,在三颈烧瓶中将含 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是_______ 。(选填字母编号)
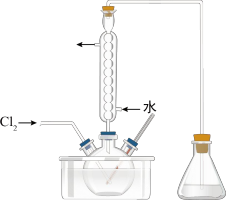
A.增大 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性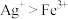 ,还原性
,还原性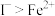 。回答下列问题:
。回答下列问题:
(1)海带中含有丰富的碘元素,处理时应将海带放入
 的灰烬。
的灰烬。(2)转化过程加入的Fe粉是过量的,发生的反应为:
 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为(3)氧化过程可以用适量的酸化的
 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物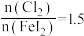 时,氧化产物为
时,氧化产物为 和
和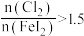 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。(4)实验室从含碘废液(除
 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
①操作X的名称为
②向含碘废液中加入稍过量的
 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是③氧化时,在三颈烧瓶中将含
 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
A.增大
 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
您最近一年使用:0次
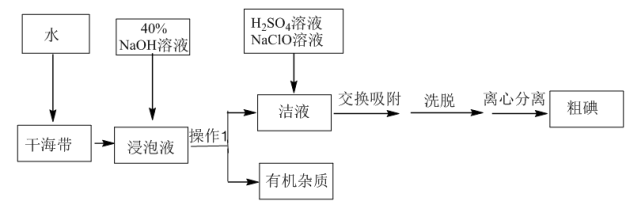
5 . 用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
已知: 交换吸附原理:
交换吸附原理: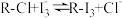 。试回答下列问题:
。试回答下列问题:
(1)操作Ⅰ的正确图示为_______。
(2)在清液中加入 和
和 溶液后,溶液最终变为棕红色,该步骤中
溶液后,溶液最终变为棕红色,该步骤中 的量要适中,请说明原因
的量要适中,请说明原因_______ 。
(3)其中交换吸附装置如图1所示,交换柱内装有氯型阴离子交换树脂( 表示),待溶液转化原理为:
表示),待溶液转化原理为: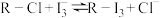 ,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
第一步:取8~10%的 溶液
溶液 注入交换柱中。碱性洗脱原理为:
注入交换柱中。碱性洗脱原理为:
 。往碱性洗脱液中滴加
。往碱性洗脱液中滴加 溶液,烧杯底部会析出一层泥状粗碘。
溶液,烧杯底部会析出一层泥状粗碘。
第二步:取10%的 溶液
溶液 注入上述交换柱中。氯化钠洗脱原理为:
注入上述交换柱中。氯化钠洗脱原理为: 。再往氯化钠洗脱液中滴加
。再往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液,溶液由无色转变棕黑色浑浊。
溶液,溶液由无色转变棕黑色浑浊。
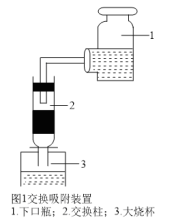
①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对 进行交换吸附,那实验中将
进行交换吸附,那实验中将 转化成
转化成 的原因可能是
的原因可能是_______ 。
②往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液反应的离子方程式
溶液反应的离子方程式_______ 。
(4)置换碘量法是分析氧化性试剂的一种常用分析方法,基本过程如下:
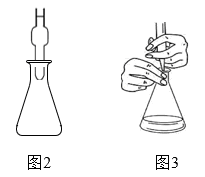
a.取3只碘量瓶,用移液管分别量取一定体积的供试品(氧化性物质)溶液于碘量瓶(图2)中
b.加入稍过量的碘化钾溶液,盖上盖子,并加纯水液封,静置或微热一段时间
c.打开瓶塞,按图3方式用标准 溶液进行滴定,重复3次
溶液进行滴定,重复3次
d.另取3只碘量瓶,用移液管分别量取一定体积准确浓度的基准液 溶液于其中
溶液于其中
e.计算标准液的浓度
f.空白实验
过程中涉及的反应过程如下:
供试品(氧化性物质)
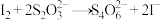

①上述操作合理的顺序是:_______ 。
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ (部分步骤可以重复)
(部分步骤可以重复)
②碘量瓶加盖并加纯水液封的主要目的是_______ 。
③已知 易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会_______ 。(填“偏大”、“偏小”或“不变”)

已知:
 交换吸附原理:
交换吸附原理: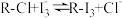 。试回答下列问题:
。试回答下列问题:(1)操作Ⅰ的正确图示为_______。
A. | B.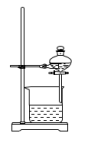 | C.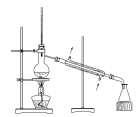 | D.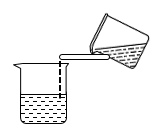 |
 和
和 溶液后,溶液最终变为棕红色,该步骤中
溶液后,溶液最终变为棕红色,该步骤中 的量要适中,请说明原因
的量要适中,请说明原因(3)其中交换吸附装置如图1所示,交换柱内装有氯型阴离子交换树脂(
 表示),待溶液转化原理为:
表示),待溶液转化原理为: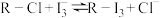 ,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行第一步:取8~10%的
 溶液
溶液 注入交换柱中。碱性洗脱原理为:
注入交换柱中。碱性洗脱原理为:
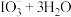 。往碱性洗脱液中滴加
。往碱性洗脱液中滴加 溶液,烧杯底部会析出一层泥状粗碘。
溶液,烧杯底部会析出一层泥状粗碘。第二步:取10%的
 溶液
溶液 注入上述交换柱中。氯化钠洗脱原理为:
注入上述交换柱中。氯化钠洗脱原理为: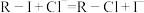 。再往氯化钠洗脱液中滴加
。再往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液,溶液由无色转变棕黑色浑浊。
溶液,溶液由无色转变棕黑色浑浊。
①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对
 进行交换吸附,那实验中将
进行交换吸附,那实验中将 转化成
转化成 的原因可能是
的原因可能是②往氯化钠洗脱液中滴加
 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液反应的离子方程式
溶液反应的离子方程式(4)置换碘量法是分析氧化性试剂的一种常用分析方法,基本过程如下:
a.取3只碘量瓶,用移液管分别量取一定体积的供试品(氧化性物质)溶液于碘量瓶(图2)中
b.加入稍过量的碘化钾溶液,盖上盖子,并加纯水液封,静置或微热一段时间
c.打开瓶塞,按图3方式用标准
 溶液进行滴定,重复3次
溶液进行滴定,重复3次d.另取3只碘量瓶,用移液管分别量取一定体积准确浓度的基准液
 溶液于其中
溶液于其中e.计算标准液的浓度
f.空白实验

过程中涉及的反应过程如下:
供试品(氧化性物质)

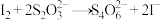

①上述操作合理的顺序是:
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ (部分步骤可以重复)
(部分步骤可以重复)②碘量瓶加盖并加纯水液封的主要目的是
③已知
 易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
您最近一年使用:0次
名校
解题方法
6 . 我国拥有很长的海岸线,海洋资源的开发利用具有广阔前景。全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。空气吹出法工艺是目前“海水提溴”的最主要方法之一、其工艺流程如图:
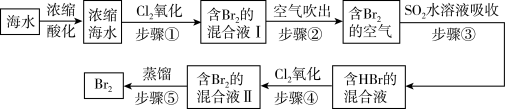
(1)步骤①中获得Br2的离子方程式为____ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2共有___ 个电子转移(用a和NA的代数式表示)。
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤:____ 、____ 。
(5)“试剂a”通常应具有一定的____ 性。
利用H2O2完成“溶液A”向“溶液B”的转变。配平该反应的化学方程式:____ 。
______KI+______H2O=______KOH+______I2
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ 。(选填编号)
(7)“操作II”宜选用的装置是____ 。(选填编号)
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:____ 。
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液30.0mL,恰好反应完全。
则所测盐中碘的含量是____ mg•g-1(保留四位小数)。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2共有
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤:
(5)“试剂a”通常应具有一定的
利用H2O2完成“溶液A”向“溶液B”的转变。配平该反应的化学方程式:
______KI+______H2O=______KOH+______I2
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶不与反应 | 与水不互溶不与I2反应 | 与水不互溶不与I2反应 | 与水不互溶与I2反应 |
(7)“操作II”宜选用的装置是
A. | B. | C. | D. |
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液30.0mL,恰好反应完全。
则所测盐中碘的含量是
您最近一年使用:0次
解题方法
7 . 开发和利用海洋资源是当前科学研究的一项重要任务,如图是某化工厂对海洋资源综合利用的流程图:
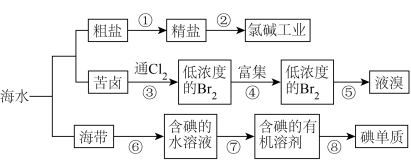
请回答下列问题:
(1)粗盐中含有泥沙、 、
、 、
、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
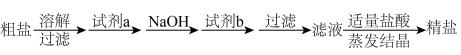
加入的试剂a、b分别是___________ 、___________ 。
(2)③中发生反应的离子方程式为___________ ,可推断氧化性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
(3)⑥通常分三个步骤:
第1步:灼烧,将足量海带灼烧成灰烬;
第2步: 溶液的获取;
溶液的获取;
第3步:氧化。
下列仪器在第1步中不会用到的有___________ 。
A.试管B.瓷坩埚C.坩埚钳D.铁三脚架E.泥三角F.酒精灯G.烧杯H.量筒
第3步中最好选用的氧化剂是___________ 。
A.浓硫酸B.新制氯水C.酸性高锰酸钾D.
(4)⑦中所用的操作方法有___________ 、___________ 。

请回答下列问题:
(1)粗盐中含有泥沙、
 、
、 、
、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
加入的试剂a、b分别是
(2)③中发生反应的离子方程式为

 (填“>”或“<”)。
(填“>”或“<”)。(3)⑥通常分三个步骤:
第1步:灼烧,将足量海带灼烧成灰烬;
第2步:
 溶液的获取;
溶液的获取;第3步:氧化。
下列仪器在第1步中不会用到的有
A.试管B.瓷坩埚C.坩埚钳D.铁三脚架E.泥三角F.酒精灯G.烧杯H.量筒
第3步中最好选用的氧化剂是
A.浓硫酸B.新制氯水C.酸性高锰酸钾D.

(4)⑦中所用的操作方法有
您最近一年使用:0次
解题方法
8 . 实验室从海带浸取液中提取碘单质。
(1)碘的结构与性质
①碘原子核外有5个电子层,最外层有7个电子,碘元素在周期表中的位置是_______ 。
②质子数为53、中子数为78的碘核素表示为_______ 。
③设计简单的实验验证氯的非金属性比碘强:_____ 。(须用试剂:新制氯水、KI溶液,淀粉溶液)
(2)提取碘单质
I.萃取氧化法:向浸取液中加入 ,调节pH为3~4,加入
,调节pH为3~4,加入 ,再加入
,再加入 溶液,反应一段时间后得到
溶液,反应一段时间后得到 的
的 溶液。
溶液。
①调pH时不用盐酸来替代 的主要原因是
的主要原因是_______ 。(填序号)
a.盐酸易挥发使溶液pH变化快, 不易挥发溶液pH缓慢
不易挥发溶液pH缓慢
b. 为弱电解质,反应过程中电离出
为弱电解质,反应过程中电离出 维持溶液的pH
维持溶液的pH
②加入 的作用是
的作用是_______ ,得到 的
的 溶液。
溶液。
II.双氧化法:把浸取液分成A、B两份,在 催化下用
催化下用 把A溶液中的
把A溶液中的 氧化为
氧化为 ,然后与B溶液混合,经盐酸酸化得到碘单质。
,然后与B溶液混合,经盐酸酸化得到碘单质。
③ 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
④A、B两份溶液的体积比为_______ 时,可使碘的提取率最高。
(3)废液的处理:提取碘后的酸性废液中含有少量的 、
、 ,向废液中加入适量
,向废液中加入适量 把
把 氧化成
氧化成 ,然后加入活性炭,过滤后排放。活性炭的作用是
,然后加入活性炭,过滤后排放。活性炭的作用是_______ 。
(1)碘的结构与性质
①碘原子核外有5个电子层,最外层有7个电子,碘元素在周期表中的位置是
②质子数为53、中子数为78的碘核素表示为
③设计简单的实验验证氯的非金属性比碘强:
(2)提取碘单质
I.萃取氧化法:向浸取液中加入
 ,调节pH为3~4,加入
,调节pH为3~4,加入 ,再加入
,再加入 溶液,反应一段时间后得到
溶液,反应一段时间后得到 的
的 溶液。
溶液。①调pH时不用盐酸来替代
 的主要原因是
的主要原因是a.盐酸易挥发使溶液pH变化快,
 不易挥发溶液pH缓慢
不易挥发溶液pH缓慢b.
 为弱电解质,反应过程中电离出
为弱电解质,反应过程中电离出 维持溶液的pH
维持溶液的pH②加入
 的作用是
的作用是 的
的 溶液。
溶液。II.双氧化法:把浸取液分成A、B两份,在
 催化下用
催化下用 把A溶液中的
把A溶液中的 氧化为
氧化为 ,然后与B溶液混合,经盐酸酸化得到碘单质。
,然后与B溶液混合,经盐酸酸化得到碘单质。③
 氧化
氧化 的离子方程式为
的离子方程式为④A、B两份溶液的体积比为
(3)废液的处理:提取碘后的酸性废液中含有少量的
 、
、 ,向废液中加入适量
,向废液中加入适量 把
把 氧化成
氧化成 ,然后加入活性炭,过滤后排放。活性炭的作用是
,然后加入活性炭,过滤后排放。活性炭的作用是
您最近一年使用:0次
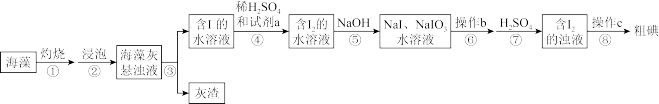
9 . 碘元素被称为“智力元素”,海洋植物如海带、海藻中存在丰富的碘元素,一般以碘离子形式存在。某小组设计实验从20.00g海藻中提取碘单质,实验流程如下:
试回答下列问题:
(1)灼烧海藻时,将海藻用___________ (填化学式)润湿后,置于___________ (填装置名称)中烧成灰烬。
(2)从下列试剂中选择可做试剂a的是___________ (填序号)。
A.H2O2 B.MnO2 C.FeCl2 D.SO2
有人提出试剂a可以是Cl2,但是使用时必须控制用量,否则生成的I2,又被Cl2氧化为+5价,该反应的化学方程式为___________
(3)操作b是___________ ,滴加稀硫酸时发生的离子反应方程式为___________ 操作c为过滤,滤液可返回至___________ (填步骤序号)操作后溶液中循环利用。
(4)碘量法常用于测量草药中可能残余的有毒元素As的含量:
①取1000g草药样品进行前期处理制得待测溶液1000mL,此时样品中含有的砷元素转化为H3AsO3;
②转移100mL待测液至250mL锥形瓶中,加入1.000×10-3mol·L-1标准I2溶液20.00mL(H3AsO3转化为H3AsO4),并加入少量的淀粉溶液;
③用1.000×103mol·L-1的硫代硫酸钠标准溶液滴定过量的碘(已知:2 +I2=2I-+
+I2=2I-+ )。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
)。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为___________ mg/kg;若滴定时溶液酸性过强,会导致测量结果___________ (填“偏高”或“偏低”)。

试回答下列问题:
(1)灼烧海藻时,将海藻用
(2)从下列试剂中选择可做试剂a的是
A.H2O2 B.MnO2 C.FeCl2 D.SO2
有人提出试剂a可以是Cl2,但是使用时必须控制用量,否则生成的I2,又被Cl2氧化为+5价,该反应的化学方程式为
(3)操作b是
(4)碘量法常用于测量草药中可能残余的有毒元素As的含量:
①取1000g草药样品进行前期处理制得待测溶液1000mL,此时样品中含有的砷元素转化为H3AsO3;
②转移100mL待测液至250mL锥形瓶中,加入1.000×10-3mol·L-1标准I2溶液20.00mL(H3AsO3转化为H3AsO4),并加入少量的淀粉溶液;
③用1.000×103mol·L-1的硫代硫酸钠标准溶液滴定过量的碘(已知:2
 +I2=2I-+
+I2=2I-+ )。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
)。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
您最近一年使用:0次
10 . 碘是人体的必需微量元素之一,海带提取碘的部分实验流程如下
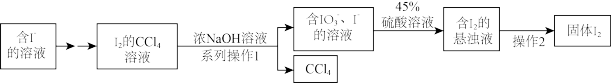
(1)系列操作1中需用到的玻璃仪器有烧杯、玻璃棒和___________ ,操作2的实验方法是___________ 。
(2)氧化 通常用
通常用 作为氧化剂,写出反应的离子方程式
作为氧化剂,写出反应的离子方程式___________ 。
(3)某实验小组研究 的氧化,将
的氧化,将 通入KI溶液中,出现黄色,查阅资料,发生了以下反应:
通入KI溶液中,出现黄色,查阅资料,发生了以下反应: 。为了探究该反应的影响因素,设计以下实验:
。为了探究该反应的影响因素,设计以下实验:
①用水吸收 制取
制取 水溶液,吸收装置最佳的是
水溶液,吸收装置最佳的是___________ 。

②实验1和2探究___________ 对实验的影响,实验2和3探究___________ 对实验的影响,实验2加蒸馏水的体积为___________ (用表中字母或字母的表达式作答)。
③添加药品的合理顺序为: 水溶液、
水溶液、___________ 、稀盐酸、___________ (填“KI溶液”或“蒸馏水”)。
④往三组实验中滴加淀粉溶液,均没有出现蓝色,你认为原因是___________ (用化学方程式解释)。检验该反应发生的实验试剂是___________ 。
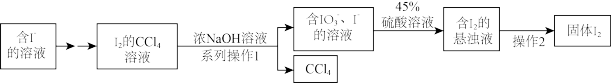
(1)系列操作1中需用到的玻璃仪器有烧杯、玻璃棒和
(2)氧化
 通常用
通常用 作为氧化剂,写出反应的离子方程式
作为氧化剂,写出反应的离子方程式(3)某实验小组研究
 的氧化,将
的氧化,将 通入KI溶液中,出现黄色,查阅资料,发生了以下反应:
通入KI溶液中,出现黄色,查阅资料,发生了以下反应: 。为了探究该反应的影响因素,设计以下实验:
。为了探究该反应的影响因素,设计以下实验:| 实验序号 |  水溶液(mL) 水溶液(mL) |  溶液(mL) 溶液(mL) | 稀盐酸(mL) | 蒸馏水(mL) | 实验现象 |
| 1 | a(过量) | b | 0 | d | 溶液逐渐变浅黄色 |
| 2 | a(过量) | b | c | ___________ | 溶液变黄,有浑浊 |
| 3 | a(过量) | 2b | c | 0 | 溶液变黄,比实验2出现浑浊更快 |
 制取
制取 水溶液,吸收装置最佳的是
水溶液,吸收装置最佳的是
②实验1和2探究
③添加药品的合理顺序为:
 水溶液、
水溶液、④往三组实验中滴加淀粉溶液,均没有出现蓝色,你认为原因是
您最近一年使用:0次
2021-08-04更新
|
586次组卷
|
3卷引用:广东省2022届高三8月阶段性质量检测化学试题



