1 . 海带中含有丰富的碘,某中学实验小组为了提取和检验海带灰中的碘,设计了以下实验流程。(已知:海带灰中的碘元素主要以 形式存在)
形式存在)
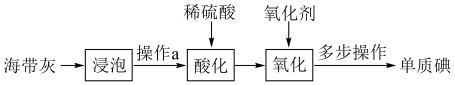
(1)“浸泡”时需充分搅拌,并将悬浊液煮沸2~3分钟,主要的目的是___________ (写一条即可)。
(2)操作a需要用到的玻璃仪器,除烧杯外,还需要___________ 。
(3)“酸化”时需要稀硫酸,回答下列有关问题:
①配制 稀硫酸,需要质量分数为98%的浓硫酸(密度:
稀硫酸,需要质量分数为98%的浓硫酸(密度: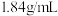 )的体积约为
)的体积约为___________  。(已知:用量筒取用浓硫酸)
。(已知:用量筒取用浓硫酸)
②配制过程的部分操作如下图,则操作步骤的正确顺序为___________ 。(用字母序号表示)
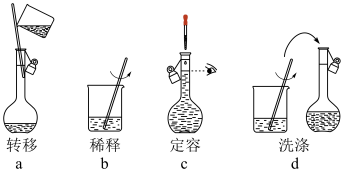
③下列有关配制上述稀硫酸的描述正确的是___________
A.稀释时将蒸馏水缓缓注入盛有浓硫酸的烧杯中
B.溶液未冷却至室温,立即转移、定容
C.定容时俯视容量瓶的刻度线,导致所配溶液的浓度偏大
D.将所配的稀硫酸分装于带橡胶塞的广口瓶中
(4)“氧化”时氧化剂的选择将影响实验结果。
①若选用 ,“氧化”时发生反应的离子方程式为
,“氧化”时发生反应的离子方程式为___________ 。
②若选用 ,过量的
,过量的 可将碘单质氧化成
可将碘单质氧化成 ,其反应的化学方程式为
,其反应的化学方程式为___________ 。
(5)检验“氧化”后的水溶液中是否含有单质碘的实验操作方法___________ 。
 形式存在)
形式存在)
(1)“浸泡”时需充分搅拌,并将悬浊液煮沸2~3分钟,主要的目的是
(2)操作a需要用到的玻璃仪器,除烧杯外,还需要
(3)“酸化”时需要稀硫酸,回答下列有关问题:
①配制
 稀硫酸,需要质量分数为98%的浓硫酸(密度:
稀硫酸,需要质量分数为98%的浓硫酸(密度: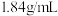 )的体积约为
)的体积约为 。(已知:用量筒取用浓硫酸)
。(已知:用量筒取用浓硫酸)②配制过程的部分操作如下图,则操作步骤的正确顺序为

③下列有关配制上述稀硫酸的描述正确的是
A.稀释时将蒸馏水缓缓注入盛有浓硫酸的烧杯中
B.溶液未冷却至室温,立即转移、定容
C.定容时俯视容量瓶的刻度线,导致所配溶液的浓度偏大
D.将所配的稀硫酸分装于带橡胶塞的广口瓶中
(4)“氧化”时氧化剂的选择将影响实验结果。
①若选用
 ,“氧化”时发生反应的离子方程式为
,“氧化”时发生反应的离子方程式为②若选用
 ,过量的
,过量的 可将碘单质氧化成
可将碘单质氧化成 ,其反应的化学方程式为
,其反应的化学方程式为(5)检验“氧化”后的水溶液中是否含有单质碘的实验操作方法
您最近一年使用:0次
解题方法
2 . 碘是生物必需的一种微量元素,海带、海藻等食物含碘量最为丰富.某小组通过实验提取并测定干海带中碘的含量.回答下列问题:
Ⅰ.从海带中提取碘.该小组同学按如图实验流程进行实验:______ (填仪器名称)。______ (用离子方程式表示)。
Ⅱ.滴定法测海带中碘的含量。
用 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为:
的水溶液,淀粉溶液作指示剂。原理为: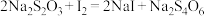 ,
,
(3)用酸式滴定管量取 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是__________ 。
(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。
猜想1:碘离子被______ 氧化;
猜想2:碘离子被步骤iii中过量的 氧化;
氧化;
②验证猜想
③查阅资料 小组同学认为可能是反应速率不同造成的, 氧化
氧化 的速率
的速率______ (填“快于”或“慢于”) 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。
④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案____________ 。
⑤完成实验 小组同学修正方案后,取5.000 g干海带进行测定,消耗15.75 mL
 溶液,则干海带中碘的含量为
溶液,则干海带中碘的含量为______ mg/g(保留2位有效数字)。
Ⅰ.从海带中提取碘.该小组同学按如图实验流程进行实验:

Ⅱ.滴定法测海带中碘的含量。
用
 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为:
的水溶液,淀粉溶液作指示剂。原理为: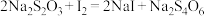 ,
,(3)用酸式滴定管量取
 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。

猜想1:碘离子被
猜想2:碘离子被步骤iii中过量的
 氧化;
氧化;②验证猜想
| 序号 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量原海带浸出液,加入硫酸酸化,再滴加几滴淀粉溶液,鼓入空气 | 待测液始终保持无色 | 猜想1不成立 |
| 2 | 将2mL KI溶液、2滴 KI溶液、2滴  溶液、2滴淀粉溶液和1滴 溶液、2滴淀粉溶液和1滴  溶液混合配制待测液,用 溶液混合配制待测液,用 溶液滴定 溶液滴定 | 猜想2不成立 |
 氧化
氧化 的速率
的速率 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案
⑤完成实验 小组同学修正方案后,取5.000 g干海带进行测定,消耗15.75 mL

 溶液,则干海带中碘的含量为
溶液,则干海带中碘的含量为
您最近一年使用:0次
2024-04-16更新
|
633次组卷
|
2卷引用:广东省佛山市2024届高三教学质量检测(一)化学试题
3 . 我国拥有很长的海岸线,具有丰富的海洋资源。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。
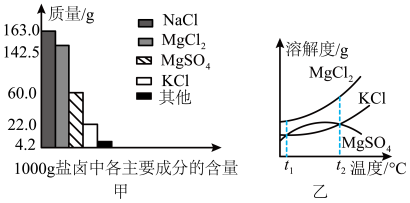
(1)根据图甲所示,写出盐卤中含量最多的盐为__________ 。(填化学式)
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到 以上,根据溶解度曲线,首先析出的晶体应是
以上,根据溶解度曲线,首先析出的晶体应是__________ 。(填化学式)
(3)如图是常用于混合物的分离和提纯的装置:
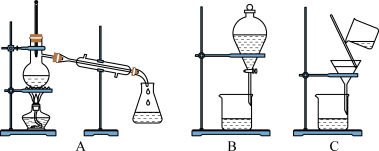
粗盐的提纯应选择图__________ (填字母,下同)装置,若实验中为了除去粗盐中的 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是__________ 。
A.NaOH、 、
、 、HCl B.NaOH、
、HCl B.NaOH、 、
、 、HCl
、HCl
C. 、
、 、NaOH、HCl D.
、NaOH、HCl D. 、NaOH、
、NaOH、 、HCl
、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。

(4)实验步骤①会用到下列仪器中的__________ (填字母)
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中 的存在,
的存在,______________________________ 。
(6)“提取碘”存在以下两种方案。
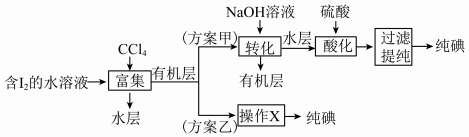
①方案乙中“操作X”的名称是__________ 。
②该流程可循环利用的物质是__________ 。
③采用方案乙得到纯碘的产率较低,原因是______________________________ 。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。

(1)根据图甲所示,写出盐卤中含量最多的盐为
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到
 以上,根据溶解度曲线,首先析出的晶体应是
以上,根据溶解度曲线,首先析出的晶体应是(3)如图是常用于混合物的分离和提纯的装置:

粗盐的提纯应选择图
 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是A.NaOH、
 、
、 、HCl B.NaOH、
、HCl B.NaOH、 、
、 、HCl
、HClC.
 、
、 、NaOH、HCl D.
、NaOH、HCl D. 、NaOH、
、NaOH、 、HCl
、HClⅡ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。

(4)实验步骤①会用到下列仪器中的
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中
 的存在,
的存在,(6)“提取碘”存在以下两种方案。

①方案乙中“操作X”的名称是
②该流程可循环利用的物质是
③采用方案乙得到纯碘的产率较低,原因是
您最近一年使用:0次
2023-12-27更新
|
160次组卷
|
2卷引用:河北省保定市1+3联考2023-2024学年高一上学期12月月考化学试题
名校
解题方法
4 . 某学习小组按如下实验流程探究海带中碘含量的测定和碘的提取。
Ⅰ.碘含量的测定

(1)灼烧海带实验用到的主要的含硅酸盐的仪器有酒精灯、玻璃棒、___________ 、___________ 等。
(2)仪器A的名称为:___________ 。
(3)碘浓度还可用色度计测定吸光度,吸光度越大碘浓度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(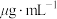 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的 溶液,再从中取出0.10mL加入
溶液,再从中取出0.10mL加入 中配得第一份4.00mL碘的
中配得第一份4.00mL碘的 标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是___________ 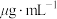 。(注:
。(注: )
)
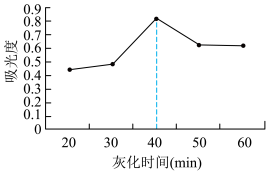
(4)课题组在其他实验条件相同情况下,研究了不同灰化时间(干海带灼烧成灰的时间)对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是___________ 。
Ⅱ.碘的提取
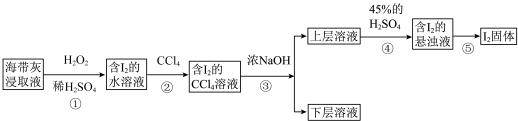
某同学另取海带原液设计如下实验方案提取碘:
步骤③的离子反应方程式为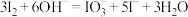
(5)步骤①中发生反应的离子方程式为___________ 。
(6)向含有 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象为
振荡静置后的实验现象为___________ 。
(7)步骤④发生反应的离子方程式为___________ 。
Ⅰ.碘含量的测定

(1)灼烧海带实验用到的主要的含硅酸盐的仪器有酒精灯、玻璃棒、
(2)仪器A的名称为:
(3)碘浓度还可用色度计测定吸光度,吸光度越大碘浓度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(
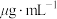 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的 溶液,再从中取出0.10mL加入
溶液,再从中取出0.10mL加入 中配得第一份4.00mL碘的
中配得第一份4.00mL碘的 标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是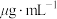 。(注:
。(注: )
)(4)课题组在其他实验条件相同情况下,研究了不同灰化时间(干海带灼烧成灰的时间)对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是

Ⅱ.碘的提取
某同学另取海带原液设计如下实验方案提取碘:

步骤③的离子反应方程式为
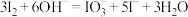
(5)步骤①中发生反应的离子方程式为
(6)向含有
 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象为
振荡静置后的实验现象为(7)步骤④发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 海洋植物如海带、海藻中含有丰富的碘元素,其中碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如图。
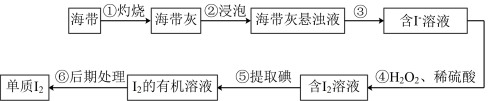
(1)步骤①所用硅酸盐仪器除酒精灯、瓷坩埚外,还有___________ 。
(2)写出步骤④中主要反应的离子方程式:___________ 。
(3)步骤⑤操作的名称为___________ ;若该步骤用的有机溶剂为苯,则得到 的有机溶液的操作为充分振荡放气后,静置分层,
的有机溶液的操作为充分振荡放气后,静置分层,___________ ,该步骤还可选择的有关试剂是___________ (填标号)。
a.酒精 b.四氯化碳 c.饱和食盐水
(4)流程中后期处理用反萃取法:
碘的有机溶液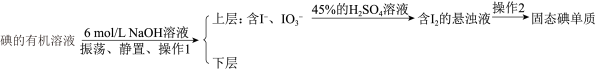
①碘单质与 溶液(即浓溶液)发生反应的离子方程式为
溶液(即浓溶液)发生反应的离子方程式为___________ ,该反应中氧化剂与还原剂的质量之比为___________ 。
(2) 与
与 在
在 的
的 溶液中能发生反应,反应的化学方程式为
溶液中能发生反应,反应的化学方程式为___________ 。
(5)实验室常用碘量法测定某溶液中 的含量。取
的含量。取 该溶液,加入
该溶液,加入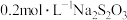 溶液,充分反应后,消耗
溶液,充分反应后,消耗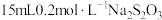 溶液。则该溶液中
溶液。则该溶液中 的含量是
的含量是___________  。(离子方程式为
。(离子方程式为 )
)

(1)步骤①所用硅酸盐仪器除酒精灯、瓷坩埚外,还有
(2)写出步骤④中主要反应的离子方程式:
(3)步骤⑤操作的名称为
 的有机溶液的操作为充分振荡放气后,静置分层,
的有机溶液的操作为充分振荡放气后,静置分层,a.酒精 b.四氯化碳 c.饱和食盐水
(4)流程中后期处理用反萃取法:
碘的有机溶液
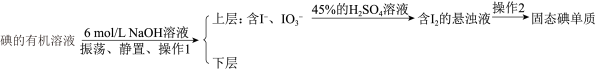
①碘单质与
 溶液(即浓溶液)发生反应的离子方程式为
溶液(即浓溶液)发生反应的离子方程式为(2)
 与
与 在
在 的
的 溶液中能发生反应,反应的化学方程式为
溶液中能发生反应,反应的化学方程式为(5)实验室常用碘量法测定某溶液中
 的含量。取
的含量。取 该溶液,加入
该溶液,加入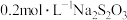 溶液,充分反应后,消耗
溶液,充分反应后,消耗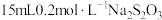 溶液。则该溶液中
溶液。则该溶液中 的含量是
的含量是 。(离子方程式为
。(离子方程式为 )
)
您最近一年使用:0次
名校
解题方法
6 . 海洋资源的利用具有非常广阔的前景,从海水中可提取多种化工原料。
Ⅰ.如图是从海水中提取镁的简单流程,回答下列问题:

(1)工业上常用于沉淀 的试剂A是
的试剂A是___________ ,操作A的名称是___________ 。
(2)由无水 制取Mg的化学方程式是
制取Mg的化学方程式是___________ 。
Ⅱ.海水中Br含量为 ,工业上常用“吹出法”从海水中提溴,工艺流程示意图如图,回答下列问题:
,工业上常用“吹出法”从海水中提溴,工艺流程示意图如图,回答下列问题:
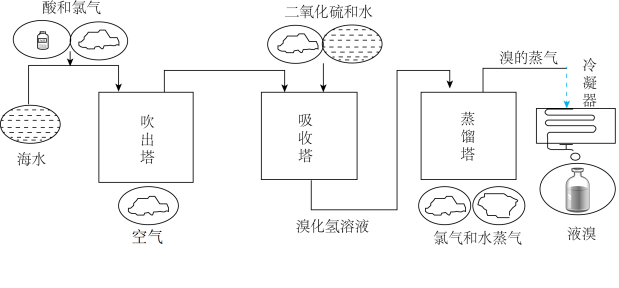
(3)鼓入热空气将生成的溴吹出,利用了 的
的___________ 性。
(4)吸收塔中 的吸收率可达95%,吸收塔中主要反应的方程式是
的吸收率可达95%,吸收塔中主要反应的方程式是 。也有工艺是在吹出
。也有工艺是在吹出 后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,该反应的离子方程式是
后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,该反应的离子方程式是___________ 。
Ⅲ.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计如下实验:

(5)步骤①中灼烧海带时,应将海带放入___________ (填仪器名称)中灼烧。
(6)步骤④发生的离子反应方程式为___________ 。
(7)实验室常用碘量法测定溶液中 的含量。取200mL样品,加入
的含量。取200mL样品,加入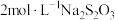 溶液,发生反应
溶液,发生反应 ,充分反应后,消耗
,充分反应后,消耗 溶液100mL。则该样品中
溶液100mL。则该样品中 的含量是
的含量是___________ 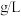 。
。
Ⅰ.如图是从海水中提取镁的简单流程,回答下列问题:

(1)工业上常用于沉淀
 的试剂A是
的试剂A是(2)由无水
 制取Mg的化学方程式是
制取Mg的化学方程式是Ⅱ.海水中Br含量为
 ,工业上常用“吹出法”从海水中提溴,工艺流程示意图如图,回答下列问题:
,工业上常用“吹出法”从海水中提溴,工艺流程示意图如图,回答下列问题:
(3)鼓入热空气将生成的溴吹出,利用了
 的
的(4)吸收塔中
 的吸收率可达95%,吸收塔中主要反应的方程式是
的吸收率可达95%,吸收塔中主要反应的方程式是 。也有工艺是在吹出
。也有工艺是在吹出 后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,该反应的离子方程式是
后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,该反应的离子方程式是Ⅲ.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计如下实验:

(5)步骤①中灼烧海带时,应将海带放入
(6)步骤④发生的离子反应方程式为
(7)实验室常用碘量法测定溶液中
 的含量。取200mL样品,加入
的含量。取200mL样品,加入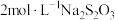 溶液,发生反应
溶液,发生反应 ,充分反应后,消耗
,充分反应后,消耗 溶液100mL。则该样品中
溶液100mL。则该样品中 的含量是
的含量是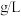 。
。
您最近一年使用:0次
解题方法
7 . 食品添加剂的常见类别有:着色剂、增味剂、膨松剂、凝固剂、防腐剂、营养强化剂等。
(1)碘酸钾为___________ (填食品添加剂的类别)。
(2)从海带中提取碘的主要实验过程如下图所示:

①干海带的“灼烧”需在___________ (填仪器名称)中进行。
②操作1为___________ (填操作名称)。
③在“氧化”步骤中,最符合绿色化学思想的氧化剂是下列物质中的___________ (填选项字母),酸性条件下该反应的离子方程式为___________ 。
A. 溶液 B.浓硝酸 C.
溶液 B.浓硝酸 C.
④检验操作2后水层中是否含有碘单质的方法为___________ 。
(3)在加热条件下,将 通入到
通入到 和
和 的混合溶液中制备
的混合溶液中制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;若要制备500g的加碘食盐(碘含量为2.54%),至少需要
___________ g。
(1)碘酸钾为
(2)从海带中提取碘的主要实验过程如下图所示:

①干海带的“灼烧”需在
②操作1为
③在“氧化”步骤中,最符合绿色化学思想的氧化剂是下列物质中的
A.
 溶液 B.浓硝酸 C.
溶液 B.浓硝酸 C.
④检验操作2后水层中是否含有碘单质的方法为
(3)在加热条件下,将
 通入到
通入到 和
和 的混合溶液中制备
的混合溶液中制备 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
8 . 资源丰富的海水是工业生产中的重要原料。请按要求回答下列问题。
(1)海水中溴含量约为65 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:

①步骤ⅰ反应的化学方程式为_______ 。
②步骤ⅱ目的是_______ ;其中“通入热空气吹出 ”,利用了溴的性质是
”,利用了溴的性质是_______ 。步骤ⅱ 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
③步骤ⅲ氧化 的粒子为
的粒子为_______ ;
④步骤ⅳ分离提纯的方法是_______ ;其依据是_______ 。
(2)海带中碘含量丰富。从海带中提取碘的实验如下装置中,不能达到目的的有A_______ (填选项字母),解释A不能达到目的的原因:_______ 。
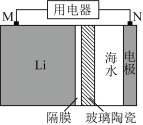
(3)海水电池在海洋能源领域备受关注。
①图1为一种锂-海水电池构造示意图。N极反应式为_______ 。
②欲用图2电解装置制得漂白液(NaClO为有效成分)可将其a极与锂-海水电池图1的_______ (填“M”或“N”)极连接;理论上该电解总反应的生成物中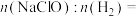
_______ 。
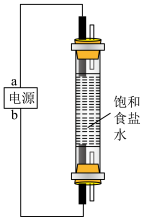
(1)海水中溴含量约为65
 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:
①步骤ⅰ反应的化学方程式为
②步骤ⅱ目的是
 ”,利用了溴的性质是
”,利用了溴的性质是 参与反应的离子方程式为
参与反应的离子方程式为③步骤ⅲ氧化
 的粒子为
的粒子为④步骤ⅳ分离提纯的方法是
(2)海带中碘含量丰富。从海带中提取碘的实验如下装置中,不能达到目的的有A
| A | B | C |
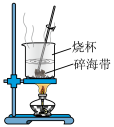 | 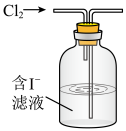 | 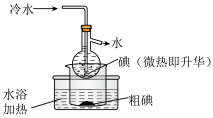 |
| 灼烧碎海带 | 获得碘水 | 提纯碘 |
(3)海水电池在海洋能源领域备受关注。
①图1为一种锂-海水电池构造示意图。N极反应式为

②欲用图2电解装置制得漂白液(NaClO为有效成分)可将其a极与锂-海水电池图1的
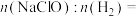

您最近一年使用:0次
9 . 开发和利用海洋资源是当前科学研究的一项重要任务,如图是某化工厂对海洋资源综合利用的流程图:
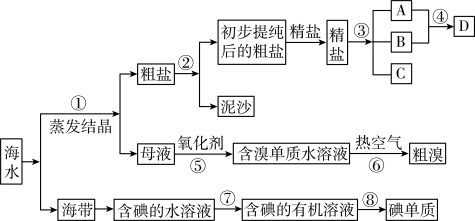
请根据以上信息回答下列问题:
(1)写出流程中⑦所用的方法:_______ 。
(2)初步提纯后的粗盐中含有Ca2+、Mg2+、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:

加入的试剂①、②分别是:_______ 、_______ 。
(3)步骤③的条件是通直流电,其离子方程式为_______ 。D具有杀菌消毒的作用,在喷洒前需要在空气中晾置一会,这样做的原因是_______ 。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克Cl2的氧化能力(氯元素均被还原至-1价)。则亚氯酸钠NaClO2的有效氯含量为_______ (保留两位小数)。
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是_______ 。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有_______ 性。对粗溴一般做如下处理:
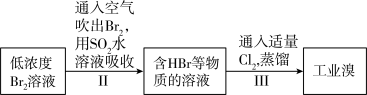
其中步骤Ⅱ、Ⅲ起到的作用是_______ 。
向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应。
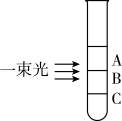
(7)写出制备氯化银胶体的方程式:_______ 。
(8)具有明显的丁达尔效应的是区域_______ (填字母),该区域中分散质的粒径大小为_______ 。
(9)分离出C区域的分散质的方法是_______ 。

请根据以上信息回答下列问题:
(1)写出流程中⑦所用的方法:
(2)初步提纯后的粗盐中含有Ca2+、Mg2+、
 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
加入的试剂①、②分别是:
(3)步骤③的条件是通直流电,其离子方程式为
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克Cl2的氧化能力(氯元素均被还原至-1价)。则亚氯酸钠NaClO2的有效氯含量为
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有

其中步骤Ⅱ、Ⅲ起到的作用是
向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应。

(7)写出制备氯化银胶体的方程式:
(8)具有明显的丁达尔效应的是区域
(9)分离出C区域的分散质的方法是
您最近一年使用:0次
名校
10 . 碘是动植物和人体必需的微量元素,I-的氧化和单质I2的分离是海带中碘元素分离的关键步骤。某学习小组在实验室对海带中碘元素进行分离和含量测定,并进行实验改进。
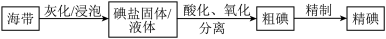
(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为______ 、_____ 。
(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为_____ 。而且该反应过程放出大量热,会对I2的提取造成的影响是_____ 。
(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为_____ 。
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为_____ 。

(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO
 ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I
 (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为
您最近一年使用:0次



