解题方法
1 . 食品添加剂的常见类别有:着色剂、增味剂、膨松剂、凝固剂、防腐剂、营养强化剂等。
(1)碘酸钾为___________ (填食品添加剂的类别)。
(2)从海带中提取碘的主要实验过程如下图所示:

①干海带的“灼烧”需在___________ (填仪器名称)中进行。
②操作1为___________ (填操作名称)。
③在“氧化”步骤中,最符合绿色化学思想的氧化剂是下列物质中的___________ (填选项字母),酸性条件下该反应的离子方程式为___________ 。
A. 溶液 B.浓硝酸 C.
溶液 B.浓硝酸 C.
④检验操作2后水层中是否含有碘单质的方法为___________ 。
(3)在加热条件下,将 通入到
通入到 和
和 的混合溶液中制备
的混合溶液中制备 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;若要制备500g的加碘食盐(碘含量为2.54%),至少需要
___________ g。
(1)碘酸钾为
(2)从海带中提取碘的主要实验过程如下图所示:

①干海带的“灼烧”需在
②操作1为
③在“氧化”步骤中,最符合绿色化学思想的氧化剂是下列物质中的
A.
 溶液 B.浓硝酸 C.
溶液 B.浓硝酸 C.
④检验操作2后水层中是否含有碘单质的方法为
(3)在加热条件下,将
 通入到
通入到 和
和 的混合溶液中制备
的混合溶液中制备 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
2 . 资源丰富的海水是工业生产中的重要原料。请按要求回答下列问题。
(1)海水中溴含量约为65 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:

①步骤ⅰ反应的化学方程式为_______ 。
②步骤ⅱ目的是_______ ;其中“通入热空气吹出 ”,利用了溴的性质是
”,利用了溴的性质是_______ 。步骤ⅱ 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
③步骤ⅲ氧化 的粒子为
的粒子为_______ ;
④步骤ⅳ分离提纯的方法是_______ ;其依据是_______ 。
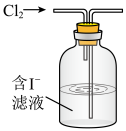
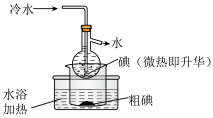
(2)海带中碘含量丰富。从海带中提取碘的实验如下装置中,不能达到目的的有A_______ (填选项字母),解释A不能达到目的的原因:_______ 。
(3)海水电池在海洋能源领域备受关注。
①图1为一种锂-海水电池构造示意图。N极反应式为_______ 。
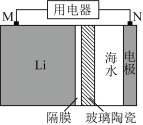
②欲用图2电解装置制得漂白液(NaClO为有效成分)可将其a极与锂-海水电池图1的_______ (填“M”或“N”)极连接;理论上该电解总反应的生成物中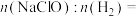
_______ 。
(1)海水中溴含量约为65
 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:
①步骤ⅰ反应的化学方程式为
②步骤ⅱ目的是
 ”,利用了溴的性质是
”,利用了溴的性质是 参与反应的离子方程式为
参与反应的离子方程式为③步骤ⅲ氧化
 的粒子为
的粒子为④步骤ⅳ分离提纯的方法是
(2)海带中碘含量丰富。从海带中提取碘的实验如下装置中,不能达到目的的有A
| A | B | C |
 |  |  |
| 灼烧碎海带 | 获得碘水 | 提纯碘 |
(3)海水电池在海洋能源领域备受关注。
①图1为一种锂-海水电池构造示意图。N极反应式为

②欲用图2电解装置制得漂白液(NaClO为有效成分)可将其a极与锂-海水电池图1的

您最近一年使用:0次
名校
3 . 碘是动植物和人体必需的微量元素,I-的氧化和单质I2的分离是海带中碘元素分离的关键步骤。某学习小组在实验室对海带中碘元素进行分离和含量测定,并进行实验改进。
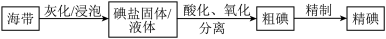
(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为______ 、_____ 。
(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为_____ 。而且该反应过程放出大量热,会对I2的提取造成的影响是_____ 。
(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为_____ 。
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为_____ 。

(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO
 ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I
 (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为
您最近一年使用:0次
名校
4 . 从海产品中提取碘是我国工业上获取碘的重要途径,实验室证明海带中存在碘元素的方法如下:
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的_______ (填标号)。
a. b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。
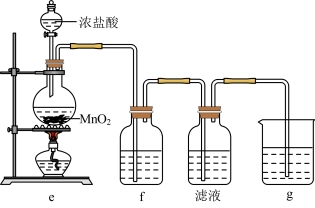
①装置e中发生反应的化学方程式是_______ 。
②装置f、g中所装的试剂分别是_______ 、_______ 。
③检验“滤液”中有碘单质生成的方法是_______ 。若通入 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是_______ 。
(3)“步骤Ⅲ”氧化剂氧化时,用 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是_______ 。
(4)若“步骤Ⅲ”所得溶液经过分离提纯获得 ,其物质的量是
,其物质的量是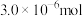 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是_______ mg/kg。
Ⅰ.取3g左右的干海带,把干海带表面的附着物用刷子刷净,用剪刀剪碎后,用酒精润湿,灼烧至完全变成灰烬。
Ⅱ.将海带灰转移到小烧杯中,向其中加10mL蒸馏水,搅拌、煮沸2~3min,过滤。
Ⅲ.向滤液中加氧化剂氧化,最后检验碘单质的存在。
回答下列问题:
(1)“步骤1”中,灼烧时会用到下列仪器中的
a.
 b.
b. c.
c. d.
d.
(2)某兴趣小组在实验室完成“步骤Ⅲ”中氧化剂氧化过程,装置如图所示。

①装置e中发生反应的化学方程式是
②装置f、g中所装的试剂分别是
③检验“滤液”中有碘单质生成的方法是
 过量,检验发现“滤液”中无碘单质,其原因是
过量,检验发现“滤液”中无碘单质,其原因是(3)“步骤Ⅲ”氧化剂氧化时,用
 在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是
在pH<2的酸性介质中反应效果最佳。已知还原产物是NO,则反应的离子方程式是(4)若“步骤Ⅲ”所得溶液经过分离提纯获得
 ,其物质的量是
,其物质的量是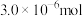 。则干海带中碘元素的含量是
。则干海带中碘元素的含量是
您最近一年使用:0次
2022-07-20更新
|
555次组卷
|
3卷引用:辽宁省县级重点高中协作体2021-2022学年高一下学期期末考试化学试题
名校
解题方法
5 . 我国拥有很长的海岸线,海洋资源的开发利用具有广阔前景。全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。空气吹出法工艺是目前“海水提溴”的最主要方法之一、其工艺流程如图:
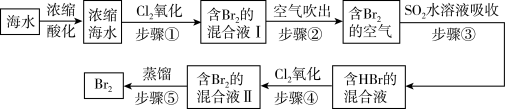
(1)步骤①中获得Br2的离子方程式为____ 。
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是____ 。
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2共有___ 个电子转移(用a和NA的代数式表示)。
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤:____ 、____ 。
(5)“试剂a”通常应具有一定的____ 性。
利用H2O2完成“溶液A”向“溶液B”的转变。配平该反应的化学方程式:____ 。
______KI+______H2O=______KOH+______I2
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是___ 。(选填编号)
(7)“操作II”宜选用的装置是____ 。(选填编号)
(8)在操作II后,检验提取碘后的水层是否仍含有碘单质的方法是:____ 。
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液30.0mL,恰好反应完全。
则所测盐中碘的含量是____ mg•g-1(保留四位小数)。

(1)步骤①中获得Br2的离子方程式为
(2)根据上述反应可判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
(3)步骤③中若吸收剂为饱和Na2SO3溶液(足量),则完全吸收amolBr2共有
碘是人体必需的一种微量元素。海洋植物中富含碘元素。实验室模拟从海带中提取碘单质的流程图如图:

(4)设计“操作Ⅰ”的主要步骤:
(5)“试剂a”通常应具有一定的
利用H2O2完成“溶液A”向“溶液B”的转变。配平该反应的化学方程式:
______KI+______H2O=______KOH+______I2
(6)由于“溶液B”中I2的含量较低,“操作II”能将I2“富集、浓缩”到“有机溶液X”中。
已知:I2在以下试剂中的溶解度都大于水,则“试剂b”可以是
| 试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
| 相关性质 | 与水互溶不与反应 | 与水不互溶不与I2反应 | 与水不互溶不与I2反应 | 与水不互溶与I2反应 |
(7)“操作II”宜选用的装置是
A. | B.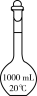 | C.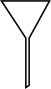 | D. |
(9)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O ,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:
,学生测定某碘盐(含KIO3)中碘元素的含量,其步骤为:a.准确称取120g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液30.0mL,恰好反应完全。
则所测盐中碘的含量是
您最近一年使用:0次
6 . 碘元素被称为“智力元素”,海洋植物如海带、海藻中存在丰富的碘元素,一般以碘离子形式存在。某小组设计实验从20.00g海藻中提取碘单质,实验流程如下:
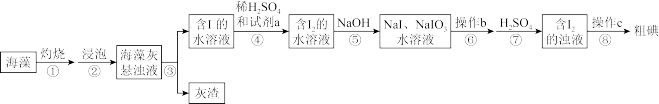
试回答下列问题:
(1)灼烧海藻时,将海藻用___________ (填化学式)润湿后,置于___________ (填装置名称)中烧成灰烬。
(2)从下列试剂中选择可做试剂a的是___________ (填序号)。
A.H2O2 B.MnO2 C.FeCl2 D.SO2
有人提出试剂a可以是Cl2,但是使用时必须控制用量,否则生成的I2,又被Cl2氧化为+5价,该反应的化学方程式为___________
(3)操作b是___________ ,滴加稀硫酸时发生的离子反应方程式为___________ 操作c为过滤,滤液可返回至___________ (填步骤序号)操作后溶液中循环利用。
(4)碘量法常用于测量草药中可能残余的有毒元素As的含量:
①取1000g草药样品进行前期处理制得待测溶液1000mL,此时样品中含有的砷元素转化为H3AsO3;
②转移100mL待测液至250mL锥形瓶中,加入1.000×10-3mol·L-1标准I2溶液20.00mL(H3AsO3转化为H3AsO4),并加入少量的淀粉溶液;
③用1.000×103mol·L-1的硫代硫酸钠标准溶液滴定过量的碘(已知:2 +I2=2I-+
+I2=2I-+ )。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
)。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为___________ mg/kg;若滴定时溶液酸性过强,会导致测量结果___________ (填“偏高”或“偏低”)。

试回答下列问题:
(1)灼烧海藻时,将海藻用
(2)从下列试剂中选择可做试剂a的是
A.H2O2 B.MnO2 C.FeCl2 D.SO2
有人提出试剂a可以是Cl2,但是使用时必须控制用量,否则生成的I2,又被Cl2氧化为+5价,该反应的化学方程式为
(3)操作b是
(4)碘量法常用于测量草药中可能残余的有毒元素As的含量:
①取1000g草药样品进行前期处理制得待测溶液1000mL,此时样品中含有的砷元素转化为H3AsO3;
②转移100mL待测液至250mL锥形瓶中,加入1.000×10-3mol·L-1标准I2溶液20.00mL(H3AsO3转化为H3AsO4),并加入少量的淀粉溶液;
③用1.000×103mol·L-1的硫代硫酸钠标准溶液滴定过量的碘(已知:2
 +I2=2I-+
+I2=2I-+ )。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
)。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
您最近一年使用:0次
7 . 海洋中蕴含丰富的资源。
I.利用海水提取淡水、溴、镁和碘的部分过程如图所示:
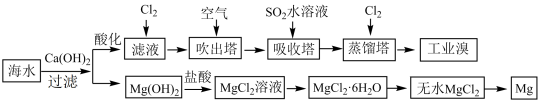
(1)海水中部分离子的含量如下:
其中,Mg2+的物质的量浓度是_______ mol/L。海水淡化的方法有_______ 、离子交换法和电渗析法等。
(2)滤液中通入Cl2后发生反应的离子方程式为_______
(3)提取溴元素时,热空气吹出并用SO2水溶液吸收的目的是_______ ,然后再通入Cl2。
(4)若要提取1mol溴,理论上至少需要标准状况下Cl2的体积为_______ L(忽略Cl2的溶解)。
(5)由无水MgCl2制取Mg的化学方程式为_______ 。
II.海带中含有丰富的碘元素。从海带中提取碘单质的工业生产流程如图所示:
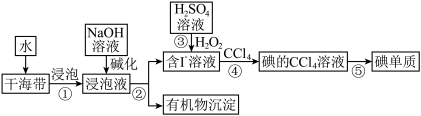
(6)步骤②的操作是_______
(7)步骤③反应的离子方程式有H++OH-=H2O和_______ 。
(8)步骤④还可以选用的试剂是_______ (填字母序号)。
A.苯 B.乙醇 C.己烷 D.乙酸
I.利用海水提取淡水、溴、镁和碘的部分过程如图所示:

(1)海水中部分离子的含量如下:
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Na+ | 10560 | Cl- | 18980 |
| Mg2+ | 1272 | Br- | 64 |
| Ca2+ | 400 |  | 2560 |
(2)滤液中通入Cl2后发生反应的离子方程式为
(3)提取溴元素时,热空气吹出并用SO2水溶液吸收的目的是
(4)若要提取1mol溴,理论上至少需要标准状况下Cl2的体积为
(5)由无水MgCl2制取Mg的化学方程式为
II.海带中含有丰富的碘元素。从海带中提取碘单质的工业生产流程如图所示:

(6)步骤②的操作是
(7)步骤③反应的离子方程式有H++OH-=H2O和
(8)步骤④还可以选用的试剂是
A.苯 B.乙醇 C.己烷 D.乙酸
您最近一年使用:0次
8 . 碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海带、海水和盐矿中。从海带中提取碘的实验过程如图所示。
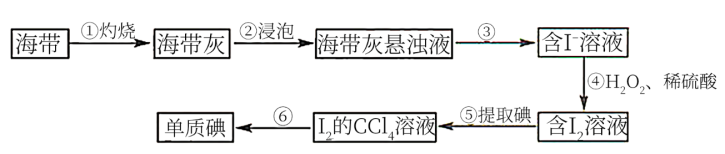
已知:① 的升华温度:45℃~77℃;②
的升华温度:45℃~77℃;② 沸点:76.8℃。回答下列问题:
沸点:76.8℃。回答下列问题:
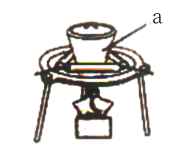
(1)步骤①灼烧海带,实验室通常在如图所示装置中进行,仪器a的名称为___________ 。
(2)步骤③涉及的操作名称为___________ ,实验室进行该操作时用到的玻璃仪器有___________ 。
(3)步骤④中涉及的主要反应的离子方程式为___________ 。
(4)海带灰中还含有其他可溶性无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第___________ 步(填编号)与碘分离,若要使碘尽可能地完全转移,应采取的操作是___________ 。
(5)步骤⑥将 与
与 分离可以采用
分离可以采用___________ (填“常压”或“减压”)蒸馏方法,原因是___________ 。
(6)若实验室称得海带的质量为m g,提取单质碘的过程中,碘损失了n%,最后得到单质碘b g,则海带中碘的百分含量为___________ (用含m、n、b的式子表示)

已知:①
 的升华温度:45℃~77℃;②
的升华温度:45℃~77℃;② 沸点:76.8℃。回答下列问题:
沸点:76.8℃。回答下列问题:(1)步骤①灼烧海带,实验室通常在如图所示装置中进行,仪器a的名称为

(2)步骤③涉及的操作名称为
(3)步骤④中涉及的主要反应的离子方程式为
(4)海带灰中还含有其他可溶性无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第
(5)步骤⑥将
 与
与 分离可以采用
分离可以采用(6)若实验室称得海带的质量为m g,提取单质碘的过程中,碘损失了n%,最后得到单质碘b g,则海带中碘的百分含量为
您最近一年使用:0次
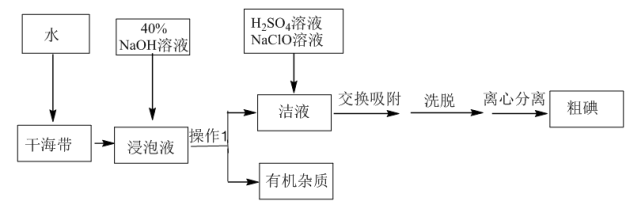
9 . 用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
已知: 交换吸附原理:
交换吸附原理: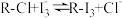 。试回答下列问题:
。试回答下列问题:
(1)操作Ⅰ的正确图示为_______。
(2)在清液中加入 和
和 溶液后,溶液最终变为棕红色,该步骤中
溶液后,溶液最终变为棕红色,该步骤中 的量要适中,请说明原因
的量要适中,请说明原因_______ 。
(3)其中交换吸附装置如图1所示,交换柱内装有氯型阴离子交换树脂( 表示),待溶液转化原理为:
表示),待溶液转化原理为: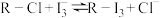 ,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
第一步:取8~10%的 溶液
溶液 注入交换柱中。碱性洗脱原理为:
注入交换柱中。碱性洗脱原理为:
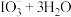 。往碱性洗脱液中滴加
。往碱性洗脱液中滴加 溶液,烧杯底部会析出一层泥状粗碘。
溶液,烧杯底部会析出一层泥状粗碘。
第二步:取10%的 溶液
溶液 注入上述交换柱中。氯化钠洗脱原理为:
注入上述交换柱中。氯化钠洗脱原理为: 。再往氯化钠洗脱液中滴加
。再往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液,溶液由无色转变棕黑色浑浊。
溶液,溶液由无色转变棕黑色浑浊。
①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对 进行交换吸附,那实验中将
进行交换吸附,那实验中将 转化成
转化成 的原因可能是
的原因可能是_______ 。
②往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液反应的离子方程式
溶液反应的离子方程式_______ 。
(4)置换碘量法是分析氧化性试剂的一种常用分析方法,基本过程如下:
a.取3只碘量瓶,用移液管分别量取一定体积的供试品(氧化性物质)溶液于碘量瓶(图2)中
b.加入稍过量的碘化钾溶液,盖上盖子,并加纯水液封,静置或微热一段时间
c.打开瓶塞,按图3方式用标准 溶液进行滴定,重复3次
溶液进行滴定,重复3次
d.另取3只碘量瓶,用移液管分别量取一定体积准确浓度的基准液 溶液于其中
溶液于其中
e.计算标准液的浓度
f.空白实验
过程中涉及的反应过程如下:
供试品(氧化性物质)
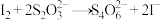

①上述操作合理的顺序是:_______ 。
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ (部分步骤可以重复)
(部分步骤可以重复)
②碘量瓶加盖并加纯水液封的主要目的是_______ 。
③已知 易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会_______ 。(填“偏大”、“偏小”或“不变”)

已知:
 交换吸附原理:
交换吸附原理: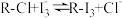 。试回答下列问题:
。试回答下列问题:(1)操作Ⅰ的正确图示为_______。
A. | B.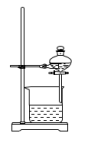 | C.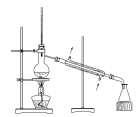 | D. |
 和
和 溶液后,溶液最终变为棕红色,该步骤中
溶液后,溶液最终变为棕红色,该步骤中 的量要适中,请说明原因
的量要适中,请说明原因(3)其中交换吸附装置如图1所示,交换柱内装有氯型阴离子交换树脂(
 表示),待溶液转化原理为:
表示),待溶液转化原理为: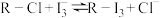 ,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行第一步:取8~10%的
 溶液
溶液 注入交换柱中。碱性洗脱原理为:
注入交换柱中。碱性洗脱原理为:
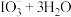 。往碱性洗脱液中滴加
。往碱性洗脱液中滴加 溶液,烧杯底部会析出一层泥状粗碘。
溶液,烧杯底部会析出一层泥状粗碘。第二步:取10%的
 溶液
溶液 注入上述交换柱中。氯化钠洗脱原理为:
注入上述交换柱中。氯化钠洗脱原理为: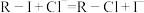 。再往氯化钠洗脱液中滴加
。再往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液,溶液由无色转变棕黑色浑浊。
溶液,溶液由无色转变棕黑色浑浊。
①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对
 进行交换吸附,那实验中将
进行交换吸附,那实验中将 转化成
转化成 的原因可能是
的原因可能是②往氯化钠洗脱液中滴加
 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液反应的离子方程式
溶液反应的离子方程式(4)置换碘量法是分析氧化性试剂的一种常用分析方法,基本过程如下:
a.取3只碘量瓶,用移液管分别量取一定体积的供试品(氧化性物质)溶液于碘量瓶(图2)中
b.加入稍过量的碘化钾溶液,盖上盖子,并加纯水液封,静置或微热一段时间
c.打开瓶塞,按图3方式用标准
 溶液进行滴定,重复3次
溶液进行滴定,重复3次d.另取3只碘量瓶,用移液管分别量取一定体积准确浓度的基准液
 溶液于其中
溶液于其中e.计算标准液的浓度
f.空白实验

过程中涉及的反应过程如下:
供试品(氧化性物质)


①上述操作合理的顺序是:
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ (部分步骤可以重复)
(部分步骤可以重复)②碘量瓶加盖并加纯水液封的主要目的是
③已知
 易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
您最近一年使用:0次
10 . 下列有关资源开发和利用的说法,不正确的是
| A.向浸泡过海带灰的水中加淀粉,有蓝色出现 |
B.把生铁炼成钢,需要降低生铁中硅的含量,可以在炼钢时添加 |
C.为将氨基酸混合物分离开,可以通过调节混合溶液的 值,从而析出晶体进行分离 值,从而析出晶体进行分离 |
| D.洗涤葡萄糖还原银氨溶液在试管壁产生的银,先用稀硝酸溶洗,再用水清洗 |
您最近一年使用:0次



