名校
解题方法
1 . 某学习小组根据侯氏制碱原理(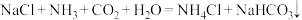 )制备少量
)制备少量 的流程如下:
的流程如下:

回答下列问题:
(1)流程中涉及的食盐水、二氧化碳和碳酸钠,其中属于电解质的有___________ 种。该流程中由 制
制 的化学方程式为
的化学方程式为___________ 。
(2)取过滤、洗涤、干燥后得到的 和煅烧得到的
和煅烧得到的 各0.9g分别放入如图所示的装置中。
各0.9g分别放入如图所示的装置中。

①某同学忘记贴上标签,如果采用下列实验,可以判断出装置中物质的实验有___________ (填字母)。
a.用针筒分别打入滴有酚酞的 水,用力振荡
水,用力振荡
b.用针筒分别打入少量的氢氧化钡溶液
③用针筒先分别滴入 的水,溶解后再分别滴入少量的稀盐酸,装置
的水,溶解后再分别滴入少量的稀盐酸,装置 和
和 中发生反应的离子方程式分别是
中发生反应的离子方程式分别是___________ ;在相同的温度和压强下,若分别加入过量的稀盐酸,则两装置中气球体积较大的是___________ (填序号)。
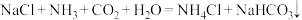 )制备少量
)制备少量 的流程如下:
的流程如下:
回答下列问题:
(1)流程中涉及的食盐水、二氧化碳和碳酸钠,其中属于电解质的有
 制
制 的化学方程式为
的化学方程式为(2)取过滤、洗涤、干燥后得到的
 和煅烧得到的
和煅烧得到的 各0.9g分别放入如图所示的装置中。
各0.9g分别放入如图所示的装置中。
①某同学忘记贴上标签,如果采用下列实验,可以判断出装置中物质的实验有
a.用针筒分别打入滴有酚酞的
 水,用力振荡
水,用力振荡b.用针筒分别打入少量的氢氧化钡溶液
③用针筒先分别滴入
 的水,溶解后再分别滴入少量的稀盐酸,装置
的水,溶解后再分别滴入少量的稀盐酸,装置 和
和 中发生反应的离子方程式分别是
中发生反应的离子方程式分别是
您最近一年使用:0次
名校
2 . 现有下列物质:① ②
② 溶液 ③
溶液 ③ 固体 ④
固体 ④ ⑤饱和
⑤饱和 溶液 ⑥
溶液 ⑥ ⑦熔融
⑦熔融 ,回答下列问题:
,回答下列问题:
(1)上述物质中,属于电解质的是_______ 。
(2)熔融 的电离方程式为
的电离方程式为_______ 。
(3)①与②反应的化学方程式为_______ 。
(4)碳酸钠可用于海水提溴,涉及的反应为: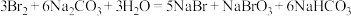 。
。
ⅰ)该反应的离子方程式为_______ 。
ⅱ)当 参与反应时,转移电子的物质的量为
参与反应时,转移电子的物质的量为_______ 。
(5)④⑤⑥是侯氏制碱的原料,三者反应的化学方程式为_______ 。
 ②
② 溶液 ③
溶液 ③ 固体 ④
固体 ④ ⑤饱和
⑤饱和 溶液 ⑥
溶液 ⑥ ⑦熔融
⑦熔融 ,回答下列问题:
,回答下列问题:(1)上述物质中,属于电解质的是
(2)熔融
 的电离方程式为
的电离方程式为(3)①与②反应的化学方程式为
(4)碳酸钠可用于海水提溴,涉及的反应为:
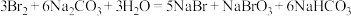 。
。ⅰ)该反应的离子方程式为
ⅱ)当
 参与反应时,转移电子的物质的量为
参与反应时,转移电子的物质的量为(5)④⑤⑥是侯氏制碱的原料,三者反应的化学方程式为
您最近一年使用:0次
2024-01-19更新
|
57次组卷
|
2卷引用:海南省琼海市嘉积中学2023-2024学年高一上学期第三次月考化学科试题
名校
解题方法
3 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示

沉淀池反应;
(1)“侯氏制碱法”誉满全球,其中的“碱”为_______ ,俗称_______ ,其用途_______ (写一种)。
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是_______。
(3)燃烧炉中发生反应的化学方程式为_______ 。
(4)使用原料氯化钠的利用率从70%提高到90%以上,主要是设计了_______ (填Ⅰ或Ⅱ)的循环。上述流程中X的分子式_______ 。
(5)该流程提取的副产品为_______ 。
(6)为验证产品是否含有NaCl,可取少量试样溶于水后,滴加_______ ,若出现_______ 现象,则证明含有NaCl。

沉淀池反应;

(1)“侯氏制碱法”誉满全球,其中的“碱”为
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是_______。
A. | B. | C. | D. |
(4)使用原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(5)该流程提取的副产品为
(6)为验证产品是否含有NaCl,可取少量试样溶于水后,滴加
您最近一年使用:0次
名校
解题方法
4 . 我国化工专家侯德榜的杰出贡献是
| A.提取青蒿素 | B.分离机应用稀土元素 |
| C.发明联合制碱法 | D.人工合成结晶牛胰岛素 |
您最近一年使用:0次
2022-05-27更新
|
207次组卷
|
3卷引用:2021年海南省普通高中学业水平合格性考试化学试题
5 . 综合利用海水可以制备工业溴、纯碱等物质,其流程示意图如下:

(1)气体X的化学式是:___________ 。
(2)无需经过化学变化就能从海水中获得的物质是___________(填写字母)。
(3)提取溴的过程经过2次用 使“
使“ ”,所发生的离子反应方程式为
”,所发生的离子反应方程式为___________ 。
(4)用碳酸氢钠固体得到纯碱的有关反应化学方程式为___________ 。
(5)工业上制取金属镁的化学方程式为___________ 。

(1)气体X的化学式是:
(2)无需经过化学变化就能从海水中获得的物质是___________(填写字母)。
A. | B.淡水 | C.烧碱 | D.食盐 |
 使“
使“ ”,所发生的离子反应方程式为
”,所发生的离子反应方程式为(4)用碳酸氢钠固体得到纯碱的有关反应化学方程式为
(5)工业上制取金属镁的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 工业上以食盐、氨气、二氧化碳等物质为原料制取纯碱。
(1)实验室提纯粗盐的一个重要环节是除去粗盐水中的杂质阳离子(主要含Ca2+、Mg2+),提纯该粗盐时,可考虑在粗盐水中依次加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A____ 、B_____ 。
(2)氨气分子的空间构型为_____ ,其中N原子采用_____ 杂化方式,二氧化碳中心原子C采用_____ 杂化方式。
(3)上述实验涉及的元素中,Ca基态原子电子排布式为__________________ 。
(4)上述实验涉及的元素中,O2-、Na+、Cl-中半径最小的是__________ 。
(5)制取纯碱时,向饱和食盐水中通入气体,即可得到小苏打的沉淀物,氨气与二氧化碳通入的先后顺序是:_________ ,因为:___________
(6)写成工业上以食盐、氨气、二氧化碳等物质为原料制取小苏打反应的化学方程式:______
(1)实验室提纯粗盐的一个重要环节是除去粗盐水中的杂质阳离子(主要含Ca2+、Mg2+),提纯该粗盐时,可考虑在粗盐水中依次加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A
(2)氨气分子的空间构型为
(3)上述实验涉及的元素中,Ca基态原子电子排布式为
(4)上述实验涉及的元素中,O2-、Na+、Cl-中半径最小的是
(5)制取纯碱时,向饱和食盐水中通入气体,即可得到小苏打的沉淀物,氨气与二氧化碳通入的先后顺序是:
(6)写成工业上以食盐、氨气、二氧化碳等物质为原料制取小苏打反应的化学方程式:
您最近一年使用:0次
7 . 提出联合制碱法(侯氏制碱法)的中国化工专家是( )
| A.路布兰 | B.索尔维 | C.侯德榜 | D.徐光宪 |
您最近一年使用:0次
2020-06-21更新
|
214次组卷
|
7卷引用:海南省海口市灵山中学2019-2020学年高一下学期期中考试化学试题
(已下线)海南省海口市灵山中学2019-2020学年高一下学期期中考试化学试题海南省海口市灵山中学2019-2020学年高一下期中考试化学试题海南省东方市八所中学2020-2021学年高一上学期第三次月考化学试题海南省儋州市第二中学2020-2021学年高一下学期3月月考化学(合格考)试题黑龙江省大庆实验中学2020-2021学年高一上学期第一次线上教学质量检测(1月)化学试题黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题(已下线)易错专题14 侯氏制碱法生产纯碱-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
8 . 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_______ ;
(2)写出“联合制碱法”有关反应的化学方程式:_______ ;_______ ;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______ ;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_______ 。
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
(2)写出“联合制碱法”有关反应的化学方程式:
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=
您最近一年使用:0次
2019-01-30更新
|
545次组卷
|
3卷引用:2007年普通高等学校招生全国统一考试(海南卷)化学试题
9 . 综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤______ ;⑥加适量的盐酸;⑦蒸发结晶。
(2)碳酸氢钠固体受热分解的化学方程式是:_____ 。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用______ 溶液进行洗涤以除之。
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式:______ 。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:______ 。

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤
(2)碳酸氢钠固体受热分解的化学方程式是:
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式:
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:
您最近一年使用:0次
真题
10 . 工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为__________________ ;
②硫酸钠和焦炭、石灰石反应的化学方程式为___________________ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
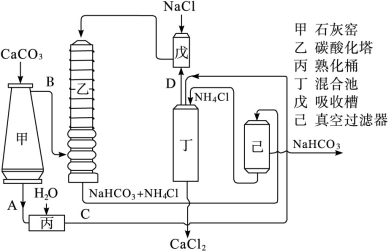
①图中的中间产物C是_______ ,D_______ 。(写化学式);
②装置乙中发生反应的化学方程式为_________________ ;
(3)联合制碱法对氨碱法的改进,其优点是____________________ ;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行____________________ ?

(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为
②硫酸钠和焦炭、石灰石反应的化学方程式为
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。

①图中的中间产物C是
②装置乙中发生反应的化学方程式为
(3)联合制碱法对氨碱法的改进,其优点是
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行

您最近一年使用:0次
2016-12-09更新
|
446次组卷
|
2卷引用:2011年普通高等学校招生全国统一考试化学(海南卷)



