2017届贵州省凯里市第一中学高三3月联考理综化学试卷
贵州
高三
阶段练习
2017-04-08
249次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础、物质结构与性质
2017届贵州省凯里市第一中学高三3月联考理综化学试卷
贵州
高三
阶段练习
2017-04-08
249次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 化学与生产、生活、社会密切相关,下列有关说法正确的是
| A.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
| B.为了防止月饼等富酯食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰 |
| C.鱼、虾等海鲜用福尔马林防腐保鲜 |
| D.干电池即使不用,放置过久,也可能漏液失效,其原因是电解质溶液NH4Cl显酸性和外壳锌反应 |
您最近一年使用:0次
单选题
|
适中(0.65)
2. 设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.常温下,1.7g NH3和3.65gHCl混合后,气体分子数为0.2NA |
| B.常温下,34g NH3含有6NA个N-H共价键 |
| C.n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA |
| D.1mol Fe溶于过量硝酸,电子转移数为2NA |
【知识点】 阿伏加德罗常数的应用解读
您最近一年使用:0次
单选题
|
适中(0.65)
3. 下列对实验的描述正确的是
| A.将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 |
| B.硝酸银溶液中加足量的NaCl溶液,再加KI溶液,先得到白色沉淀后变为黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) |
| C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| D.检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 |
您最近一年使用:0次
单选题
|
适中(0.65)
4. 下列说法不正确的是
| A.乙烯的产量是衡量一个国家石油化工发展水平的标志 |
| B.1mol CH3COOH与1mol CH3CH2OH在浓硫酸共热下生成乙酸乙酯分子数为NA |
| C.分子式为C5H12O的醇类有8种结构 |
| D.苯在空气中燃烧时冒浓烟,说明苯组成中含碳量较高 |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
5. X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不是稀有气体元素;X、Y、Z三种元素的族序数之和为16。下列说法正确的是
| A.Q与W不能形成既含极性键又含非极性键的分子 |
| B.Y的最高价氧化物不能与任何酸反应 |
| C.Y、Z、Q分别与X化合,部分元素可能形成AB3型化合物 |
| D.X、Z、W中的两种或三种元素形成的钠盐溶液只能显酸性 |
您最近一年使用:0次
2017-03-30更新
|
575次组卷
|
4卷引用:2017届贵州省凯里市第一中学高三3月联考理综化学试卷
2017届贵州省凯里市第一中学高三3月联考理综化学试卷(已下线)二轮复习 专题7 物质结构与元素周期律 押题专练【全国百强校】山东省济南市历城第二中学2019届高三上学期11月调研检测化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(押题专练)
单选题
|
适中(0.64)
6. 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
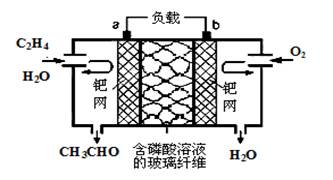

| A.该装置能量转化形式是电能转化为化学能 |
| B.负极反应式为:CH2=CH2-2e-+H2O=CH3CHO +2H+ |
| C.每有0.1 molO2反应,则向负极迁移的H+的物质的量为0.4 mol |
| D.电子移动方向:电极a→磷酸溶液→电极b |
【知识点】 化学电源
您最近一年使用:0次
2017-02-20更新
|
350次组卷
|
2卷引用:2017届吉林省吉林大学附中高三上摸底考试四化学卷
单选题
|
较难(0.4)
名校
7. 氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
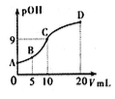
| A.甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH- |
| B.A、B、C三点溶液中,水电离出来的c(H+):B>C>A |
C.C点所在溶液中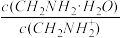 =2.5×10-5 =2.5×10-5 |
| D.B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-) |
您最近一年使用:0次
2017-03-30更新
|
371次组卷
|
4卷引用:2017届湖南省衡阳市高三下学期第一次联考理综化学试卷
二、解答题 添加题型下试题
解答题-原理综合题
|
较难(0.4)
解题方法
8. 工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)  CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某温度下,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6mol。
CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某温度下,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6mol。
(1)第一分钟内H2的平均反应速率是________ 列式并计算该温度下的化学平衡常数K=______
(2)下列时间段平均反应速率最大的是_______
A.0-1min B.1-3min C.3-8min D.8-11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是__________ ,曲线Ⅱ对应的实验条件改变的是_____________ 。
(4)若在d点时向体系内充入2molCO2和2molH2O,此时V正_____ V逆(大于,小于,等于)
(5)已知:
①CO(g)+1/2O2(g)=CO2(g); ΔH1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g); ΔH2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g); ΔH3=-192.2kJ/mol
在工业上常用CO和H2合成甲醇,该反应的热方程式为_____________
(6)如图是甲醇燃料电池原理示意图,回答下列问题:电池负极的电极反应是:__________ 。
 CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某温度下,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6mol。
CH3OH(g)+H2O(g); ΔH=-49.0kJ/mol。某温度下,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6mol。
(1)第一分钟内H2的平均反应速率是
(2)下列时间段平均反应速率最大的是
A.0-1min B.1-3min C.3-8min D.8-11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是
(4)若在d点时向体系内充入2molCO2和2molH2O,此时V正
(5)已知:
①CO(g)+1/2O2(g)=CO2(g); ΔH1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g); ΔH2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g); ΔH3=-192.2kJ/mol
在工业上常用CO和H2合成甲醇,该反应的热方程式为
(6)如图是甲醇燃料电池原理示意图,回答下列问题:电池负极的电极反应是:

您最近一年使用:0次
解答题-工业流程题
|
较难(0.4)
解题方法
9. 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体在中性和碱性溶液中不能稳定存在。
回答下列问题:
(1)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的_________ (填化学式),至沉淀不再产生后。再加入过里的Na2CO3和NaOH,充分反应后将沉淀一并滤去。在无隔膜电解槽中用惰性电极电解一段时间生成NaClO3,阳极反应式为_______
(2)X酸是_________ 。写出二氧化氯发生器中生成ClO2的化学方程式_______ ,吸收塔内的温度不宜过高的原因为________
(3)亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2有毒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析正确的是(_____ )
A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的浓度随PH增大而增大
C.PH=6时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 25℃时,该溶液在pH=4时比pH=2时更适合漂白
(4)akg 30%的双氧水理论上可最多制得___ kg NaClO2·3H2O

已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体在中性和碱性溶液中不能稳定存在。
回答下列问题:
(1)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的
(2)X酸是
(3)亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2有毒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析正确的是(

A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的浓度随PH增大而增大
C.PH=6时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 25℃时,该溶液在pH=4时比pH=2时更适合漂白
(4)akg 30%的双氧水理论上可最多制得
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
10. 甲、乙连个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度。
(1)甲组同学拟选用图l实验装置完成实验:
①写出实验中所发生主要反应的化学方程式____________
②该组同学必须选用的装置的连接顺序是:
A 接(____ ),(____ )接(____ ), (____ )接(____ ) (填接口字母,可不填满);
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。
①装置中导管a的作用:__________
②实验结束冷却至室温后,在读取量气管k中液面读数时,K中液面高于H中的液面,则测量结果将__________ (偏高,不变或偏低),若有影响,应进行_________ (操作)后再读效;
③若实验中样品的质量为mg,实验前后量气管k中液面读数分别为V0L、V1L(V0> V1换算成标况)。则样品的纯度为__________ (含m、V0、V1的表达式)
(3)图2的装置可测定一定质量铜铁合金(不含其它元素)样品中铁的质量分数。分液漏斗中加入的试剂是__________ .
(1)甲组同学拟选用图l实验装置完成实验:
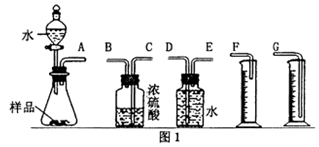
①写出实验中所发生主要反应的化学方程式
②该组同学必须选用的装置的连接顺序是:
A 接(
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。
①装置中导管a的作用:
②实验结束冷却至室温后,在读取量气管k中液面读数时,K中液面高于H中的液面,则测量结果将
③若实验中样品的质量为mg,实验前后量气管k中液面读数分别为V0L、V1L(V0> V1换算成标况)。则样品的纯度为
(3)图2的装置可测定一定质量铜铁合金(不含其它元素)样品中铁的质量分数。分液漏斗中加入的试剂是

您最近一年使用:0次
解答题-结构与性质
|
较难(0.4)
解题方法
11. 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为__________ ,有______ 个未成对电子。写出磷及其同周期相邻元素第一电离能的大小顺序_________ 。
(2)磷的一种同素异形体——白磷(P4)的其键角为_________ ,推测其在CS2中的溶解度___________ (填“大于”或“小于”)在水中的溶解度
(3)两种三角锥形气态氢化物膦(PH3)和氮(NH3)的键角分别为93.6°和107°,试分析PH3、的键角小于NH3的原因_________ 。写出一种与互为等电子体的阳离子_________ 。
(4)PCl3中心原子杂化轨道类型为________ ,VSEPR 模型为_______ 。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其立方体晶胞,其中的每个原子均满足8电子稳定结构,试判断其熔点______ (填“高于”或“低于”)金刚石熔点。
已知其B-P键长均为x cm,则其密度为_____ g/cm3(列出计算式即可)
(1)基态P原子的核外电子排布式为
(2)磷的一种同素异形体——白磷(P4)的其键角为
(3)两种三角锥形气态氢化物膦(PH3)和氮(NH3)的键角分别为93.6°和107°,试分析PH3、的键角小于NH3的原因
(4)PCl3中心原子杂化轨道类型为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其立方体晶胞,其中的每个原子均满足8电子稳定结构,试判断其熔点
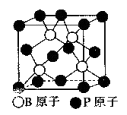
已知其B-P键长均为x cm,则其密度为
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
名校
解题方法
12. 辣椒中含辣椒素,局部应用可助减轻疼痛。辣椒素酯类化合物的结构可以表示为: (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
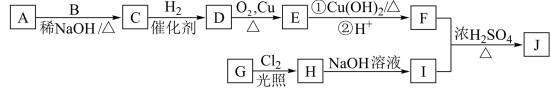
已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰,峰面积比分别为9:1和3:1;
②化合物J的分子式为C15H22O4;
③
回答下列问题:
(1)G中含有的官能团有_____ 、____ 。
(2)由C生成D的反应类型为____ ,D的化学名称为_____ 。
(3)①的化学方程式为_____ 。
(4)J的结构简式为___ 。
(5)G的同分异构体中,苯环上的一氯代物只有一种的共有___ 种(不含立体异构),核磁共振氢谱显示2组峰的是__ (写结构简式)。
 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰,峰面积比分别为9:1和3:1;
②化合物J的分子式为C15H22O4;
③

回答下列问题:
(1)G中含有的官能团有
(2)由C生成D的反应类型为
(3)①的化学方程式为
(4)J的结构简式为
(5)G的同分异构体中,苯环上的一氯代物只有一种的共有
您最近一年使用:0次
2017-02-23更新
|
510次组卷
|
4卷引用:2017届吉林省吉林大学附中高三上摸底考试四化学卷
试卷分析
整体难度:适中
考查范围:化学反应原理、有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 锰锌干电池 甲醛的毒性 大气污染来源及危害 | |
| 2 | 0.65 | 阿伏加德罗常数的应用 | |
| 3 | 0.65 | 胶体的制备 铁盐的检验 溶度积常数与溶解度的关系 配制一定物质的量浓度的溶液实验的误差分析 | |
| 4 | 0.65 | 同分异构体的数目的确定 乙烯的用途 苯的氧化反应 乙酸的酯化反应的机理 | |
| 5 | 0.4 | “位构性”关系理解及应用 结合物质计算的元素周期律、元素周期表相关推断 共价键概念及判断 | |
| 6 | 0.64 | 化学电源 | |
| 7 | 0.4 | 酸碱混合时的定性判断及计算 盐溶液中离子浓度大小的比较 盐的水解常数 | |
| 二、解答题 | |||
| 8 | 0.4 | 盖斯定律的应用 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 甲醇燃料电池 | 原理综合题 |
| 9 | 0.4 | 盐溶液中离子浓度大小的比较 电解池电极反应式及化学方程式的书写与判断 物质分离、提纯的常见化学方法 物质制备的探究 | 工业流程题 |
| 10 | 0.4 | 常用仪器及使用 化学实验基础操作 探究物质组成或测量物质的含量 综合实验设计与评价 | 实验探究题 |
| 11 | 0.4 | 电子排布式 元素性质与电负性的关系 晶胞的有关计算 | 结构与性质 |
| 12 | 0.4 | 常见官能团名称、组成及结构 根据要求书写同分异构体 同分异构体的数目的确定 有机推断综合考查 | 有机推断题 |



