湖北省孝感一中、应城一中等五校2018届高三上学期期末考试理综化学试题
湖北
高三
期末
2018-02-28
287次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
湖北省孝感一中、应城一中等五校2018届高三上学期期末考试理综化学试题
湖北
高三
期末
2018-02-28
287次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 化学与生产生活密切相关。下列说法错误的是
| A.生活污水进行脱氮脱磷处理可以减少水体富营养化 |
| B.增加炼铁高炉烟囱高度可以减小尾气中CO的浓度 |
| C.用臭氧杀灭地下害虫具有高效及环保等优点 |
| D.将装有硅胶和铁粉的小袋放入食品透气袋里,可防止食物受潮、氧化变质 |
【知识点】 硅酸 大气污染的治理原理及方法解读 水体污染来源及保护措施解读
您最近一年使用:0次
单选题
|
适中(0.65)
2. 用NA表示阿伏伽德罗常数的数值,下列说法正确的是
| A.24g Mg与足量N2反应生成Mg3N2,转移的电子数为6NA |
| B.lmol Na218O2中所含的中子数为42NA |
| C.9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA |
| D.1mol环己烷中含有的共价键数为12NA |
【知识点】 阿伏加德罗常数的求算解读
您最近一年使用:0次
2018-02-26更新
|
184次组卷
|
2卷引用:湖北省孝感一中、应城一中等五校2018届高三上学期期末考试理综化学试题
单选题
|
适中(0.65)
3. 曲酸和脱氧曲酸是非常有潜力的食品添加剂具有抗菌抗癌作用,其结构如图所示。下列有关叙述不正确的是
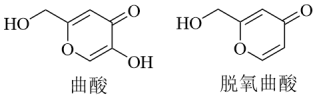

| A.曲酸的分子式为C6H6O4 |
| B.与脱氧曲酸互为同分异构体的芳香族化合物有4种(不考虑—O—O—键) |
| C.曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色 |
| D.脱氧曲酸能发生加成反应和酯化反应 |
【知识点】 有机官能团的性质及结构 多官能团有机物的结构与性质解读
您最近一年使用:0次
单选题
|
较难(0.4)
4. W、X、Y、Z为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,X与Z的最外层电子数之和为W与Y最外层电子数之和的四倍。下列叙述不正确的是
| A.Z的氧化物对应的水化物酸性均比X的强 |
| B.W、X、Z三种元素形成的化合物可能既含离子键又含共价键 |
| C.原子半径:Y>Z>W |
| D.单质的熔点:Y>X>W |
您最近一年使用:0次
单选题
|
适中(0.65)
5. 下列实验方案不能达到相应实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 比较水和乙醇中羟基氢的活泼性 | 将少量金属钠分别加入水和乙醇中 |
| B | 比较HA 和HB两种弱酸的Ka大小 | 用pH计测定同温同浓度的NaA溶液和NaB溶液的pH |
| C | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加KSCN溶液 |
| D | 验证Ksp(AgI)<Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加数滴AgNO3溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难(0.4)
6. 世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。

下列说法错误的是

下列说法错误的是
| A.X为电源正极 |
| B.若该装置在高温下进行,则净化效率将降低 |
| C.若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极上流出24mole- |
| D.若有1molNO3-被还原,则有6molH+通过质子膜迁移至阳极区 |
【知识点】 电解原理的应用
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 25 ℃时,体积均为20 mL、浓度均为0.1mol·L-1的两种酸HX、HY 分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
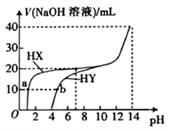

| A.Ka(HY)的数量级约为10-3 |
| B.a点c(X-)>b点c(Y-) |
| C.HX发生反应的离子方程式为HX +OH-=X-+H2O |
| D.pH=7时,两种反应后的溶液中c(Y- )>c(X-) |
您最近一年使用:0次
2018-01-07更新
|
654次组卷
|
7卷引用:河南省新乡市2018届高三第一次模拟测试理综化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
8. 利用H2还原铁的氧化物并确定其组成的装置如图所示(Zn粒中往往含有硫化物等杂质,焦性没食子酸溶液可吸收少量氧气)。
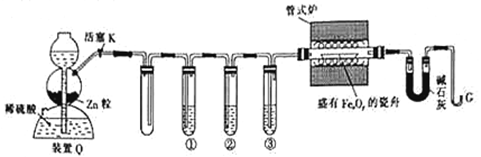
回答下列问题:
(1)装置Q(启普发生器)用于制备H2,还可用于_____ (填字母,下同)。
A.生石灰与浓氨水制NH3 B.过氧化钠与水制O2
C.硫化铁固体与稀硝酸制H2S D.大理石与稀盐酸制CO2
(2)①②③中依次盛装的试剂为__________________ 。
A.KMnO4酸性溶液、浓H2SO4、焦性没食子酸溶液
B.焦性没食子酸溶液、浓H2SO4、KMnO4酸性溶液
C. KMnO4酸性溶液、焦性没食子酸溶液、浓H2SO4
KMnO4酸性溶液中发生反应的离子方程式为_____________ 。
(3)“加热管式炉”和“打开活塞K”这两步操作应该先进行的是__________ ,在这两步之间还应进行的操作是_______________ 。
(4)反应过程中G管逸出的气体是___________ ,其处理方法是___________ 。
(5)结束反应时,应该___________ ,待装置冷却后称量并记录相应数据。
(6)假设反应完全后瓷舟中的固体只有Fe单质,实验中测得了下列数据: ①瓷舟的质量为30.4g;②瓷舟和FexOy的总质量为42.0g;③反应前U形管及内盛物的总质量为98.4g;④反应后U形管及内盛物的总质量为102.0g。由以上数据计算并确定该铁的氧化物的化学式为____________ 。

回答下列问题:
(1)装置Q(启普发生器)用于制备H2,还可用于
A.生石灰与浓氨水制NH3 B.过氧化钠与水制O2
C.硫化铁固体与稀硝酸制H2S D.大理石与稀盐酸制CO2
(2)①②③中依次盛装的试剂为
A.KMnO4酸性溶液、浓H2SO4、焦性没食子酸溶液
B.焦性没食子酸溶液、浓H2SO4、KMnO4酸性溶液
C. KMnO4酸性溶液、焦性没食子酸溶液、浓H2SO4
KMnO4酸性溶液中发生反应的离子方程式为
(3)“加热管式炉”和“打开活塞K”这两步操作应该先进行的是
(4)反应过程中G管逸出的气体是
(5)结束反应时,应该
(6)假设反应完全后瓷舟中的固体只有Fe单质,实验中测得了下列数据: ①瓷舟的质量为30.4g;②瓷舟和FexOy的总质量为42.0g;③反应前U形管及内盛物的总质量为98.4g;④反应后U形管及内盛物的总质量为102.0g。由以上数据计算并确定该铁的氧化物的化学式为
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
9. 纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。
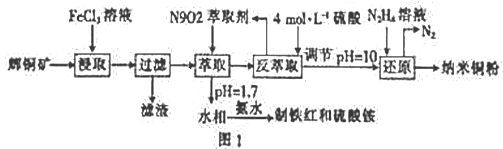
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________________ 。
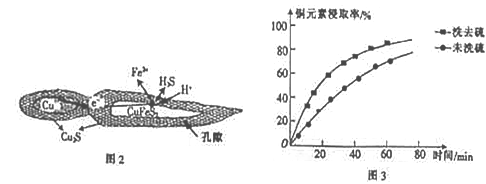
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为______ ;浸取时,在有氧环境下可维持Fe2+较高浓度,有关反应的离子方程式为________ 。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3 所示,未洗硫时铜元素浸取率较低,其原因是_____________________ 。
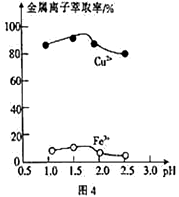
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4 所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe2+萃取率降低的原因是_________________ 。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_______________ 。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____ 、干燥、_____ 等操作可得到Fe2O3产品。

(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为

(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3 所示,未洗硫时铜元素浸取率较低,其原因是
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4 所示,当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe2+萃取率降低的原因是

(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、
【知识点】 氧化还原反应的应用 铜的其他化合物 物质分离、提纯综合应用解读
您最近一年使用:0次
2018-02-26更新
|
106次组卷
|
3卷引用:湖北省孝感一中、应城一中等五校2018届高三上学期期末考试理综化学试题
湖北省孝感一中、应城一中等五校2018届高三上学期期末考试理综化学试题广西2018届高三下学期第二次模拟理科综合化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题24 分离提纯型实验探究评价题
解答题-原理综合题
|
适中(0.65)
10. 科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________ 。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2,发生反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
①5min时三个容器中的反应达到化学平衡状态的是容器_______ (填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______ 。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器___________ 。(填序号,下同);平衡常数最小的是容器_____________ 。
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中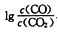 与温度(T)的关系如图2所示。下列说法正确的是
与温度(T)的关系如图2所示。下列说法正确的是_____ (填字母)。
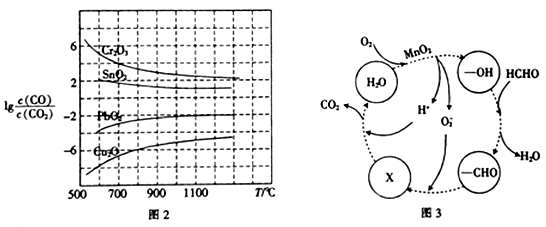
a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____ ,总反应的化学方程式为_________ 。
(1)已知:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;3CH3OH(g)
 CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol CO与H2合成CH3CH=CH2的热化学方程式为
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2molH2,发生反应:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。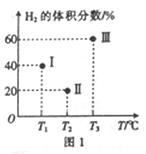
①5min时三个容器中的反应达到化学平衡状态的是容器
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中
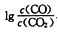 与温度(T)的关系如图2所示。下列说法正确的是
与温度(T)的关系如图2所示。下列说法正确的是
a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是
您最近一年使用:0次
2017-03-14更新
|
615次组卷
|
2卷引用:2017届湖南省邵阳市高三第二次大联考理综化学试卷
解答题-结构与性质
|
适中(0.65)
解题方法
11. 氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________ 。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____ ,C2F4分子中碳原子的杂化轨道类型是____ ,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________ 。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________ 。
③与NO2F分子互为等电子的非极性分子有__________ (写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
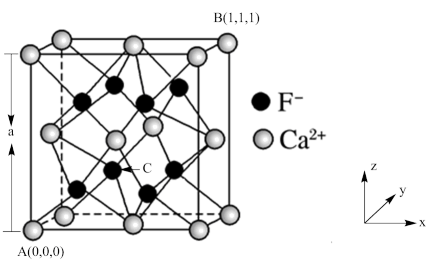
①CaF2晶胞中,Ca2+的配位数为_____ ;F-的配位数为_____ 。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________ 。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____ (列出计算式即可)g/cm3。
(1)基态氟原子的价电子排布式为
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因
③与NO2F分子互为等电子的非极性分子有
(3)CaF2的晶体结构如图所示。

①CaF2晶胞中,Ca2+的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为
您最近一年使用:0次
2018-02-26更新
|
301次组卷
|
2卷引用:湖北省孝感一中、应城一中等五校2018届高三上学期期末考试理综化学试题
解答题-有机推断题
|
适中(0.65)
名校
解题方法
12. 一种第二代抗组胺药物的中间体G的合成路线如下:
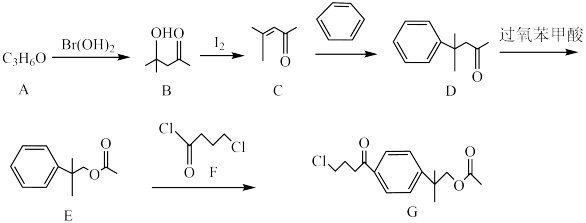
已知:A的分子结构中含有2个甲基。
回答下列问题:
(1)A的名称为__________ ,由A生成B的反应类型为_______ 。
(2)G中含氧官能团名称为_______ 。
(3)F的分子式为_______ 。
(4)由C生成D的化学方程式为______________ 。
(5)对二取代芳香化合物W是E的同分异构体,W能发生银镜反应和水解反应,水解产物之一能与FeCl3溶液发生显色反应,则W有________ 种结构,其中核磁共振氢谱为五组峰,且峰面积之比为1:2 : 2 : 2:9的结构简式为_____________ 。
(6)参照上述合成路线,以乙醛为原料(无机试剂任选),设计正丁醇的合成路线:_______________________________ 。

已知:A的分子结构中含有2个甲基。
回答下列问题:
(1)A的名称为
(2)G中含氧官能团名称为
(3)F的分子式为
(4)由C生成D的化学方程式为
(5)对二取代芳香化合物W是E的同分异构体,W能发生银镜反应和水解反应,水解产物之一能与FeCl3溶液发生显色反应,则W有
(6)参照上述合成路线,以乙醛为原料(无机试剂任选),设计正丁醇的合成路线:
您最近一年使用:0次
2018-02-26更新
|
437次组卷
|
4卷引用:湖北省孝感一中、应城一中等五校2018届高三上学期期末考试理综化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、认识化学科学、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 硅酸 大气污染的治理原理及方法 水体污染来源及保护措施 | |
| 2 | 0.65 | 阿伏加德罗常数的求算 | |
| 3 | 0.65 | 有机官能团的性质及结构 多官能团有机物的结构与性质 | |
| 4 | 0.4 | “位构性”关系理解及应用 结合物质计算的元素周期律、元素周期表相关推断 | |
| 5 | 0.65 | 电离平衡常数及影响因素 沉淀溶解平衡的应用 乙醇与钠反应 化学实验方案的设计与评价 | |
| 6 | 0.4 | 电解原理的应用 | |
| 7 | 0.65 | 弱电解质的电离平衡 一元强酸与一元弱酸的比较 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.65 | 铁的氧化物 物质分离、提纯综合应用 常见气体的制备与收集 探究物质组成或测量物质的含量 | 实验探究题 |
| 9 | 0.4 | 氧化还原反应的应用 铜的其他化合物 物质分离、提纯综合应用 | 实验探究题 |
| 10 | 0.65 | 盖斯定律的应用 化学反应速率计算 化学平衡状态的判断方法 转化率的相关计算及判断 | 原理综合题 |
| 11 | 0.65 | 电子排布式 等电子原理的应用 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 有机反应类型 根据要求书写同分异构体 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |



