河南省沈丘县第一高级中学2021届高三上学期1月质量检测理综化学试题
河南
高三
阶段练习
2021-02-23
250次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、有机化学基础、化学反应原理、物质结构与性质
河南省沈丘县第一高级中学2021届高三上学期1月质量检测理综化学试题
河南
高三
阶段练习
2021-02-23
250次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、有机化学基础、化学反应原理、物质结构与性质
一、单选题 添加题型下试题
1. 根据古代文献记载的化学知识,下列相关结论或应用错误的是
| 选项 | 文献记载 | 结论或应用 |
| A | 唐代金陵子称石胆(主要成分为CuSO4·5H2O)“浅碧色,烧之变白色者为真” | 古人鉴别石胆真伪 |
| B | 《天工开物》记载:造瓦“凡坯既成,干燥之后,则堆积窖中燃薪举火”,“浇水转釉(主要为青色) ,与造砖同法” | 造瓦时浇水转釉后,铁元素主要以氧化铁形式存在 |
| C | 《抱朴子内篇》记载:“曾青涂铁,铁赤色如铜” | 描述了湿法治铜的原理 |
| D | 南北朝时期陶弘景说:“水银,能消化金、银使成泥,人以镀物是也” | 汞、金、银形成的合金可用于器物上镀金、银. |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-28更新
|
529次组卷
|
6卷引用:河南省名校联盟2021届高三1月联考理综化学试题
河南省名校联盟2021届高三1月联考理综化学试题 河南省沈丘县第一高级中学2021届高三上学期1月质量检测理综化学试题黑龙江省齐齐哈尔市2021届高三第二次模拟考试理综化学试题(已下线)第10讲 金属材料及金属矿物的开发利用(精练)-2022年高考化学一轮复习讲练测河北省石家庄市第四十三中学2022-2023学年高三上学期10月月考化学试题(已下线)第5讲 金属材料与金属的冶炼
单选题
|
适中(0.65)
名校
2. 亚氯酸钠(NaClO2,不稳定,受热易分解)漂白织物时不损伤纤维,常用作高端漂白剂。其合成路线如图所示:
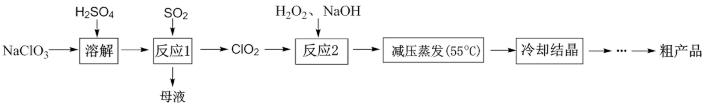
下列说法中错误的是

下列说法中错误的是
| A.“反应1”中制取67.5gClO2,理论上需要22.4L(标准状况)SO2 |
| B.温度过高会造成“”中的还原剂大量损失 |
| C.“减压蒸发”的主要目的是为了减少NaClO2的分解 |
| D.对粗产品进一步提纯可采取的操作为重结晶 |
您最近一年使用:0次
2021-01-16更新
|
261次组卷
|
2卷引用:河南省名校联盟2021届高三1月联考理综化学试题
单选题
|
适中(0.65)
名校
3. 某药物的中间体结构如图所示。下列有关说法中正确的是


| A.利用稀硝酸和硝酸银溶液可直接检验其中的溴元素 |
| B.在浓硫酸催化下,可发生消去反应(产生双键)或取代反应 |
| C.该有机物苯环上一氯代物有4种(不含立体异构) |
| D.1 mol该有机物与氢气加成,最多消耗4 mol氢气 |
您最近一年使用:0次
2021-01-16更新
|
379次组卷
|
4卷引用:河南省名校联盟2021届高三1月联考理综化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 碱性条件下,Na2S2O8(其中硫元素为+6价)活化Fe、SO 和·OH(SO
和·OH(SO 和·OH为具有强氧化性的自由基)去除水体中As(V)的机理模型如图所示:
和·OH为具有强氧化性的自由基)去除水体中As(V)的机理模型如图所示:

下列有关说法中错误的是
 和·OH(SO
和·OH(SO 和·OH为具有强氧化性的自由基)去除水体中As(V)的机理模型如图所示:
和·OH为具有强氧化性的自由基)去除水体中As(V)的机理模型如图所示:
下列有关说法中错误的是
| A.1 mol Na2S2O8中含有NA个过氧键(-O-O-) |
| B.pH过低时可能会影响除砷效果 |
C.SO 和S2O 和S2O 均能腐蚀铁,持续释放Fe2+ 均能腐蚀铁,持续释放Fe2+ |
D.强碱性条件下,溶液中的自由基主要为SO |
【知识点】 化学反应条件的控制及优化
您最近一年使用:0次
2021-01-16更新
|
291次组卷
|
2卷引用:河南省名校联盟2021届高三1月联考理综化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 主族元素W、X、Y、Z的原子序数依次增大且不超过20,化合物ZYWX常用作检验某金属阳离子的试剂,电解该化合物的水溶液可生成一种结构如图所示的黄色液体(YWX)2.下列说法正确的是
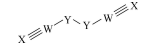
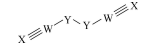
| A.X的最简单氢化物是一种弱电解质 |
| B.Z的单质能从硫酸铜溶液中置换铜 |
| C.ZYWX结构中存在离子键和共价键 |
| D.W、X、Y的氧化物对应水化物的酸性逐渐增强 |
您最近一年使用:0次
2021-01-16更新
|
196次组卷
|
2卷引用:河南省名校联盟2021届高三1月联考理综化学试题
6. 磷酸铁锂锂离子电池具有寿命长、高温性能好、大容量等特点。如图为磷酸铁锂锂离子电池结构示意图。已知放电时正极反应式为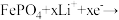
 。下列说法错误的是
。下列说法错误的是

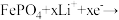
 。下列说法错误的是
。下列说法错误的是
| A.该电池的电解质不可能为稀硫酸溶液 |
| B.关闭K2、打开K1,Li+通过锂离子膜移向负极 |
| C.该电池在充、放电过程中,铁的化合价发生了变化 |
| D.关闭K1、打开K2,阳极反应式为LiFePO4-xe-=xFePO4 +(1-x)LiFePO4+xLi+ |
【知识点】 非电解质、电解质物质类别判断解读 二次电池
您最近一年使用:0次
2021-01-16更新
|
145次组卷
|
2卷引用:河南省名校联盟2021届高三1月联考理综化学试题
单选题
|
较易(0.85)
名校
解题方法
7. 常温下,向Na2R溶液中缓慢通入氯化氢气体,溶液中-lgc(HR-)或-lgc(HR-)或-lgc(R2-)-lgc(R2-)分别与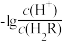 或
或 之间变化关系(曲线L1、L2)如图所示。下列说法中错误的是
之间变化关系(曲线L1、L2)如图所示。下列说法中错误的是
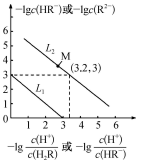
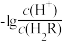 或
或 之间变化关系(曲线L1、L2)如图所示。下列说法中错误的是
之间变化关系(曲线L1、L2)如图所示。下列说法中错误的是
| A.Ka2(H2R)的数量级为10-7 |
| B.NaHR 溶液显酸性 |
| C.M点溶液中:c(H+ )+c(Na+ )=c(HR-)+2c(R2- )+c(OH- ) |
| D.Na2R溶液中: c(OH- ) >c(HR-)+ c(H2R) |
您最近一年使用:0次
2021-01-16更新
|
275次组卷
|
2卷引用:河南省名校联盟2021届高三1月联考理综化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
8. 某课外活动小组利用石墨电极电解1mol·L-1的FeCl2溶液,探究影响电解产物的因素,回答下列问题:
(1)实验室配制1mol·L-1的FeCl2溶液时,为了防止 FeCl2被氧化常加入适量的_______ (填试剂名称),若配制100mL此溶液,需要用托盘天平称量FeCl2·4H2O的质量为_______ g。
(2)探究装置如图所示:

①湿润淀粉KI试纸检测的物质是_______ (填化学式)。
②从价态角度分析,在两极均有可能放电的离子是_______ (填离子符号,下同)。
③在无限稀释的水溶液中部分离子的离子淌度如下表所示(注:淌度越大的离子向电极的迁移速率越快):
仅从淌度角度分析,_______ 在B电极放电更具优势。
(3)电解电压控制在1.5V时,电解现象如下表所示:
①实验Ⅱ中阳极电极反应式为_______ 。
②实验I中溶液变浑浊的主要原因是_______ 。
③结合上述实验,试分析影响阴极放电物质的主要因素是_______ 。
(1)实验室配制1mol·L-1的FeCl2溶液时,为了防止 FeCl2被氧化常加入适量的
(2)探究装置如图所示:

①湿润淀粉KI试纸检测的物质是
②从价态角度分析,在两极均有可能放电的离子是
③在无限稀释的水溶液中部分离子的离子淌度如下表所示(注:淌度越大的离子向电极的迁移速率越快):
| 阳离子 | 淌度(10-8m2·V-1.s-1) | 阴离子 | 淌度(10-8m2·V-1.s-1) |
| H+ | 36.3 | OH- | 20.5 |
| Li+ | 4.01 | Cl- | 7.91 |
| Na+ | 5.19 | I- | 7.95 |
| Fe2+ | 5.4 | SO | 8.27 |
(3)电解电压控制在1.5V时,电解现象如下表所示:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | |
| 溶液pH | pH=4.91 | pH=2.38 | pH=-0.43 | |
| 阳极 | 湿润淀粉KI试纸 | 未变色 | 未变色 | 未变色 |
| 电极附近溶液加KSCN | 盐酸酸化才变红 | 无需酸化即可变红 | 无需酸化即可变红 | |
| 是否出现浑浊 | 变浑浊 | 少量浑浊 | 无浑浊 | |
| 阴极 | 是否有气泡产生 | 无 | 无 | 有 |
| 电极表面是否出现镀层 | 出现银白色镀层 | 出现银白色镀层 | 无镀层出现 | |
①实验Ⅱ中阳极电极反应式为
②实验I中溶液变浑浊的主要原因是
③结合上述实验,试分析影响阴极放电物质的主要因素是
您最近一年使用:0次
2021-01-16更新
|
527次组卷
|
3卷引用:河南省名校联盟2021届高三1月联考理综化学试题
河南省名校联盟2021届高三1月联考理综化学试题 河南省沈丘县第一高级中学2021届高三上学期1月质量检测理综化学试题(已下线)03 物质成分或反应产物探究类综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
解答题-工业流程题
|
适中(0.65)
名校
解题方法
9. ZnO广泛应用于橡胶、涂料、陶瓷等行业。利用锌渣(主要成分为ZnO,还含有铜、铁、铅、锰等素的氧化物)经过二次净化可制取高纯ZnO,其流程如图所示:
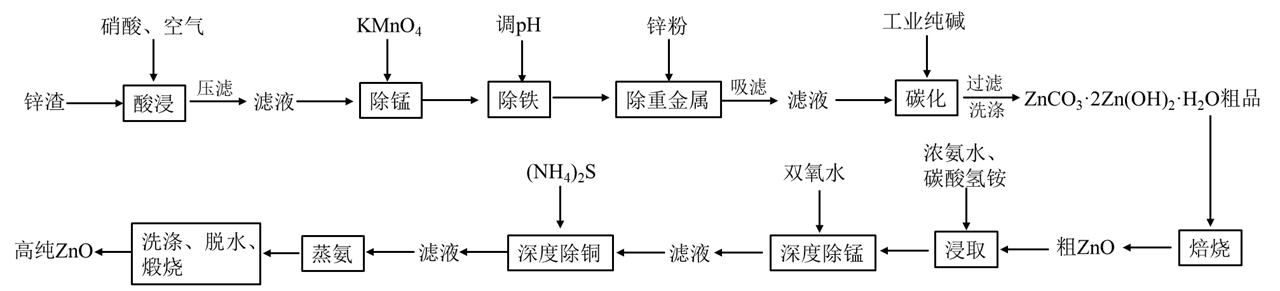
已知:①ZnS和CuS的Ksp分别为2.5×10-22、6.4×10-36。
②Zn与铝及其化合物的性质相似。
回答下列问题:
(1)“酸浸”步骤中氧化铁参与反应的离子方程式为_______ 。
(2)“碳化”步骤中生成碱式碳酸锌,同时还会有CO2生成,写出该反应的化学方程式:_______ ,“碳化”步骤中溶液的碱性过强,锌离子易转化为一种可溶性盐,从而使碱式碳酸锌产量偏小,该可溶性锌盐的化学式为_______ 。
(3)“深度除锰”过程是利用双氧水将滤液中微量的Mn(OH)2转化为更难溶的MnO2·H2O,参与反应的n(H2O2):n[Mn(OH)2]=_______ 。
(4)“深度除铜”步骤中发生反应为[ 。
。
① 与高纯ZnO产率之间关系如下表所示:
与高纯ZnO产率之间关系如下表所示:
随 增大,高纯ZnO产率有所下降的原因是
增大,高纯ZnO产率有所下降的原因是_______ 。
②除铜后要求溶液中c(Cu2+)≤1.0×10-6,若溶液中Zn2+浓度为2mol·L-1,试计算说明溶液是否达到要求:_______ (写出计算过程)。
(5)“蒸氨”步骤有氨气和二氧化碳生成,用水吸收后可返回_______ (填流程图中的步骤名称)步骤循环利用。

已知:①ZnS和CuS的Ksp分别为2.5×10-22、6.4×10-36。
②Zn与铝及其化合物的性质相似。
回答下列问题:
(1)“酸浸”步骤中氧化铁参与反应的离子方程式为
(2)“碳化”步骤中生成碱式碳酸锌,同时还会有CO2生成,写出该反应的化学方程式:
(3)“深度除锰”过程是利用双氧水将滤液中微量的Mn(OH)2转化为更难溶的MnO2·H2O,参与反应的n(H2O2):n[Mn(OH)2]=
(4)“深度除铜”步骤中发生反应为[
 。
。①
 与高纯ZnO产率之间关系如下表所示:
与高纯ZnO产率之间关系如下表所示: | 1 | 1.1 | 1.2 |
| 高纯ZnO产率 | 99.98% | 99.90% | 99.62% |
 增大,高纯ZnO产率有所下降的原因是
增大,高纯ZnO产率有所下降的原因是②除铜后要求溶液中c(Cu2+)≤1.0×10-6,若溶液中Zn2+浓度为2mol·L-1,试计算说明溶液是否达到要求:
(5)“蒸氨”步骤有氨气和二氧化碳生成,用水吸收后可返回
您最近一年使用:0次
2021-01-16更新
|
127次组卷
|
2卷引用:河南省名校联盟2021届高三1月联考理综化学试题
解答题-原理综合题
|
较难(0.4)
名校
解题方法
10. 环戊二烯(C5H6)常温下呈液体,是一种重要的医药中间体。回答下列问题:
(1)已知:


液态环戊二烯发生氢化反应生成1mol液态环戊烷[C5H10(l)]的ΔH=_______ kJ·mol-1。
(2)气相的环戊二烯易发生双聚化反应:2C5H6(g)=C10H12(g) ΔH<0。
①下列有关双聚化反应的说法中正确的是_______ (填字母)。
A.分离出C10H12能够提高C5H6转化率
B.双聚化反应的正反应的活化能大于逆反应的活化能
C.升温有利于提高活化分子的百分数
D.升高温度,正反应速率减小
②130℃条件下,将nmol C5H6(g)置于1L刚性容器中发生上述反应,t时刻容器中气体的总压为p(总),C10H12(g)的物质的量为x,试写出C5H6(g)在t时刻的分压表达式:_______ 。
③一定温度下,将0.006 mol液态C5H6(置于1L刚性容器中,将容器中的空气抽空后,加热到130℃使之气化,保持温度为130℃,容器中的总压随时间变化如下表所示:
C5H6刚好完全气化后容器内的压强为20.36 kPa(此时容器中气体可看成全部为C5H6),则50 min时气体的总物质的量为_______ ×10-3 mol(保留小数点后一位,下同),C10H12(g)表示的反应速率为_______ ×10-5 mol·L-1·min-1。
(3)一定温度下,将物质的量分数为80%的C10H12(g)、20%的水蒸气通入恒压反应釜中(反应釜中压强保持500 kPa),发生解聚反应C10H12(g)=2C5H6(g)。
①增大水蒸气的量,可提高解聚反应的转化率,其原因是_______ 。
②若该温度下C10H12(g)的平衡转化率为50%,则解聚反应的平衡常数Kp=_______ kPa(结果保留一位小数,用分压表示,分压=总压×物质的量分数)。
(1)已知:



液态环戊二烯发生氢化反应生成1mol液态环戊烷[C5H10(l)]的ΔH=
(2)气相的环戊二烯易发生双聚化反应:2C5H6(g)=C10H12(g) ΔH<0。
①下列有关双聚化反应的说法中正确的是
A.分离出C10H12能够提高C5H6转化率
B.双聚化反应的正反应的活化能大于逆反应的活化能
C.升温有利于提高活化分子的百分数
D.升高温度,正反应速率减小
②130℃条件下,将nmol C5H6(g)置于1L刚性容器中发生上述反应,t时刻容器中气体的总压为p(总),C10H12(g)的物质的量为x,试写出C5H6(g)在t时刻的分压表达式:
③一定温度下,将0.006 mol液态C5H6(置于1L刚性容器中,将容器中的空气抽空后,加热到130℃使之气化,保持温度为130℃,容器中的总压随时间变化如下表所示:
| t(min) | 10 | 20 | 30 | 40 | 50 | 60 |
| p(kPa) | 18.07 | 16.62 | 15.63 | 14.87 | 14.33 | 13.88 |
(3)一定温度下,将物质的量分数为80%的C10H12(g)、20%的水蒸气通入恒压反应釜中(反应釜中压强保持500 kPa),发生解聚反应C10H12(g)=2C5H6(g)。
①增大水蒸气的量,可提高解聚反应的转化率,其原因是
②若该温度下C10H12(g)的平衡转化率为50%,则解聚反应的平衡常数Kp=
【知识点】 化学反应原理综合考查解读 化学平衡的有关计算
您最近一年使用:0次
2021-01-16更新
|
321次组卷
|
2卷引用:河南省名校联盟2021届高三1月联考理综化学试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
11. 铜锌合金俗称“黄铜”,具有很多优异的性能。回答下列问题:
(1)铜原子失电子转变为亚铜离子过程中,失去的电子位于基态铜原子的_______ 能级。铜的焰色反应呈绿色,焰色反应过程中,用光谱仪所摄取的光谱为_______ 。
(2)Zn2+和Cu2+能与含氮化合物如NH3、乙二胺(H2N-CH2CH2-NH2)等形成配合物。
①Zn2+与乙二胺形成配合物时,提供孤电子对的原子为_______ (填元素符号)。
②乙二胺分子中碳原子的杂化类型为_______ 。乙二胺易溶于水,除因为是极性分子外,还可能的原因为_______ 。
③Zn2+与NH3形成的配离子为[Zn(NH3)6]2+,其结构如图所示(其余5个NH3未画出),在该配离子中氨气的键角比独立存在的气态氨气分子中键角略大,其原因是_______ 。

④向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:_______
(3)A和B是两种含铜超导体材料的晶胞,其中B可通过A掺杂Ca2+获得。

晶胞A的密度为_______ g·cm-3(设NA为阿伏加德罗常数的值),若晶胞A中“2”号Ba2+的坐标参数为( ,
, ,
,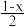 ),则“1”号Ba2+的坐标参数为
),则“1”号Ba2+的坐标参数为_______ ,晶胞B的化学式为_______ 。
(1)铜原子失电子转变为亚铜离子过程中,失去的电子位于基态铜原子的
(2)Zn2+和Cu2+能与含氮化合物如NH3、乙二胺(H2N-CH2CH2-NH2)等形成配合物。
①Zn2+与乙二胺形成配合物时,提供孤电子对的原子为
②乙二胺分子中碳原子的杂化类型为
③Zn2+与NH3形成的配离子为[Zn(NH3)6]2+,其结构如图所示(其余5个NH3未画出),在该配离子中氨气的键角比独立存在的气态氨气分子中键角略大,其原因是

④向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:
(3)A和B是两种含铜超导体材料的晶胞,其中B可通过A掺杂Ca2+获得。

晶胞A的密度为
 ,
, ,
,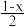 ),则“1”号Ba2+的坐标参数为
),则“1”号Ba2+的坐标参数为
您最近一年使用:0次
2021-01-16更新
|
284次组卷
|
4卷引用:河南省名校联盟2021届高三1月联考理综化学试题
河南省名校联盟2021届高三1月联考理综化学试题 河南省沈丘县第一高级中学2021届高三上学期1月质量检测理综化学试题黑龙江省鹤岗市第一中学2021届高三下学期2月月考理综化学试题(已下线)大题08 物质结构与性质(一)(选修)-【考前抓大题】备战2021年高考化学(全国通用)
解答题-有机推断题
|
适中(0.65)
名校
12. 化合物G是一种治疗关节疼痛的药物,其一种合成路线如图所示(部分反应条件已经略去):

回答下列问题:
(1)有机物A的名称为_______ 。
(2)由B生成C的反应类型为_______ 。
(3)C中官能团的名称为_______ ;E中手性碳(注:连有4个不同的原子或基团的碳)的个数为_______ 。
(4)F生成G时,还会有硫酸铵生成,写出反应的化学方程式:_______ 。
(5)比G少5个碳原子的G的同系物为X,其同分异构体有多种,写出同时符合以下条件的X的同分异构体的结构简式_______ 。
①属于芳香酯 ②核磁共振氢谱中有四组峰,且峰的面积之比为3:2:2:1
(6)已知 设计以苯甲醛(
设计以苯甲醛( )为原料制备苯甲胺
)为原料制备苯甲胺 )的合成路线:
)的合成路线:_______ (其他试剂任选)。

回答下列问题:
(1)有机物A的名称为
(2)由B生成C的反应类型为
(3)C中官能团的名称为
(4)F生成G时,还会有硫酸铵生成,写出反应的化学方程式:
(5)比G少5个碳原子的G的同系物为X,其同分异构体有多种,写出同时符合以下条件的X的同分异构体的结构简式
①属于芳香酯 ②核磁共振氢谱中有四组峰,且峰的面积之比为3:2:2:1
(6)已知
 设计以苯甲醛(
设计以苯甲醛( )为原料制备苯甲胺
)为原料制备苯甲胺 )的合成路线:
)的合成路线:【知识点】 有机物的合成 逆合成分析法解读 根据题给物质选择合适合成路线解读
您最近一年使用:0次
2021-01-16更新
|
636次组卷
|
3卷引用:河南省名校联盟2021届高三1月联考理综化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、有机化学基础、化学反应原理、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 铁的氧化物 硫酸铜 常见合金的组成 | |
| 2 | 0.65 | 氧化还原反应方程式的配平 蒸发与结晶 常见无机物的制备 | |
| 3 | 0.65 | 同分异构体的数目的确定 苯的加成反应 卤代烃中卤素原子的检验 醇的消去反应 | |
| 4 | 0.65 | 化学反应条件的控制及优化 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 | |
| 6 | 0.65 | 非电解质、电解质物质类别判断 二次电池 | |
| 7 | 0.85 | 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 盐的水解常数 | |
| 二、解答题 | |||
| 8 | 0.65 | 亚铁盐溶液的配制与保存 电解原理的理解及判断 通过实验探究电解原理 化学实验探究 | 实验探究题 |
| 9 | 0.65 | 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 10 | 0.4 | 化学反应原理综合考查 化学平衡的有关计算 | 原理综合题 |
| 11 | 0.65 | 价层电子对互斥理论 杂化轨道理论 配合物 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 有机物的合成 逆合成分析法 根据题给物质选择合适合成路线 | 有机推断题 |



