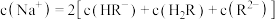今有浓度分别为amol·L-1、bmol·L-1的MCl和NCl两种正盐的稀溶液,下列说法不正确的是( )
| A.若a=b,并测得两溶液中的总离子浓度分别为x和y,且x>y,则相同浓度时,碱性:MOH>NOH |
| B.若a=b,并测得c(M+)=c(N+)+c(NOH),则MOH是强碱,NOH是弱碱 |
| C.若a>b,测得c(M+)=c(N+),则可推出溶液中c(MOH)>c(NOH),且相同浓度时,碱性MOH<NOH |
| D.若两溶液等体积混合,测得c(M+)+c(N+)+c(MOH)+c(NOH)=0.1mol·L-1,则可推出a+b=0.1 |
2020高三·全国·专题练习 查看更多[2]
更新时间:2020-04-15 18:16:26
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】25℃时,向100 mL 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错 
误 的是



| A.a点时溶液的pH<1 |
| B.a点到b点的过程中,溶液的导电能力减弱 |
C.ab段上的点(不包括a点)均满足关系式:c (NH4+)+c(Na+)<2c(SO42-) (NH4+)+c(Na+)<2c(SO42-) |
| D.b点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)> c(H+)> c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】室温下,用0.1 mol/L 的盐酸滴定相同浓度的25 mL溴化肼(N2H5Br)溶液,已知肼(N2H4)是二元弱碱,N2H4+H2O⇌N2H +OH﹣ Kb1=1.0×10﹣6,N2H
+OH﹣ Kb1=1.0×10﹣6,N2H +H2O⇌
+H2O⇌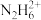 +OH﹣ Kb2=1.3×10﹣15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是
+OH﹣ Kb2=1.3×10﹣15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是

 +OH﹣ Kb1=1.0×10﹣6,N2H
+OH﹣ Kb1=1.0×10﹣6,N2H +H2O⇌
+H2O⇌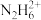 +OH﹣ Kb2=1.3×10﹣15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是
+OH﹣ Kb2=1.3×10﹣15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是
| A.N2H4与硫酸反应形成的酸式盐的化学式为N2H6(HSO4)2 |
B.b点表示盐酸与溴化肼恰好完全反应:c(Cl﹣)=c(Br﹣)>c(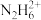 ) ) |
C.a点对应的溶液中:c(Br﹣)+c(OH﹣)=c(N2H )+2c( )+2c(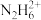 )+c(H+) )+c(H+) |
D.c点的混合溶液中:c(Cl﹣)>c(Br﹣)>c(H+)>c(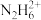 )>c(N2H )>c(N2H )>c(OH﹣) )>c(OH﹣) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】向0.1mol/I.的NH4HCO3溶液中逐渐加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图象,下列说法不正确的是( )


| A.开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O |
| B.当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 |
| C.pH=9.5时,溶液中c(HCO3-)>c(NH3•H2O)>c(NH4+)>c(CO32-) |
| D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的分布分数δ[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如NH
和NH3·H2O的分布分数δ[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如NH 的分布分数δ(NH
的分布分数δ(NH )=
)= ]与滴加盐酸体积的关系如图所示。下列叙述正确的是
]与滴加盐酸体积的关系如图所示。下列叙述正确的是

 和NH3·H2O的分布分数δ[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如NH
和NH3·H2O的分布分数δ[平衡时某含氮微粒的浓度占含氮微粒总浓度的分数,如NH 的分布分数δ(NH
的分布分数δ(NH )=
)= ]与滴加盐酸体积的关系如图所示。下列叙述正确的是
]与滴加盐酸体积的关系如图所示。下列叙述正确的是
A.曲线a代表δ(NH3·H2O),曲线b代表δ(NH ) ) |
| B.M点加入盐酸体积为12.5mL |
| C.NH3·H2O的电离常数的数量级为10-5 |
| D.应选用酚酞为指示剂,滴定终点溶液的颜色变化为红色变为无色 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】已知常温下Ka(CH3COOH)>Ka(HClO)、Ksp(AgCl)>Ksp(AgBr)。下列分析不正确的是
| A.将10 mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) |
| B.现有①200 mL 0.1 mol/L NaClO溶液,②100 mL0.1 mol/L CH3COONa溶液,两种溶液中的阴离子的物质的量浓度之和:②>① |
C.向0.1 mol/L NH4Cl溶液中加入少量NH4Cl固体: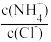 比值减小 比值减小 |
| D.将AgBr和AgCl的饱和溶液等体积混合,再加入足量AgNO3浓溶液:产生的AgCl沉淀多于AgBr沉淀 |
您最近一年使用:0次

 溶液中加入
溶液中加入 溶液调节溶液的
溶液调节溶液的 ,测得溶液中含R微粒占所有含R微粒的物质的量分数
,测得溶液中含R微粒占所有含R微粒的物质的量分数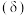 与溶液
与溶液

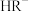 占所有含R微粒的物质的量分数的变化
占所有含R微粒的物质的量分数的变化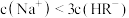
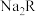 溶液中:
溶液中: