超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个C60分子、2个p—甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
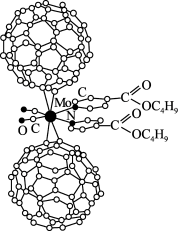
(1)Mo处于第五周期第VIB族,核外电子排布与Cr相似,它的基态价电子排布式是________ ;核外未成对电子数是________ 个。
(2)该超分子中配体CO提供孤电子对的原子是________ (填元素符号),p—甲酸丁酯吡啶配体中C原子的杂化方式有________ 。(已知吡啶可看做苯分子中的一个CH原子团被N取代的化合物)
(3)已知:C60分子中存在碳碳单、双键;C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。则一个C60分子的结构是由_____ 个五边形和____ 个六边形组成的球体。用文字简述C60跟F2在一定条件下反应所得的物质的组成:__________________ 。
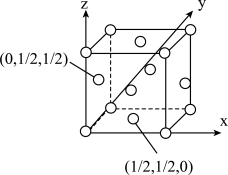
(4)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点的原子坐标均可以为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及( ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是_____________ 。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加 德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为_____ pm。

(1)Mo处于第五周期第VIB族,核外电子排布与Cr相似,它的基态价电子排布式是
(2)该超分子中配体CO提供孤电子对的原子是
(3)已知:C60分子中存在碳碳单、双键;C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。则一个C60分子的结构是由
(4)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点的原子坐标均可以为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(
 ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是
更新时间:2020-04-22 21:45:32
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】从铜电解液分离出的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。

已知:
i.含镍溶液中的主要离子有: 、
、 、
、 、
、 、
、 、
、 和
和
ii.部分物质的电离常数和溶度积常数如下表。回答下列问题:
(1)将粗硫酸镍溶液的pH调小至0.5,加入的试剂是___________ 。
(2)滤渣1中除CuS外,还含有 和S。反应生成
和S。反应生成 和S的离子方程式是:
和S的离子方程式是:______ 。
(3)“氧化除杂”时,加入 的目的
的目的___________ 。
(4)用沉淀溶解平衡原理解释用 能够“氟化除杂”的原因
能够“氟化除杂”的原因___________ 。
(5)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。
①将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是___________ (填标号)。
A. B.
B. C.
C. D.
D.
②如图是硫的四种含氧酸根的结构:

根据组成和结构推断,能在酸性溶液中将 转化为
转化为 的是
的是___________ (填标号)。理由是___________ 。
③如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若图中A原子的坐标为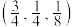 ,则B的原子坐标为
,则B的原子坐标为___________ 。


已知:
i.含镍溶液中的主要离子有:
 、
、 、
、 、
、 、
、 、
、 和
和
ii.部分物质的电离常数和溶度积常数如下表。回答下列问题:
| 物质 | 溶度积常数 | 物质 | 溶度积常数 | 物质 | 溶度积常数 |
| CuS |  |  |  |  |  |
| NiS |  |  | 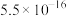 |  |  |
| FeS |  |
(1)将粗硫酸镍溶液的pH调小至0.5,加入的试剂是
(2)滤渣1中除CuS外,还含有
 和S。反应生成
和S。反应生成 和S的离子方程式是:
和S的离子方程式是:(3)“氧化除杂”时,加入
 的目的
的目的(4)用沉淀溶解平衡原理解释用
 能够“氟化除杂”的原因
能够“氟化除杂”的原因(5)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。
①将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是
A.
 B.
B. C.
C. D.
D.
②如图是硫的四种含氧酸根的结构:

根据组成和结构推断,能在酸性溶液中将
 转化为
转化为 的是
的是③如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为
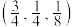 ,则B的原子坐标为
,则B的原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是______ ,基态Zn原子的价电子排布式为______ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,非金属元素的电负性由大到小排序为_____ 。
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是______ 。
(4)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为_____ 。(只答一种)
③[Zn(CN)4]2-中Zn2+与碳原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____ 。
(5)金属锌晶体的晶胞如图所示,若锌原子的半径为r nm,则金属锌晶体的空间利用率是______ (用含r、π的代数式表示)。

(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,非金属元素的电负性由大到小排序为
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(4)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与碳原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(5)金属锌晶体的晶胞如图所示,若锌原子的半径为r nm,则金属锌晶体的空间利用率是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S2O )可看作是SO
)可看作是SO 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
(1)基态S原子的核外电子排布式是_______ 。
(2)比较S原子和O原子的电负性大小,从原子结构的角度说明理由:_______ 。
(3)S2O 的空间结构是
的空间结构是_______ 。
(4)同位素示踪实验可证实S2O 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为

过程ii中,S2O 断裂的只有硫硫键,若过程i所用试剂是Na232SO3和35S,过程ii含硫产物是
断裂的只有硫硫键,若过程i所用试剂是Na232SO3和35S,过程ii含硫产物是_______ 。
(5)MgS2O3•6H2O的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。晶胞中的[Mg(H2O)6]2+个数为_______ 。已知阿伏加德罗常数的值为NA,该晶体的密度为ρg•cm-3,MgS2O3•6H2O的摩尔质量M=_______ g•mol-1(1nm=10-7cm,用含有字母的代数式表示)。

(6)浸金时,S2O 作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2O
作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2O 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:_______ 。
 )可看作是SO
)可看作是SO 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。(1)基态S原子的核外电子排布式是
(2)比较S原子和O原子的电负性大小,从原子结构的角度说明理由:
(3)S2O
 的空间结构是
的空间结构是(4)同位素示踪实验可证实S2O
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为
过程ii中,S2O
 断裂的只有硫硫键,若过程i所用试剂是Na232SO3和35S,过程ii含硫产物是
断裂的只有硫硫键,若过程i所用试剂是Na232SO3和35S,过程ii含硫产物是(5)MgS2O3•6H2O的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。晶胞中的[Mg(H2O)6]2+个数为

(6)浸金时,S2O
 作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2O
作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2O 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6
(1)颜料中含有Cu元素,基态Cu原子的价电子排布式为___________ ;Si、O、Ba元素电负性由大到小的顺序为_____ ,干冰、Si、SiC熔点由高到低的顺序为_____________ 。
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配位化合物,其中提供孤电子对的是_______ 元素。
(3)铜可作CH3CH2OH氧化生成CH3CHO的催化剂。乙醇的沸点高于乙醛,其主要原因是_____________________________ 。
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式________________ ;C、N、O的第一电离能由大到小的顺序为__________________________________ 。
②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。
ⅰ.g-C3N4中氮原子的杂化类型是___________________ 。
ⅱ.根据图2,在图1中用平行四边形画出一个最小重复单元_____________ 。
ⅲ.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g- C3N4的密度为___________________ 。
(1)颜料中含有Cu元素,基态Cu原子的价电子排布式为
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配位化合物,其中提供孤电子对的是
(3)铜可作CH3CH2OH氧化生成CH3CHO的催化剂。乙醇的沸点高于乙醛,其主要原因是
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式
②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。

ⅰ.g-C3N4中氮原子的杂化类型是
ⅱ.根据图2,在图1中用平行四边形画出一个最小重复单元
ⅲ.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g- C3N4的密度为
您最近一年使用:0次
【推荐2】邻羟基苯甲酸俗称水杨酸,具有抗炎、抗菌、角质调节等作用。其分子结构如图所示。
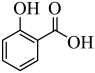
回答下列问题:
(1)下列关于水杨酸的说法中合理的是_______ (填标号)。
a.属于分子晶体 b.沸点高于对羟基苯甲酸 c.相同条件下,在水中的溶解度小于对羟基苯甲酸
(2)具有酚羟基的物质通常能与 溶液发生显色反应。其显色原理是苯酚电离出的
溶液发生显色反应。其显色原理是苯酚电离出的 和
和 形成配位键,得到的
形成配位键,得到的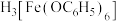 显紫色。
显紫色。
①基态 的核外电子排布式为
的核外电子排布式为_______ 。
②实验发现对羟基苯甲酸不能与 溶液发生显色反应,从电离平衡的角度解释其原因可能是
溶液发生显色反应,从电离平衡的角度解释其原因可能是_______ 。
③查阅资料可知,对甲基苯酚与 溶液作用显蓝色,不同的酚类物质与
溶液作用显蓝色,不同的酚类物质与 显示不同的颜色,从分子结构的角度解释其原因可能是
显示不同的颜色,从分子结构的角度解释其原因可能是_______ 。
(3)理论上可以通过乙酸和邻羟基苯甲酸反应制备阿司匹林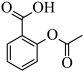 ,然而实际生产中该反应产率极低。
,然而实际生产中该反应产率极低。
已知:i.乙醇和乙酸在酸性条件下发生酯化反应,部分反应机理如下:
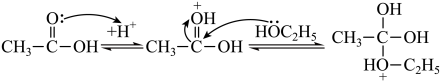
ii.苯酚中氧原子 轨道与碳原子
轨道与碳原子 轨道平行,氧原子p轨道电子云与苯环大
轨道平行,氧原子p轨道电子云与苯环大 键电子云发生重叠,电子向苯环偏移,降低了氧原子周围的电子云密度。
键电子云发生重叠,电子向苯环偏移,降低了氧原子周围的电子云密度。
①H、O、C电负性由大到小的顺序为_______ 。
②苯酚中氧原子的杂化方式为_______ 。
③该方法产率极低的原因可能有两种:原因一是邻羟基苯甲酸可以形成分子内氢键,阻碍酯化反应发生;原因二是_______ 。

回答下列问题:
(1)下列关于水杨酸的说法中合理的是
a.属于分子晶体 b.沸点高于对羟基苯甲酸 c.相同条件下,在水中的溶解度小于对羟基苯甲酸
(2)具有酚羟基的物质通常能与
 溶液发生显色反应。其显色原理是苯酚电离出的
溶液发生显色反应。其显色原理是苯酚电离出的 和
和 形成配位键,得到的
形成配位键,得到的 显紫色。
显紫色。①基态
 的核外电子排布式为
的核外电子排布式为②实验发现对羟基苯甲酸不能与
 溶液发生显色反应,从电离平衡的角度解释其原因可能是
溶液发生显色反应,从电离平衡的角度解释其原因可能是③查阅资料可知,对甲基苯酚与
 溶液作用显蓝色,不同的酚类物质与
溶液作用显蓝色,不同的酚类物质与 显示不同的颜色,从分子结构的角度解释其原因可能是
显示不同的颜色,从分子结构的角度解释其原因可能是(3)理论上可以通过乙酸和邻羟基苯甲酸反应制备阿司匹林
 ,然而实际生产中该反应产率极低。
,然而实际生产中该反应产率极低。已知:i.乙醇和乙酸在酸性条件下发生酯化反应,部分反应机理如下:

ii.苯酚中氧原子
 轨道与碳原子
轨道与碳原子 轨道平行,氧原子p轨道电子云与苯环大
轨道平行,氧原子p轨道电子云与苯环大 键电子云发生重叠,电子向苯环偏移,降低了氧原子周围的电子云密度。
键电子云发生重叠,电子向苯环偏移,降低了氧原子周围的电子云密度。①H、O、C电负性由大到小的顺序为
②苯酚中氧原子的杂化方式为
③该方法产率极低的原因可能有两种:原因一是邻羟基苯甲酸可以形成分子内氢键,阻碍酯化反应发生;原因二是
您最近一年使用:0次
【推荐3】开发新型储氢材料,能有效解决氢气的贮存和输运问题,对大规模使用氢能具有重要的意义。
(1)方海平教授在还原氧化石墨烯膜上直接观察到了自然环境下生成的二维CaCl晶体(钙离子的价态为+1),该晶体可形成石墨烯-CaCl异质结,具备显著的储氢和释氢能力。

①二维CaCl具有金属性,可能原因为___________ 。
②出现这种反常化学计量比现象被称为反晶,原因是阴、阳离子与芳香环之间的作用不同导致的,与芳香环作用力较强的是___________ (填“阳离子”或“阴离子”)。
(2)氨硼烷(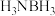 )是目前最具潜力的储氢材料之一,可由
)是目前最具潜力的储氢材料之一,可由 (俗称无机苯,结构为平面六元环状)制得。
(俗称无机苯,结构为平面六元环状)制得。
①第一电离能介于B和N之间的第二周期元素有___________ 种。
② 中含有和苯类似的
中含有和苯类似的 大
大 键,则N原子中参与形成大
键,则N原子中参与形成大 键电子占据
键电子占据___________ (填标号)。
a.2s轨道 b.2p轨道 c.sp杂化轨道 d. 杂化轨道
杂化轨道
(3)“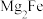 ”的氢化物是目前已发现的体积储氢密度最高的储氢材料之一,其部分晶体结构如下图所示,晶胞参数为acm。结构中,Fe原子采取立方密堆积,Mg占据其堆积形成的所有四面体空隙且处于中心位置,H原子以正八面体的配位模式有序分布在Fe的周围,H-Fe键长为晶胞参数的
”的氢化物是目前已发现的体积储氢密度最高的储氢材料之一,其部分晶体结构如下图所示,晶胞参数为acm。结构中,Fe原子采取立方密堆积,Mg占据其堆积形成的所有四面体空隙且处于中心位置,H原子以正八面体的配位模式有序分布在Fe的周围,H-Fe键长为晶胞参数的 。
。

①写出该氢化物的化学式___________ 。
②计算Mg-H键长___________ (用含a的公式表示)。
③计算该氢化物中氢的密度
___________  。
。
(1)方海平教授在还原氧化石墨烯膜上直接观察到了自然环境下生成的二维CaCl晶体(钙离子的价态为+1),该晶体可形成石墨烯-CaCl异质结,具备显著的储氢和释氢能力。

①二维CaCl具有金属性,可能原因为
②出现这种反常化学计量比现象被称为反晶,原因是阴、阳离子与芳香环之间的作用不同导致的,与芳香环作用力较强的是
(2)氨硼烷(
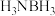 )是目前最具潜力的储氢材料之一,可由
)是目前最具潜力的储氢材料之一,可由 (俗称无机苯,结构为平面六元环状)制得。
(俗称无机苯,结构为平面六元环状)制得。①第一电离能介于B和N之间的第二周期元素有
②
 中含有和苯类似的
中含有和苯类似的 大
大 键,则N原子中参与形成大
键,则N原子中参与形成大 键电子占据
键电子占据a.2s轨道 b.2p轨道 c.sp杂化轨道 d.
 杂化轨道
杂化轨道(3)“
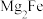 ”的氢化物是目前已发现的体积储氢密度最高的储氢材料之一,其部分晶体结构如下图所示,晶胞参数为acm。结构中,Fe原子采取立方密堆积,Mg占据其堆积形成的所有四面体空隙且处于中心位置,H原子以正八面体的配位模式有序分布在Fe的周围,H-Fe键长为晶胞参数的
”的氢化物是目前已发现的体积储氢密度最高的储氢材料之一,其部分晶体结构如下图所示,晶胞参数为acm。结构中,Fe原子采取立方密堆积,Mg占据其堆积形成的所有四面体空隙且处于中心位置,H原子以正八面体的配位模式有序分布在Fe的周围,H-Fe键长为晶胞参数的 。
。
①写出该氢化物的化学式
②计算Mg-H键长
③计算该氢化物中氢的密度

 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】氮族元素的单质及其化合物在生活、生产中有广泛应用。
(1)下列电子排布图能表示基态N原子的电子排布情况的是_______ (填代号)。
A.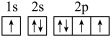 B.
B. 
C. D.
D. 
(2)键角: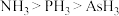 ,从原子结构角度分析原因:
,从原子结构角度分析原因:_______ 。 中As原子的杂化类型是
中As原子的杂化类型是_______ ,空间构型是_______ 。
(3)白磷中毒后,用硫酸铜溶液解毒,其化学反应原理如下:
①白磷的结构如图所示,上述反应转移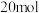 电子时,破坏
电子时,破坏
_______  键。与
键。与 中阴离子互为等电子体的分子有
中阴离子互为等电子体的分子有_______ (填一种即可)。

②Cu3P中铜离子的价层电子排布式为_______ 。
③在 溶液中滴加过量氨水生成蓝色溶液,主要成分是
溶液中滴加过量氨水生成蓝色溶液,主要成分是 ,它不含的作用力类型有
,它不含的作用力类型有_______ 。 填代号
填代号
a.离子键 b.金属键 c.配位键 d.极性共价键
(4)联氨 的沸点为
的沸点为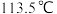 ,联磷
,联磷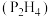 的沸点为
的沸点为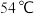 ,其主要原因是
,其主要原因是_______ 。
(5)磷化硼是半导体材料,早在1891年,法国化学家亨利∙莫瓦桑就合成了磷化硼晶体,其晶胞如图所示。磷化硼的化学式为_______ 。磷化硼的熔点为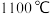 ,它的晶体类型是
,它的晶体类型是_______ 。

(6)砷化镓是重要的半导体材料,用来制作半导体激光器和太阳电池等元件。砷化镓晶胞如图所示。已知砷化镓的摩尔质量为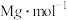 ,密度为
,密度为 ,
, 代表阿伏加 德罗常数的值。图中x和y最短核间距离为
代表阿伏加 德罗常数的值。图中x和y最短核间距离为_______ pm。

(1)下列电子排布图能表示基态N原子的电子排布情况的是
A.
 B.
B. 
C.
 D.
D. 
(2)键角:
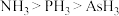 ,从原子结构角度分析原因:
,从原子结构角度分析原因: 中As原子的杂化类型是
中As原子的杂化类型是(3)白磷中毒后,用硫酸铜溶液解毒,其化学反应原理如下:

①白磷的结构如图所示,上述反应转移
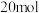 电子时,破坏
电子时,破坏
 键。与
键。与 中阴离子互为等电子体的分子有
中阴离子互为等电子体的分子有
②Cu3P中铜离子的价层电子排布式为
③在
 溶液中滴加过量氨水生成蓝色溶液,主要成分是
溶液中滴加过量氨水生成蓝色溶液,主要成分是 ,它不含的作用力类型有
,它不含的作用力类型有 填代号
填代号
a.离子键 b.金属键 c.配位键 d.极性共价键
(4)联氨
 的沸点为
的沸点为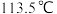 ,联磷
,联磷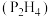 的沸点为
的沸点为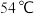 ,其主要原因是
,其主要原因是(5)磷化硼是半导体材料,早在1891年,法国化学家亨利∙莫瓦桑就合成了磷化硼晶体,其晶胞如图所示。磷化硼的化学式为
 ,它的晶体类型是
,它的晶体类型是
(6)砷化镓是重要的半导体材料,用来制作半导体激光器和太阳电池等元件。砷化镓晶胞如图所示。已知砷化镓的摩尔质量为
 ,密度为
,密度为 ,
, 代表阿伏加 德罗常数的值。图中x和y最短核间距离为
代表阿伏加 德罗常数的值。图中x和y最短核间距离为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
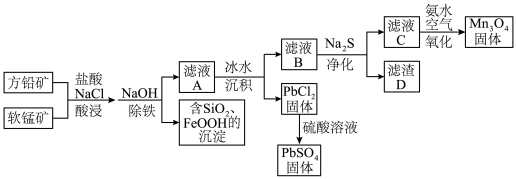
【推荐2】以方铅矿(主要含PbS、FeS2、ZnS)和软锰矿(主要含MnO2、SiO2及铁的氧化物)为原料联合制取PbSO4和Mn3O4的一种流程示意图如下: [PbCl4]2- (aq) △H > 0
[PbCl4]2- (aq) △H > 0
(1)“酸浸”过程使矿石中的金属元素浸出,铅和锰分别以[PbCl4]2-和Mn2+的形式浸出。
① 加快浸出速率可采取的措施有___________ (写出2条)。
② 补全PbS与MnO2反应的离子方程式___________ 。
PbS +MnO2 +___________+___________= [PbCl4]2- +SO +___________+___________
+___________+___________
③ 加酸时,方案1:将盐酸一次性加入,硫元素主要转化为S单质;方案2:将盐酸间隔一定时间分两次加入,硫元素主要转化为SO ,该工艺流程采用方案2,理由是
,该工艺流程采用方案2,理由是___________ 。
(2)“除铁”时,加入NaOH至溶液pH≈3,过量的软锰矿将Fe2+氧化生成沉淀,写出发生反应的离子方程式___________ 。
(3)滤渣D的主要成分是PbS和ZnS,滤液C中c(Pb2+) = 7.7×10-7 mol·L-1,c(Zn2+) = 1.3×10-6 mol·L-1,则可推断Ksp(PbS)、Ksp(ZnS)、Ksp(MnS)的大小关系为___________ 。
(4)“氧化”过程,生成Mn3O4时参加反应的氧化剂与还原剂的物质的量之比为___________ (Mn3O4的结构式为 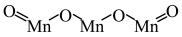 )。
)。
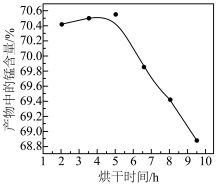
(5)干燥温度为90℃,对产品Mn3O4进行鼓风烘干,得到的产物中锰含量结果如图所示,5 h后随干燥时间的延长,产品中的锰含量下降的原因可能是___________ 。
 [PbCl4]2- (aq) △H > 0
[PbCl4]2- (aq) △H > 0(1)“酸浸”过程使矿石中的金属元素浸出,铅和锰分别以[PbCl4]2-和Mn2+的形式浸出。
① 加快浸出速率可采取的措施有
② 补全PbS与MnO2反应的离子方程式
PbS +MnO2 +___________+___________= [PbCl4]2- +SO
 +___________+___________
+___________+___________③ 加酸时,方案1:将盐酸一次性加入,硫元素主要转化为S单质;方案2:将盐酸间隔一定时间分两次加入,硫元素主要转化为SO
 ,该工艺流程采用方案2,理由是
,该工艺流程采用方案2,理由是(2)“除铁”时,加入NaOH至溶液pH≈3,过量的软锰矿将Fe2+氧化生成沉淀,写出发生反应的离子方程式
(3)滤渣D的主要成分是PbS和ZnS,滤液C中c(Pb2+) = 7.7×10-7 mol·L-1,c(Zn2+) = 1.3×10-6 mol·L-1,则可推断Ksp(PbS)、Ksp(ZnS)、Ksp(MnS)的大小关系为
(4)“氧化”过程,生成Mn3O4时参加反应的氧化剂与还原剂的物质的量之比为
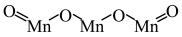 )。
)。(5)干燥温度为90℃,对产品Mn3O4进行鼓风烘干,得到的产物中锰含量结果如图所示,5 h后随干燥时间的延长,产品中的锰含量下降的原因可能是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的核外电子排布式是___________ ,M在元素周期表中的位置是___________ ,元素B、D、E的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(2)元素A和E组成的阳离子空间构型为___________ ;化合物ABD的结构式为___________ ,其中B原子的杂化方式为___________ 。
(3)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙,常温下,若甲、乙两溶液的pH均等于5,则由水电离出的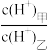 =
=___________ ;乙溶液中所含离子的物质的量浓度由大到小的顺序是___________ 。
(4)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为___________ ;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是___________ 。
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___________ 。
请回答下列问题:
(1)基态G原子的核外电子排布式是
(2)元素A和E组成的阳离子空间构型为
(3)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙,常温下,若甲、乙两溶液的pH均等于5,则由水电离出的
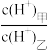 =
=(4)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】氮气、羟基乙胺(HOCH2CH2NH2)和氮化镓都含氮元素,其用途非常广泛。回答下列问题:
(1)基态氮原子价层电子排布图为___ ,其中电子能量最高的能级是___ 。
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为___ ,其中C和N的杂化方式均为___ HOCH2CH2NH2中∠HOC小于∠HNC,其原因是___ 。
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中___ 区,该环状配离子的配位原子为___ 。
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的___ (选填:八面体空隙、正四面体空隙、立方体空隙或三角形空隙);已知该晶胞底边边长为apm,高为cpm,阿伏加 德罗常数的值为NA,则该晶体的密度为___ g•cm-3(列出计算式即可)。

(1)基态氮原子价层电子排布图为
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的

您最近一年使用:0次
【推荐2】氧化物种类繁多,在生产生活中有广泛应用。按要求回答下列问题。
(1)三种氧化物的熔沸点如下表所示:
三种物质中,MgO熔点最高的原因是____ 。
(2)Ag2O晶体的立方晶胞如图Ⅰ所示,该晶胞中表示O2−的是____ (填“A”或“B”),由B构成的空间构型为____ 。其晶胞的俯视图如图Ⅱ所示,其中A的坐标参数为(0,0,1),则B的坐标参数为____ 。

(3)某种氧化镍晶体中存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,结果其晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。该氧化镍样品的组成可表示为NixO,晶体中Ni3+与Ni2+的个数比为1:11,则x的值为____ 。

(4)某氧化物超导材料钙钛矿晶胞结构如图所示,该化合物的化学式为_____ ,已知正方体的边长为a pm,该晶体的密度为ρ g·cm-3,则阿伏加 德罗常数的值可表示为_______ (用含a、ρ的式子表示)。

(1)三种氧化物的熔沸点如下表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| As2O3 | 175 | 457.2(193℃时升华) |
| MgO | 2800 | 3600 |
| Na2O | 1275 | 1950 |
三种物质中,MgO熔点最高的原因是
(2)Ag2O晶体的立方晶胞如图Ⅰ所示,该晶胞中表示O2−的是

(3)某种氧化镍晶体中存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,结果其晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。该氧化镍样品的组成可表示为NixO,晶体中Ni3+与Ni2+的个数比为1:11,则x的值为

(4)某氧化物超导材料钙钛矿晶胞结构如图所示,该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】我国科学家研究发现,在KOH催化下,CO(NH2)2和LiTPSI还原形成稳定的LiF/高分子双层SEI,使LiMn2O4//Li4T15O12电池稳定工作。请回答下列问题:
(1)基态Mn2+的电子排布式为[Ar]____ 。基态K原子核外电子云轮廓图呈球形的能级上占据的电子总数为____ 。
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是____ 。
(3)CO(NH2)2中元素电负性由大到小的顺序为____ (用元素符号表示)。CO(NH2)2分子中碳原子的杂化方式为____ 。
(4)几种钛的卤化物的熔点如表所示:
钛的卤化物熔点呈上述变化的主要原因是____ 。
(5)一种钛的氧化物晶胞如图1所示,其化学式为____ 。
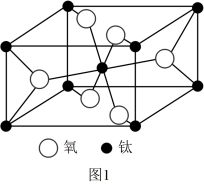
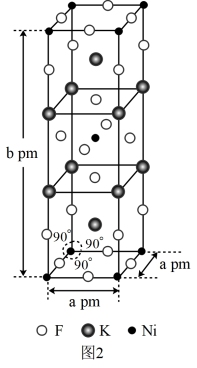
(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为____ g·cm-3(只列计算式即可)。
(1)基态Mn2+的电子排布式为[Ar]
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是
(3)CO(NH2)2中元素电负性由大到小的顺序为
(4)几种钛的卤化物的熔点如表所示:
| 卤化物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -25 | 39 | 150 |
(5)一种钛的氧化物晶胞如图1所示,其化学式为

(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为

您最近一年使用:0次



