二氧化氯(ClO2)可以除去工业污水中的氰化物,反应的离子方程式为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-
完成下列填空:
(1)上述反应所涉及元素的原子半径由大到小的顺序是___ ;其中原子核外有两个未成对电子的元素有___ 。请比较碳和氮元素非金属性强弱___ (用一个化学反应方程式表示)。
(2)二氧化氯还可以除去污水中的锰离子,请配平如下反应:___ 。
ClO2+MnSO4+H2O→MnO2↓+HCl+H2SO4
若反应中生成0.2molMnO2,则电子转移___ 个。
(3)氯的另一种氧化物Cl2O每个原子都达到8电子稳定结构,它的电子式为___ 。
(4)另一种处理含氰化物污水的方法是电解法,分析判断CN-是在___ 极上(选填编号:①阴;②阳)被反应成CO2和N2,判断的依据是___ 。
完成下列填空:
(1)上述反应所涉及元素的原子半径由大到小的顺序是
(2)二氧化氯还可以除去污水中的锰离子,请配平如下反应:
ClO2+MnSO4+H2O→MnO2↓+HCl+H2SO4
若反应中生成0.2molMnO2,则电子转移
(3)氯的另一种氧化物Cl2O每个原子都达到8电子稳定结构,它的电子式为
(4)另一种处理含氰化物污水的方法是电解法,分析判断CN-是在
更新时间:2020-05-17 16:00:55
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。
(1) 请补充空白并配平化学方程式。
____ KClO3+____ HCl(浓) → ____ KCl+____ ClO2↑+____ Cl2↑+ ___
(2) 浓盐酸在反应中显示出来的性质是________ (填序号)
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为________ 。
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的______ 倍。
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:___________________________________ 。
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
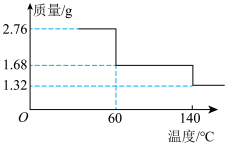
①试确定60 ℃时CaO2·xH2O中x=________ 。
②该样品中CaO2的质量分数为________ 。(保留一位小数)
(1) 请补充空白并配平化学方程式。
(2) 浓盐酸在反应中显示出来的性质是
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。

①试确定60 ℃时CaO2·xH2O中x=
②该样品中CaO2的质量分数为
您最近一年使用:0次
【推荐2】近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L。已知在酸性条件下有以下反应:
①2BrO3-+I2→2IO3-+Br2;
②2IO3-+10Br-+12H+→I2+5Br2+6H2O;
③5Br-+BrO3-+6H+→3Br2+3H2O。
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由___ 。
(2)反应②中:IO3-→I2发生的是___ 反应(选填“氧化”、“还原”)。
现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图所示关系:
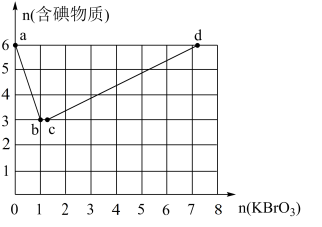
(3)a→b阶段的反应为(写出产物并配平)I-+BrO3-+H+→___ 。
(4)b→c阶段为反应③,其中氧化产物和还原产物的物质的量之比为___ 。
①2BrO3-+I2→2IO3-+Br2;
②2IO3-+10Br-+12H+→I2+5Br2+6H2O;
③5Br-+BrO3-+6H+→3Br2+3H2O。
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由
(2)反应②中:IO3-→I2发生的是
现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图所示关系:

(3)a→b阶段的反应为(写出产物并配平)I-+BrO3-+H+→
(4)b→c阶段为反应③,其中氧化产物和还原产物的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)很多含氯物质都能做消毒剂。液氯可以用于饮用水消毒,但是消毒后的水中可能产生危害人体健康的有机氯化物。世界各国陆续开发新型自来水消毒剂,下列物质可以用于自来水消毒的有___ 。
A.Na2O2 B.ClO2 C.O3 D.O2 E.HCl
(2)84消毒液是一种常用消毒剂,其中的有效成分是___ (写出化学式)。高铁酸钠(Na2FeO4)也可以用于作自来水处理剂,高铁酸钠处理过的水中含有氢氧化铁胶体,则高铁酸钠作自来水处理剂的优点是___ 。
(3)漂白粉的质量靠它的“有效氯”衡量。有效氯是根据它同盐酸作用时产生的氯气量来计算的。写出由漂白粉的有效成分Ca(ClO)2和浓HCl发生反应制备Cl2化学方程式:___ 。
生成的微量氯气与氢碘酸反应,可以得到碘单质,反应生成的碘与Na2S2O3可以定量的进行反应:2Na2S2O3+I2=Na2S4O6+2NaI,漂白粉的有效氯= ×100%。漂白粉的有效氯一般高于30.0%,某化工厂漂白粉22.0g进行上述一系列反应进行测定,消耗硫代硫酸钠0.200mol,则其有效氯为
×100%。漂白粉的有效氯一般高于30.0%,某化工厂漂白粉22.0g进行上述一系列反应进行测定,消耗硫代硫酸钠0.200mol,则其有效氯为___ 。
A.Na2O2 B.ClO2 C.O3 D.O2 E.HCl
(2)84消毒液是一种常用消毒剂,其中的有效成分是
(3)漂白粉的质量靠它的“有效氯”衡量。有效氯是根据它同盐酸作用时产生的氯气量来计算的。写出由漂白粉的有效成分Ca(ClO)2和浓HCl发生反应制备Cl2化学方程式:
生成的微量氯气与氢碘酸反应,可以得到碘单质,反应生成的碘与Na2S2O3可以定量的进行反应:2Na2S2O3+I2=Na2S4O6+2NaI,漂白粉的有效氯=
 ×100%。漂白粉的有效氯一般高于30.0%,某化工厂漂白粉22.0g进行上述一系列反应进行测定,消耗硫代硫酸钠0.200mol,则其有效氯为
×100%。漂白粉的有效氯一般高于30.0%,某化工厂漂白粉22.0g进行上述一系列反应进行测定,消耗硫代硫酸钠0.200mol,则其有效氯为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】电化学的发展对人类文明的进步起到了推动作用。
I.用如图装置研究原电池原理。
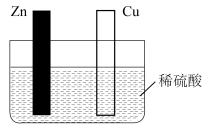
(1)用导线连接前,该装置中主要的能量转化形式为:_______ 能→_______ 能;用导线连接后,Cu表面电极反应式为_______ 。
(2)连接前后,装置中现象的差异有_______ 。
II.我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如图所示:
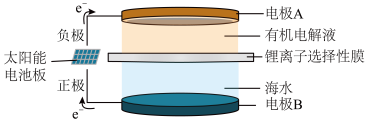
(3)电极A是_______ 极,金属锂在电极_______ (选填“A”或“B”)上生成。阳极上能产生两种气体单质,分别是Cl2和_______ 。
I.用如图装置研究原电池原理。

(1)用导线连接前,该装置中主要的能量转化形式为:
(2)连接前后,装置中现象的差异有
II.我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如图所示:

(3)电极A是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】如下图所示,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试完成以下问题:
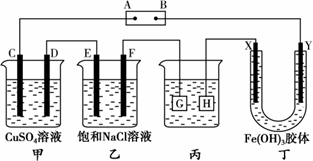
(1)电源B极的名称是________ 。
(2)乙装置中电解反应的总化学方程式是________________________ 。
(3)如果收集甲装置中两极上析出的物质,两种物质的物质的量比是(阳极比阴极)________ 。
(4)欲用丙装置给铜镀银,G应该是____ (填“铜”或“银”),电镀液的主要成分是______ (填化学式)。

(1)电源B极的名称是
(2)乙装置中电解反应的总化学方程式是
(3)如果收集甲装置中两极上析出的物质,两种物质的物质的量比是(阳极比阴极)
(4)欲用丙装置给铜镀银,G应该是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ、空气污染物NO通常用含 的吸收液吸收(反应后Ce为+3价),生成
的吸收液吸收(反应后Ce为+3价),生成 、
、 ,再利用电解法将上述吸收液中的
,再利用电解法将上述吸收液中的 转化为无毒物质,其原理如图所示:.
转化为无毒物质,其原理如图所示:.
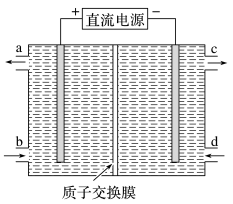
(1)已知NO被吸收的过程中,当600mL的吸收液的pH由6降为2时,转移的电子数为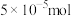 ,试写出吸收过程中发生的离子反应方程式(反应前后溶液的体积不变):
,试写出吸收过程中发生的离子反应方程式(反应前后溶液的体积不变):________________________________ 。
(2)电解过程中 从电解槽的
从电解槽的________ 口(填“a、b、c、d”)流出
(3)阴极的电极反应式:______________________________________ 。
Ⅱ、2019年10月9日,瑞典皇家科学院宣布,将209年诺贝尔化学奖授予 John B. Goodenough、M. Stanley Whittingham、Akira Yoshino,以表彰他们对锂离子电池研发领域做出的贡献。作为电动车的“颠覆者”,特斯拉公司所采用的正是高效锂电池: 电池(正极材料为
电池(正极材料为 ,负放电极材料为石墨和Li,含
,负放电极材料为石墨和Li,含 导电固体为电解质),其工作原理为:
导电固体为电解质),其工作原理为: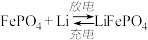 。
。
(1)放电过程中,正极反应式为:_____________________________________ ;
(2)放电结束后,负极材料应与电源________ 极相连进行充电
(3)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。一定条件下,利用上述 电池作为电源进行电解,原理如图所示,可实现有机物的电化学储氢(忽略其它有机物)。已知:电流效率
电池作为电源进行电解,原理如图所示,可实现有机物的电化学储氢(忽略其它有机物)。已知:电流效率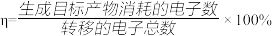
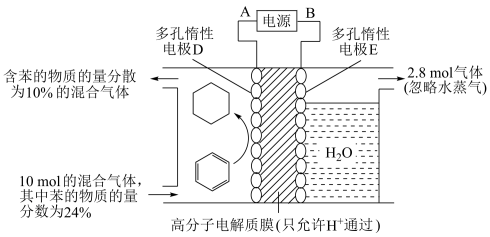
①生成目标产物的电极反应式为_____________________________________ 。
②该储氢装置的电流效率
_________________________ 。(保留一位小数)
③上述锂电池正极材料的质量将增加______ g;
 的吸收液吸收(反应后Ce为+3价),生成
的吸收液吸收(反应后Ce为+3价),生成 、
、 ,再利用电解法将上述吸收液中的
,再利用电解法将上述吸收液中的 转化为无毒物质,其原理如图所示:.
转化为无毒物质,其原理如图所示:.
(1)已知NO被吸收的过程中,当600mL的吸收液的pH由6降为2时,转移的电子数为
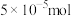 ,试写出吸收过程中发生的离子反应方程式(反应前后溶液的体积不变):
,试写出吸收过程中发生的离子反应方程式(反应前后溶液的体积不变):(2)电解过程中
 从电解槽的
从电解槽的(3)阴极的电极反应式:
Ⅱ、2019年10月9日,瑞典皇家科学院宣布,将209年诺贝尔化学奖授予 John B. Goodenough、M. Stanley Whittingham、Akira Yoshino,以表彰他们对锂离子电池研发领域做出的贡献。作为电动车的“颠覆者”,特斯拉公司所采用的正是高效锂电池:
 电池(正极材料为
电池(正极材料为 ,负放电极材料为石墨和Li,含
,负放电极材料为石墨和Li,含 导电固体为电解质),其工作原理为:
导电固体为电解质),其工作原理为: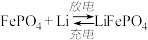 。
。(1)放电过程中,正极反应式为:
(2)放电结束后,负极材料应与电源
(3)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。一定条件下,利用上述
 电池作为电源进行电解,原理如图所示,可实现有机物的电化学储氢(忽略其它有机物)。已知:电流效率
电池作为电源进行电解,原理如图所示,可实现有机物的电化学储氢(忽略其它有机物)。已知:电流效率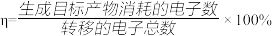

①生成目标产物的电极反应式为
②该储氢装置的电流效率

③上述锂电池正极材料的质量将增加
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题(书写相关符号)。
(1)上述8种元素中,写出④⑦⑧元素的符号___________ ,其中非金属性最强的是___________ 。
(2)元素③、⑤、⑥原子半径由大到小为___________ 。
(3)元素②的原子结构示意图为___________ 。
(4)元素②、③形成的气态氢化物热稳定性:___________ >___________ ;元素①、③、⑤的化合物,写出其电子式:___________ 。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的方程式为___________ 。
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:___________ 。
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述8种元素中,写出④⑦⑧元素的符号
(2)元素③、⑤、⑥原子半径由大到小为
(3)元素②的原子结构示意图为
(4)元素②、③形成的气态氢化物热稳定性:
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的方程式为
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题:
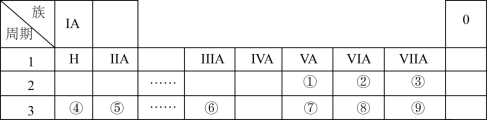
(l)②表示的元素是______ (填元素符号).
(2)②③④⑤⑧和⑨这六种元素的简单离子半径由小到大排序为:__________ (用离子符号表示);上表所示元素中,非金属性最强的是 ______ (填元素符号);⑦⑧⑨这三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序为:_______________ (填分子式)
(3)元素⑨的单质可以用来制取漂白粉,漂白粉的有效成分是______ (填化学式);用电子式表示元素⑤与⑨形成化合物的过程 ______ .
(4)上述元素中,单质能与水剧烈反应且水作还原剂,此单质是_________ (填化学式)
(5)写出元素④的最高价氧化物对应的水化物与元素⑥的最高价氧化物相互反应的化学方程式______ .
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
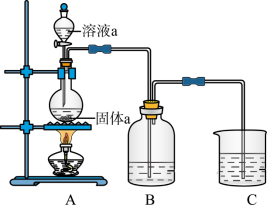
① 装置B中溶液的溶质为______ (写化学式).
② 装置C中盛放烧碱稀溶液,目的是______ .反应的离子方程式是______

(l)②表示的元素是
(2)②③④⑤⑧和⑨这六种元素的简单离子半径由小到大排序为:
(3)元素⑨的单质可以用来制取漂白粉,漂白粉的有效成分是
(4)上述元素中,单质能与水剧烈反应且水作还原剂,此单质是
(5)写出元素④的最高价氧化物对应的水化物与元素⑥的最高价氧化物相互反应的化学方程式
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:

① 装置B中溶液的溶质为
② 装置C中盛放烧碱稀溶液,目的是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
针对元素①~⑩回答下列问题。
(1)元素①和②的单质化合形成的化合物NaH中H元素的化合价为_______ ;NaH能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,其化学方程式为_______ 。
(2)元素④是人体必不可缺少的一种元素,缺乏会出现骨质疏松、易骨折等症状,请写出其原子结构示意图_______ 。
(3)由元素①和⑥形成的一种物质是天然气的主要成分,其电子式为_______ ;元素⑥还可以和⑦形成一种三原子直线型分子,其结构式为_______ ;元素②的单质在元素⑦的单质中点燃生成的淡黄色固体将其投入硫酸亚铁溶液中,预测主要的反应现象是_______ 。
(4)元素③、⑧、⑨的简单离子中半径最大是_______ (填离子符号),元素②和⑤的最高价氧化物对应的水化物之间可以发生反应,其反应的离子方程式为_______ 。
(5)表中元素⑨和⑩的气态氢化物中更稳定的是_______ (填化学式)。
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ⑤ | ⑧ | ⑨ | ||||
| 4 | ③ | ④ | ⑩ |
(1)元素①和②的单质化合形成的化合物NaH中H元素的化合价为
(2)元素④是人体必不可缺少的一种元素,缺乏会出现骨质疏松、易骨折等症状,请写出其原子结构示意图
(3)由元素①和⑥形成的一种物质是天然气的主要成分,其电子式为
(4)元素③、⑧、⑨的简单离子中半径最大是
(5)表中元素⑨和⑩的气态氢化物中更稳定的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
Ⅰ.(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①基态Ni2+的核外电子排布式为_________________ 。
②在[Ni(NH3)6]2+中存在的化学键有( )
A.离子键 B.共价键 C.配位键 D. 氢键 E.σ键 F.π键
Ⅱ.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子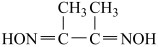 中C原子轨道杂类型为
中C原子轨道杂类型为________________ ,1mol丁二酮肟分子所含σ键的数目为_____________ 。
(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
① [Ni(CO)4]固态时属于________ 晶体(填晶体类型)。
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为_____________ (用“→”表示出配位键) 。
Ⅰ.(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①基态Ni2+的核外电子排布式为
②在[Ni(NH3)6]2+中存在的化学键有
A.离子键 B.共价键 C.配位键 D. 氢键 E.σ键 F.π键
Ⅱ.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子
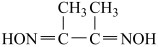 中C原子轨道杂类型为
中C原子轨道杂类型为(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
① [Ni(CO)4]固态时属于
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】第四周期的Cr、Fe、Co、Ni、Cu等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域, 和
和 是常见的配体,请回答下列问题:
是常见的配体,请回答下列问题:
(1) 的核外电子排布式为
的核外电子排布式为_______ 。
(2)基态N原子核外有_______ 种不同运动状态的电子。
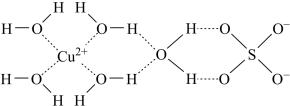
(3)通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为_______ 。
(4)As的卤化物的熔点如下:
依据表中各卤化物的熔点,可推测它们均属于_______ 晶体,这三种物质熔点差异性变化的原因是_______ 。
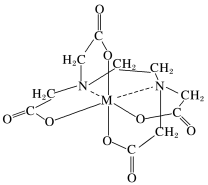
(5)向 溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表
溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表 ,配合物A中
,配合物A中 提供的是
提供的是_______ ,配合物A中第一电离能最大的非金属元素原子是_______ (写元素符号)。
 和
和 是常见的配体,请回答下列问题:
是常见的配体,请回答下列问题:(1)
 的核外电子排布式为
的核外电子排布式为(2)基态N原子核外有
(3)通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为

(4)As的卤化物的熔点如下:
| 物质 |  | 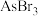 | 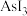 |
| 熔点/K | 256.8 | 304 | 413 |
(5)向
 溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表
溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表 ,配合物A中
,配合物A中 提供的是
提供的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】请回答:
(1)氨遇氯化氢时会产生白烟,写出白烟化学成分的电子式:___________ 。
(2)氨的催化氧化是工业制硝酸的基础,写出化学方程式___________ 。
(3)写出铝和NaOH溶液反应的离子方程式___________ 。
(4)工业上可用氨水吸收燃煤烟气中少量的SO2,写出离子方程式___________ 。
(5)氯气与二氧化硫混合后通入某有色溶液,漂白能力减弱的原因___________ (用离子方程式说明) 。
(6)肼( )的结构式为
)的结构式为___________
(7)已知298K时,正丁烷、异丁烷完全燃烧的热化学方程式分别为:
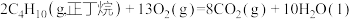
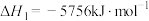
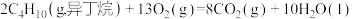

则该温度下,正丁烷转化为异丁烷的热化学方程式为___________ 。
(8)稀溶液中,1molH2SO4与NaOH完全反应时,放出114.6kJ热量,写出表示中和热的热化学方程式___________ 。
(9)Ti基态的电子排布式为___________ 。
(10)l配合物[TiCl(H2O)5]Cl2·H2O。1mol该配合物中含有δ键的数目为___________ 。
(1)氨遇氯化氢时会产生白烟,写出白烟化学成分的电子式:
(2)氨的催化氧化是工业制硝酸的基础,写出化学方程式
(3)写出铝和NaOH溶液反应的离子方程式
(4)工业上可用氨水吸收燃煤烟气中少量的SO2,写出离子方程式
(5)氯气与二氧化硫混合后通入某有色溶液,漂白能力减弱的原因
(6)肼(
 )的结构式为
)的结构式为(7)已知298K时,正丁烷、异丁烷完全燃烧的热化学方程式分别为:
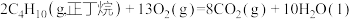
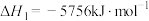
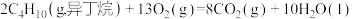

则该温度下,正丁烷转化为异丁烷的热化学方程式为
(8)稀溶液中,1molH2SO4与NaOH完全反应时,放出114.6kJ热量,写出表示中和热的热化学方程式
(9)Ti基态的电子排布式为
(10)l配合物[TiCl(H2O)5]Cl2·H2O。1mol该配合物中含有δ键的数目为
您最近一年使用:0次



