X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示:
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X单质分子的结构式是___________ ,Z元素原子最外层共有_____ 种不同运动状态的电子。
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是___________ 。
(3)常温时,W的硫酸盐溶液的pH_______ 7(填“=”、“>”或“<”),理由是:__________________________ (用离子方程式表示)。
(4)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式________________ 。
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X单质分子的结构式是
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是
(3)常温时,W的硫酸盐溶液的pH
(4)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式
11-12高三·上海·阶段练习 查看更多[1]
(已下线)2012届上海市十校高三第二次联考化学试卷
更新时间:2019-01-30 18:14:09
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) ΔH=+84kJ⋅mol−1,
2H2(g)+O2(g)═2H2O(g)ΔH=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:____________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)⇌CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
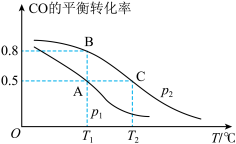
①A,B两点对应的压强大小关系是PA________ PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________ (填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________ (填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2:0.2mol, CH3OH:0.2mol。此时v正________ v逆(填> 、 < 或 =)。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) ΔH=+84kJ⋅mol−1,
2H2(g)+O2(g)═2H2O(g)ΔH=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)⇌CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。

①A,B两点对应的压强大小关系是PA
②下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2:0.2mol, CH3OH:0.2mol。此时v正
您最近一年使用:0次
【推荐2】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。回答下列问题:
(1)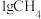 完全燃烧生成
完全燃烧生成 气体和液态水时放出
气体和液态水时放出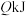 热量,则甲烷燃烧的热化学方程式为
热量,则甲烷燃烧的热化学方程式为___________ 。
(2)工业上常用 与水蒸气在一定条件下反应来制取
与水蒸气在一定条件下反应来制取 ,其原理为
,其原理为 。
。
①一定温度时,在一个体积为 的恒容密闭容器中,加入
的恒容密闭容器中,加入 和
和 水蒸气发生上述反应,
水蒸气发生上述反应, 后达平衡,生成
后达平衡,生成 ,用
,用 表示该反应的速率为
表示该反应的速率为___________ ;该温度下此反应的平衡常数为___________ (结果保留到小数点后三位)。
②保持恒温恒容时,下列各项中,能说明该反应已达到平衡状态的有___________ (填标号)。
A.容器内气体的压强不再发生变化
B.生成 的同时消耗
的同时消耗
C.混合气体的平均摩尔质量不再发生变化
D.体系的密度不再发生变化
(3)在一定条件下甲烷也可用于燃料电池。若以 溶液为电解质溶液,甲烷燃料电池正极的电极反应式为
溶液为电解质溶液,甲烷燃料电池正极的电极反应式为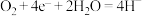 ,则负极电极反应式为
,则负极电极反应式为___________ ;该电池工作过程中,溶液中 移向
移向___________ 极。
(1)
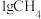 完全燃烧生成
完全燃烧生成 气体和液态水时放出
气体和液态水时放出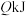 热量,则甲烷燃烧的热化学方程式为
热量,则甲烷燃烧的热化学方程式为(2)工业上常用
 与水蒸气在一定条件下反应来制取
与水蒸气在一定条件下反应来制取 ,其原理为
,其原理为 。
。①一定温度时,在一个体积为
 的恒容密闭容器中,加入
的恒容密闭容器中,加入 和
和 水蒸气发生上述反应,
水蒸气发生上述反应, 后达平衡,生成
后达平衡,生成 ,用
,用 表示该反应的速率为
表示该反应的速率为②保持恒温恒容时,下列各项中,能说明该反应已达到平衡状态的有
A.容器内气体的压强不再发生变化
B.生成
 的同时消耗
的同时消耗
C.混合气体的平均摩尔质量不再发生变化
D.体系的密度不再发生变化
(3)在一定条件下甲烷也可用于燃料电池。若以
 溶液为电解质溶液,甲烷燃料电池正极的电极反应式为
溶液为电解质溶液,甲烷燃料电池正极的电极反应式为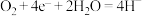 ,则负极电极反应式为
,则负极电极反应式为 移向
移向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】455°C下,向某2L密闭容器中通入1mol HI发生反应2HI(g)  H2(g)+I2(g), ∆H >0, 反应在2min时达到平衡,已知该温度下,反应H2(g)+I2(g)
H2(g)+I2(g), ∆H >0, 反应在2min时达到平衡,已知该温度下,反应H2(g)+I2(g)  2HI(g)的平衡常数为49。
2HI(g)的平衡常数为49。
(1)该温度下反应2HI(g) H2(g)+I2(g)的平衡常数为
H2(g)+I2(g)的平衡常数为______
(2)0-2min 中内以HI表示的反应速率为______ (用3位小数表示)
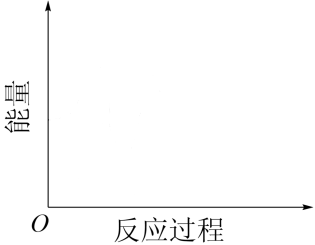
(3)反应实际分为两步:反应①2HI→H2+2I·,反应②2I·→I2。已知反应①吸热,反应②放热,且总反应速率由反应①决定,请在图中画出反应的反应进程一能量图______ 。
(4)下列关于该反应的说法中不正确的是
(5)25°C时,1molHI 完全分解为H2和I2时,放出26.5kJ热量,写出该温度下分解HI分解反应的热化学方程式_______ 。
 H2(g)+I2(g), ∆H >0, 反应在2min时达到平衡,已知该温度下,反应H2(g)+I2(g)
H2(g)+I2(g), ∆H >0, 反应在2min时达到平衡,已知该温度下,反应H2(g)+I2(g)  2HI(g)的平衡常数为49。
2HI(g)的平衡常数为49。(1)该温度下反应2HI(g)
 H2(g)+I2(g)的平衡常数为
H2(g)+I2(g)的平衡常数为(2)0-2min 中内以HI表示的反应速率为
(3)反应实际分为两步:反应①2HI→H2+2I·,反应②2I·→I2。已知反应①吸热,反应②放热,且总反应速率由反应①决定,请在图中画出反应的反应进程一能量图

(4)下列关于该反应的说法中不正确的是
| A.升高温度,活化分子百分数增加,反应速率增大 |
| B.活化分子的碰撞都是有效碰撞 |
| C.使用合适的催化剂,可以增大反应速率和HI的平衡转化率 |
| D.恒温恒容下达平衡后,再充入少量HI,达新平衡后,HI的总转化率不变 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5 ℃,易水解。某学习小组在实验室中用下图所示装置制备ClNO。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3+HNO2。
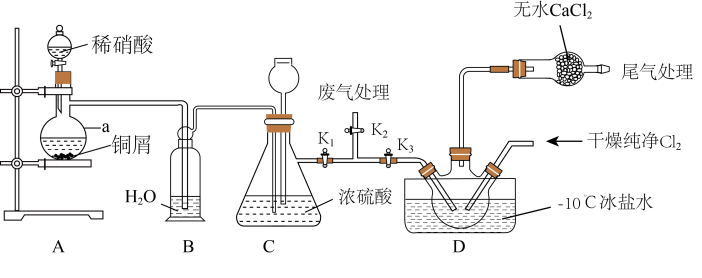
请回答下列问题:
(1)仪器a的名称为________ ,装置B的作用是________ 。
(2)装置A中发生反应的化学方程式为________ 。
(3)装置C中长颈漏斗的作用是________ 。
(4)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________ 时关闭K1、K2。向装置D三颈瓶中通入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO。
(5)装置D中干燥管的作用是________ 。
(6)ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:________ (仅提供的试剂:1 mol·L-1盐酸、1 mol·L-1 HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②要验证ClNO与 H2O 反应后的溶液中存在Cl-和HNO2,合理的操作步骤及正确的顺序是________ (填字母代号)。
a.向烧杯中滴加过量KI淀粉溶液,溶液变蓝色
b.取1.0 mL ClNO加入到盛有10.0 mL H2O的烧杯中,充分反应
c.向烧杯中滴加酸性KMnO4溶液,溶液紫红色褪去
d.向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀

请回答下列问题:
(1)仪器a的名称为
(2)装置A中发生反应的化学方程式为
(3)装置C中长颈漏斗的作用是
(4)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中
(5)装置D中干燥管的作用是
(6)ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:
②要验证ClNO与 H2O 反应后的溶液中存在Cl-和HNO2,合理的操作步骤及正确的顺序是
a.向烧杯中滴加过量KI淀粉溶液,溶液变蓝色
b.取1.0 mL ClNO加入到盛有10.0 mL H2O的烧杯中,充分反应
c.向烧杯中滴加酸性KMnO4溶液,溶液紫红色褪去
d.向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
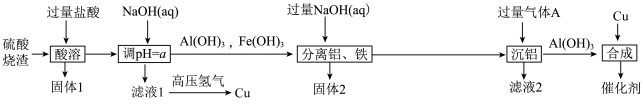
【推荐2】研究发现,Cu/Al(OH)3催化剂在工业上有着巨大作用。现以硫酸烧渣(主要成分为Fe2O3、Al2O3、CuO和SiO2等)为原料制备Cu/ Al(OH)3催化剂,流程如图所示:
已知常温下,①几种金属离子沉淀的pH如表所示:
②电离常数 H2CO3 Ka1=4.4×10-7 Ka2=4.7×10-11
③A为无色无味气体
回答下列问题:
(1)举一个“固体1”的用途___________ ,“固体2”灼烧产物是___________ (填名称),“分离铝、铁”的操作名称为___________ 。
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度不能太高,其原因是___________ 。
(3)a的范围为___________ , “滤液1”中通入高压氢制备铜的离子方程式为___________ 。
(4)“沉铝”的离子方程式为___________ ,“滤液2”的pH___________ 7(25℃) (填“>”“<”或“=”),判断依据是___________ 。
(5)合成催化剂 ,测定Cu与Al(OH)3的比例:将制得的“催化剂Cu/Al(OH)3”在空气中充分灼烧为CuO和Al2O3,固体质量不改变,则催化剂中n(Cu) : n[Al(OH)3]=___________ 。

已知常温下,①几种金属离子沉淀的pH如表所示:
| 金属离子 | Fe3+ | Al3+ | Cu2+ |
| 开始沉淀pH | 1.9 | 3.4 | 7.4 |
| 完全沉淀pH | 3.7 | 4.7 | 9.6 |
③A为无色无味气体
回答下列问题:
(1)举一个“固体1”的用途
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度不能太高,其原因是
(3)a的范围为
(4)“沉铝”的离子方程式为
(5)合成催化剂 ,测定Cu与Al(OH)3的比例:将制得的“催化剂Cu/Al(OH)3”在空气中充分灼烧为CuO和Al2O3,固体质量不改变,则催化剂中n(Cu) : n[Al(OH)3]=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】利用如图装置进行Zn与稀H2SO4反应实验,探究硫酸铜的量、反应温度对氢气生成速率的影响。

在蒸馏烧瓶中加入30 mL 0.3 mol·L-1稀硫酸,再通过注射器注入一定体积的1.0 mol·L-1硫酸铜溶液和蒸馏水,插入锌片,用秒表记录产生20.0 mL气体所需的时间。实验数据如表所示。
回答下列问题:
(1)V1=_______ ,V3_______ 。
(2)tA>tB,原因是_______ ,tB>tC的原因是_______ 。
(3)tF>tE,原因是_______ 。
(4)测定实验B反应后剩余溶液中硫酸的物质的量浓度。
①准确量取10.00 mL该剩余液注入锥形瓶中,滴加_______ 作指示剂。(填标号)
A.甲基橙 B.石蕊 C.酚酞
②用0.2000 mol·L-I标准NaOH溶液滴定。重复实验,得到下列实验数据,计算剩余溶液中硫酸的物质的量浓度为_______ mol·L-1。

在蒸馏烧瓶中加入30 mL 0.3 mol·L-1稀硫酸,再通过注射器注入一定体积的1.0 mol·L-1硫酸铜溶液和蒸馏水,插入锌片,用秒表记录产生20.0 mL气体所需的时间。实验数据如表所示。
| 实验序号 | A | B | C | D | E | F |
| 温度/℃ | 25 | 25 | 35 | 25 | 25 | 25 |
| CuSO4溶液体积/mL | 0 | 1 | 1 | 2 | V4 | 20 |
| 蒸馏水体积/mL | 20 | V1 | V2 | V3 | 16 | 0 |
| 所需时间 | tA | tB | tC | tD | tE | tF |
(1)V1=
(2)tA>tB,原因是
(3)tF>tE,原因是
(4)测定实验B反应后剩余溶液中硫酸的物质的量浓度。
①准确量取10.00 mL该剩余液注入锥形瓶中,滴加
A.甲基橙 B.石蕊 C.酚酞
②用0.2000 mol·L-I标准NaOH溶液滴定。重复实验,得到下列实验数据,计算剩余溶液中硫酸的物质的量浓度为
| 滴定次数 | 待测液体积/mL | 标准NaOH溶液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 10.00 | 0.50 | 16.88 |
| 第二次 | 10.00 | 1.00 | 17.34 |
| 第三次 | 10.00 | 0.50 | 18.10 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】阅读下表中短周期主族元素的相关信息。
(1) E在元素周期表中的位置是_____________________ 。
(2) X的化学式为____________________
(3) A、B、C三种元素形成的简单离子半径由大到小的顺序为________________ (用离子符号表示)。
(4)A的单质在真空高压下能与由元素D、E组成的化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式:____________ 。
| 元素 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的3倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(2) X的化学式为
(3) A、B、C三种元素形成的简单离子半径由大到小的顺序为
(4)A的单质在真空高压下能与由元素D、E组成的化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】元素X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,其原子半径和最外层电子数之间的关系如图所示。
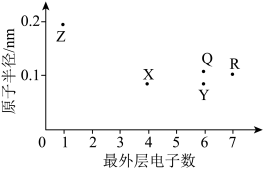
(1)Q离子的结构示意图是_______ 。
(2)R元素在周期表中位于第_______ 周期_______ 族;关于R所在主族的单质及化合物的叙述错误的是_______ (填字母)。
A.从上到下,单质颜色越来越深,熔、沸点越来越高
B.单质均可与水发生反应生成两种酸
C.单质均具有强氧化性,能将 氧化至
氧化至
D.氢化物均易溶于水,且均为强酸
(3)X、Q、R三种元素的最高价氧化物对应的水化物酸性由强到弱的顺序是_______ (填化学式)。
(4)Z与R可以形成_______ (填“共价”或“离子”)化合物,用电子式表示其形成过程为_______ 。
(5)Y与Q非金属性较强的是_______ (填元素符号),请从原子结构的角度解释原因:_______ 。

(1)Q离子的结构示意图是
(2)R元素在周期表中位于第
A.从上到下,单质颜色越来越深,熔、沸点越来越高
B.单质均可与水发生反应生成两种酸
C.单质均具有强氧化性,能将
 氧化至
氧化至
D.氢化物均易溶于水,且均为强酸
(3)X、Q、R三种元素的最高价氧化物对应的水化物酸性由强到弱的顺序是
(4)Z与R可以形成
(5)Y与Q非金属性较强的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
(1)R的元素符号为________ ; M在元素周期表中的位置为________________ 。
(2)X与M按原子个数比1∶1构成的物质为______________ 。
(3)X+、 Y2-、M2-离子半径大小顺序为____________________________________ 。
(4)将YM2通入FeCl3溶液中的离子方程式:_________________________________
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为
(2)X与M按原子个数比1∶1构成的物质为
(3)X+、 Y2-、M2-离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】 、
、 、
、 、
、 四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。
四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。 元素没有正化合价;
元素没有正化合价; 的氢化物的分子式为
的氢化物的分子式为 ,
,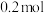 的
的 的单质能从足量酸溶液中置换出
的单质能从足量酸溶液中置换出 (标准状况);
(标准状况); 的原子核中没有中子。
的原子核中没有中子。
(1)根据以上条件,推断 、
、 、
、 、
、 的元素名称。
的元素名称。
A________ ,B ________ ,C ________ ,D ________ 。
(2)用电子式表示 与
与 、
、 与
与 、
、 与
与 相互结合成的化合物,指出其化合物的类型及所含化学键类型。
相互结合成的化合物,指出其化合物的类型及所含化学键类型。
(3)写出 与
与 所形成的化合物和
所形成的化合物和 与
与 所形成的化合物反应的离子方程式:
所形成的化合物反应的离子方程式:_______ 。
 、
、 、
、 、
、 四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。
四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。 元素没有正化合价;
元素没有正化合价; 的氢化物的分子式为
的氢化物的分子式为 ,
,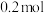 的
的 的单质能从足量酸溶液中置换出
的单质能从足量酸溶液中置换出 (标准状况);
(标准状况); 的原子核中没有中子。
的原子核中没有中子。(1)根据以上条件,推断
 、
、 、
、 、
、 的元素名称。
的元素名称。A
(2)用电子式表示
 与
与 、
、 与
与 、
、 与
与 相互结合成的化合物,指出其化合物的类型及所含化学键类型。
相互结合成的化合物,指出其化合物的类型及所含化学键类型。| 化合物 | 电子式 | 化合物类型 | 化学键类型 |
 | |||
 | |||
B+D |
(3)写出
 与
与 所形成的化合物和
所形成的化合物和 与
与 所形成的化合物反应的离子方程式:
所形成的化合物反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。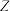 原子的最外层电子数是次外层电子数的3倍,试推断:
原子的最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号: X__________ 、Z__________ 。
(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物的电子式为__________ ;含有离子键和非极性共价键的化合物的电子式为__________ ;含有极性共价键和非极性共价键的化合物的电子式为_______ 。
(3)由X、Y、Z所形成的常见离子化合物是__________ (写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为__________ 。
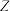 原子的最外层电子数是次外层电子数的3倍,试推断:
原子的最外层电子数是次外层电子数的3倍,试推断:(1)X、Z两种元素的元素符号: X
(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物的电子式为
(3)由X、Y、Z所形成的常见离子化合物是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
真题
解题方法
【推荐3】主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为_________ ,W3分子的空间构型为_________ ;
(2)X单质与水发生主要反应的化学方程式为____________________________ ;
(3)化合物M的化学式为________ ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是________ 。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有_________ ,O—C—O的键角约为_________ ;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z=_________ ;
(5)含有元素Z的盐的焰色反应为_________ 色。许多金属盐都可以发生焰色反应,其原因是________________________________________________________ 。
(1)W元素原子的L层电子排布式为
(2)X单质与水发生主要反应的化学方程式为
(3)化合物M的化学式为
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z=
(5)含有元素Z的盐的焰色反应为
您最近一年使用:0次



