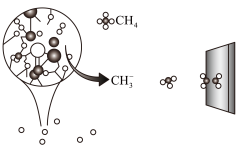
中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成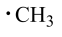 、
、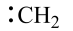 、
、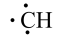 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
(1)已知相关物质的燃烧热如表所示,写出甲烷制备乙烯的热化学方程式__________ 。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是__________ (填结构简式)
(3)在400℃时,向初始体积为1L的恒压密闭反应器中充入1molCH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:
①在该温度下,其平衡常数KC=__________ 。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率__________ 。(填“增大”“减小”“不变”或“无法确定”),理由是__________ 。
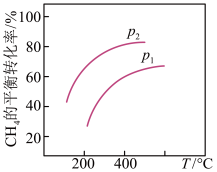
③若反应器的体积固定,不同压强下可得变化如图所示,则压强p1与p2的大小关系是__________ 。
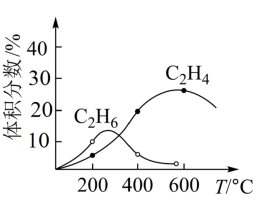
(4)实际制备C2H4时,通常存在副反应2CH4(g) C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是
C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是__________ 。
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式__________ 。
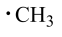 、
、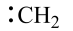 、
、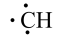 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
| 物质 | 燃烧热/(kJ·mol-1) |
| 氢气 | 285.8 |
| 甲烷 | 890.3 |
| 乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如表所示,写出甲烷制备乙烯的热化学方程式
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是
(3)在400℃时,向初始体积为1L的恒压密闭反应器中充入1molCH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:
①在该温度下,其平衡常数KC=
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率
③若反应器的体积固定,不同压强下可得变化如图所示,则压强p1与p2的大小关系是

(4)实际制备C2H4时,通常存在副反应2CH4(g)
 C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是
C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式
更新时间:2020-06-24 16:46:24
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】我国明确提出2030年“碳达峰”与2060年“碳中和”目标,“碳中和”对我国意味着:一是能源转型首当其冲;二是通过工艺改造、节能等措施减少二氧化碳的排放在能源的产生、转换、消费过程。减少二氧化碳排放的方法之一是将CO2催化还原,比如:
反应1: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
反应2: CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
都是目前处理CO2的重要方法。回答下列问题:
(1)反应1在_______ 的条件下能自发发生。(填低温、高温、任意温度)
(2)已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1
②H2O(1)=H2O(g) ΔH3=44.0 kJ·mol-1,
则 ΔH2=_______ kJ·mol-1。
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1达到平衡,下列有关叙述正确的是_______。
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1达到平衡,下列有关叙述正确的是_______。
(4)一定条件下,在1L密闭容器中加入2molCO2和2molH2只发生反应2: CO2(g)+H2(g)  CO(g)+H2O(g),如图是随着反应的进行,CO2的浓度随时间改变的变化图。若在t1时刻再加入lmolCO2, t2时刻到达新的平衡。
CO(g)+H2O(g),如图是随着反应的进行,CO2的浓度随时间改变的变化图。若在t1时刻再加入lmolCO2, t2时刻到达新的平衡。
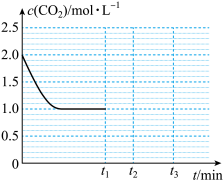
请你画出t1~t3内时刻CO2的物质的量浓度随时间改变的变化图:______
反应1: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1反应2: CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2都是目前处理CO2的重要方法。回答下列问题:
(1)反应1在
(2)已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1
②H2O(1)=H2O(g) ΔH3=44.0 kJ·mol-1,
则 ΔH2=
(3)恒温恒容的密闭容器中,投入物质的量之比为1:3的CO2和H2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1达到平衡,下列有关叙述正确的是_______。
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1达到平衡,下列有关叙述正确的是_______。| A.升高温度,逆反应速率增加,平衡常数减小 |
| B.再加入一定量的CO2和H2, CO2和H2的转化率不可能同时都增大 |
| C.加入合适的催化剂可以提高CO2的平衡转化率 |
| D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量 |
 CO(g)+H2O(g),如图是随着反应的进行,CO2的浓度随时间改变的变化图。若在t1时刻再加入lmolCO2, t2时刻到达新的平衡。
CO(g)+H2O(g),如图是随着反应的进行,CO2的浓度随时间改变的变化图。若在t1时刻再加入lmolCO2, t2时刻到达新的平衡。
请你画出t1~t3内时刻CO2的物质的量浓度随时间改变的变化图:
您最近一年使用:0次
【推荐2】维持大气中CO2的平衡对生态环境保护有着重要意义。
(1)CO2催化加氢合成低碳烯烃技术能有效利用大气中的CO2。
以合成C2H4为例,该转化分为两步进行:
第一步:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1= +41.3kJ/mol
第二步:2CO(g)+4H2(g)⇌C2H4(g)+2H2O(g) ΔH2= -210.5kJ/mol
CO2加氢合成乙烯的热化学方程式为________ 。
(2)CO2催化加氢在一定条件下还可以合成CH4。已知反应CO2(g) +4H2(g)⇌CH4(g) + 2H2O(g)。在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。

①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=________ MPa‑2。(Kp 是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×物质的量分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有________ (填字母)。
A.通入惰性气体 B.提高温度 C.增加二氧化碳浓度 D.增加氢气浓度
(3)利用铜基配合物l,10-phenanthroline -Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
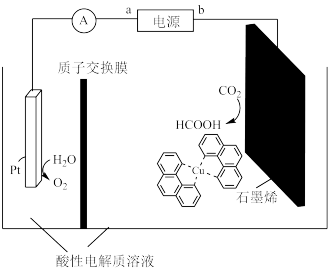
电池工作过程中,图中Pt电极附近溶液的pH________ (填 “变大”或“变小”),阴极的电极反应式为________ ,每转移2mol电子,阴极室溶液质量增加________ g。
(1)CO2催化加氢合成低碳烯烃技术能有效利用大气中的CO2。
以合成C2H4为例,该转化分为两步进行:
第一步:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1= +41.3kJ/mol
第二步:2CO(g)+4H2(g)⇌C2H4(g)+2H2O(g) ΔH2= -210.5kJ/mol
CO2加氢合成乙烯的热化学方程式为
(2)CO2催化加氢在一定条件下还可以合成CH4。已知反应CO2(g) +4H2(g)⇌CH4(g) + 2H2O(g)。在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。

①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=
②欲增加二氧化碳的平衡转化率,可采取的措施有
A.通入惰性气体 B.提高温度 C.增加二氧化碳浓度 D.增加氢气浓度
(3)利用铜基配合物l,10-phenanthroline -Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之一,其装置原理如图所示。

电池工作过程中,图中Pt电极附近溶液的pH
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】煤和石油通常都含有硫的化合物,燃烧生成的二氧化硫为大气主要污染物之一、二氧化硫的治理已成为当前研究的课题。硫与硫的氧化物在转化过程中的能量变化如图所示。

已知: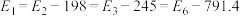 。
。
回答下列问题:
(1)图中的I、II、III、IV中属于放热反应的是_______ 。
(2)写出表示 的燃烧热的热化学方程式:
的燃烧热的热化学方程式:_______ 。
(3)从图中可看出将 氧化成
氧化成 有两条途径:①
有两条途径:① 经过程III、过程IV转化成
经过程III、过程IV转化成 ;②
;② 经过程II转化成
经过程II转化成 。这两种途径相比,①改变的条件是
。这两种途径相比,①改变的条件是_______ ,改变该条件主要是降低了_______ 。已知过程IV的化学方程式为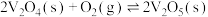 ,则过程III的热化学方程式为
,则过程III的热化学方程式为_______ 。
(4)9.6gS和16g 在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为
在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为_______ (保留两位有效数字)。
(5)工业上常用NaOH溶液吸收 ,若将0.4mol
,若将0.4mol 通入500mL
通入500mL NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol
NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol 通入足量的NaOH溶液中充分反应放出y kJ热量。则
通入足量的NaOH溶液中充分反应放出y kJ热量。则 和NaOH溶液反应生成
和NaOH溶液反应生成 的热化学反应方程式为
的热化学反应方程式为_______ 。

已知:
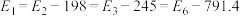 。
。回答下列问题:
(1)图中的I、II、III、IV中属于放热反应的是
(2)写出表示
 的燃烧热的热化学方程式:
的燃烧热的热化学方程式:(3)从图中可看出将
 氧化成
氧化成 有两条途径:①
有两条途径:① 经过程III、过程IV转化成
经过程III、过程IV转化成 ;②
;② 经过程II转化成
经过程II转化成 。这两种途径相比,①改变的条件是
。这两种途径相比,①改变的条件是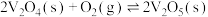 ,则过程III的热化学方程式为
,则过程III的热化学方程式为(4)9.6gS和16g
 在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为
在一定条件下连续发生过程I和过程II的反应,充分反应后无固体剩余,测得放出的热量为109.8kJ。则反应后的体系中各组分的物质的量分别为(5)工业上常用NaOH溶液吸收
 ,若将0.4mol
,若将0.4mol 通入500mL
通入500mL NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol
NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1mol 通入足量的NaOH溶液中充分反应放出y kJ热量。则
通入足量的NaOH溶液中充分反应放出y kJ热量。则 和NaOH溶液反应生成
和NaOH溶液反应生成 的热化学反应方程式为
的热化学反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
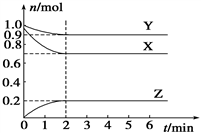
(1)该反应的化学方程式为_______________ ;
(2)反应开始至2 min,气体Z的反应速率为_________ ;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________ 倍;
②若此时将容器的体积缩小为原来的 0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为______ 反应(填“放热”或“吸热”)。
(4)若X为固体、Y、Z为气体,则该反应的平衡常数表达式为__________________ 。

(1)该反应的化学方程式为
(2)反应开始至2 min,气体Z的反应速率为
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的
②若此时将容器的体积缩小为原来的 0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为
(4)若X为固体、Y、Z为气体,则该反应的平衡常数表达式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】甲醇是基本有机原料之一,可用于燃料电池、制取 等有机产品。
等有机产品。
(1)一种“直接甲醇燃料电池”结构如图所示,电解质为强酸溶液,该燃料电池正极的电极反应式为___________ 。

(2)水煤气法制取甲醇的反应其反应的焓变、平衡常数如下:
 平衡常数K1
平衡常数K1
CO(g)+2H2(g) CH3OH(g) ΔH2=-90.1kJ/mol 平衡常数K2
CH3OH(g) ΔH2=-90.1kJ/mol 平衡常数K2
2CH4(g)+O2(g) CH3OH(g) ΔH3平衡常数K3
CH3OH(g) ΔH3平衡常数K3
则相同温度下K3=___________ (用含K1代数式表示)。
(3)二氧化碳加氢也可合成甲醇[CO2(g) + 3H2(g) CH3OH(g) + H2O(g)],在10.0L的密闭容器中投入
CH3OH(g) + H2O(g)],在10.0L的密闭容器中投入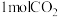 和
和 ,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如图所示。
,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如图所示。

①图中二氧化碳合成甲醇正反应为___________ 反应(选填:“放热”或“吸热”)。
②图中压强P1___________ P2 (选填:“>”或“<”)。
③在图中“M”点,平衡常数K=___________ (填数值,保留2位小数)。
(4)甲醇与醇ROH在浓硫酸及加热条件下可制备汽油抗爆震剂MTBE,反应原理为:CH3OH+ROH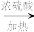 CH3OR+H2O
CH3OR+H2O
已知MTBE的分子式为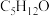 ,其核磁共振氢谱如图所示。
,其核磁共振氢谱如图所示。

①ROH的结构简式为___________ 。
②写出制备MTBE的化学方程式:___________ 。
 等有机产品。
等有机产品。(1)一种“直接甲醇燃料电池”结构如图所示,电解质为强酸溶液,该燃料电池正极的电极反应式为

(2)水煤气法制取甲醇的反应其反应的焓变、平衡常数如下:
 平衡常数K1
平衡常数K1CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.1kJ/mol 平衡常数K2
CH3OH(g) ΔH2=-90.1kJ/mol 平衡常数K22CH4(g)+O2(g)
 CH3OH(g) ΔH3平衡常数K3
CH3OH(g) ΔH3平衡常数K3则相同温度下K3=
(3)二氧化碳加氢也可合成甲醇[CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)],在10.0L的密闭容器中投入
CH3OH(g) + H2O(g)],在10.0L的密闭容器中投入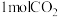 和
和 ,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如图所示。
,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如图所示。
①图中二氧化碳合成甲醇正反应为
②图中压强P1
③在图中“M”点,平衡常数K=
(4)甲醇与醇ROH在浓硫酸及加热条件下可制备汽油抗爆震剂MTBE,反应原理为:CH3OH+ROH
 CH3OR+H2O
CH3OR+H2O已知MTBE的分子式为
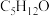 ,其核磁共振氢谱如图所示。
,其核磁共振氢谱如图所示。
①ROH的结构简式为
②写出制备MTBE的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】某些有机物在氧载体Fe2O3的作用下部分氧化,反应混合气可制备合成气(CO、H2)。反应体系中主要反应有:
反应ⅰ CO(g)+3H2(g) CH4(g)+H2O(g) ΔH1=-205.9 kJ·mol-1
CH4(g)+H2O(g) ΔH1=-205.9 kJ·mol-1
反应ⅱ CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH2=-164.7 kJ·mol-1
CH4(g)+2H2O(g) ΔH2=-164.7 kJ·mol-1
反应ⅲ CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH3=+247.1 kJ·mol-1
2CO(g)+2H2(g) ΔH3=+247.1 kJ·mol-1
反应ⅳ CO2(g)+H2(g) CO(g)+H2O(g) ΔH4
CO(g)+H2O(g) ΔH4
请回答:
(1)H表示25 ℃,101 kPa下的焓。则H(CO2)+H(H2)________ H(H2O)+H(CO)(填“大于”、“小于”或“等于”)。
(2)反应ⅲ的平衡常数Kx(ⅲ)=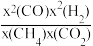 [x(B)表示组分B平衡时的摩尔分数]。其他条件不变,会导致反应ⅲKx减小的条件是
[x(B)表示组分B平衡时的摩尔分数]。其他条件不变,会导致反应ⅲKx减小的条件是________ 。
A.升温 B.降温 C.加压 D.减压 E.恒容容器中再通入一定量H2(g)
(3)T ℃下,测定上述所有反应达平衡时的体系中,反应ⅳ的平衡常数Kx(ⅳ)=1.00,x(CO2)=x(H2O)、x(H2)=a、x(CH4)=b,忽略其他反应。则反应ⅲ的平衡常数Kx(ⅲ)=_______________________ (用含a、b的最简式子表示)。
反应ⅰ CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH1=-205.9 kJ·mol-1
CH4(g)+H2O(g) ΔH1=-205.9 kJ·mol-1反应ⅱ CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH2=-164.7 kJ·mol-1
CH4(g)+2H2O(g) ΔH2=-164.7 kJ·mol-1反应ⅲ CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH3=+247.1 kJ·mol-1
2CO(g)+2H2(g) ΔH3=+247.1 kJ·mol-1反应ⅳ CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH4
CO(g)+H2O(g) ΔH4请回答:
(1)H表示25 ℃,101 kPa下的焓。则H(CO2)+H(H2)
(2)反应ⅲ的平衡常数Kx(ⅲ)=
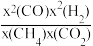 [x(B)表示组分B平衡时的摩尔分数]。其他条件不变,会导致反应ⅲKx减小的条件是
[x(B)表示组分B平衡时的摩尔分数]。其他条件不变,会导致反应ⅲKx减小的条件是A.升温 B.降温 C.加压 D.减压 E.恒容容器中再通入一定量H2(g)
(3)T ℃下,测定上述所有反应达平衡时的体系中,反应ⅳ的平衡常数Kx(ⅳ)=1.00,x(CO2)=x(H2O)、x(H2)=a、x(CH4)=b,忽略其他反应。则反应ⅲ的平衡常数Kx(ⅲ)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳的碳捕捉和碳利用技术则是关键。
(1)在恒容密闭容器中通入 与
与 ,使其物质的量浓度均为1.0mol/L,在一定条件下发生反应:
,使其物质的量浓度均为1.0mol/L,在一定条件下发生反应: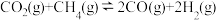 ,测得
,测得 的平衡转化率与温度及压强的关系如图所示。
的平衡转化率与温度及压强的关系如图所示。
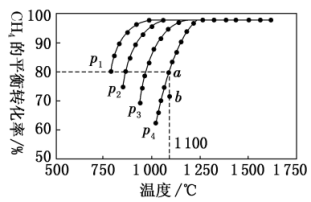
①该反应的
___________ 0(填“ ”或“
”或“ ”或“
”或“ ”)。
”)。
②压强p1、p2、p3、p4由大到小的关系为___________ 。
③压强为p4时,在b点: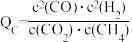
__________ Kc(填“ ”或“
”或“ ”或“
”或“ ”)。
”)。
(2) 的催化加氢同时发生以下反应,如
的催化加氢同时发生以下反应,如
i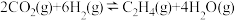
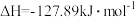
ii.
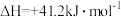
不同压强下 的平衡转化率与温度的关系如下图:
的平衡转化率与温度的关系如下图:
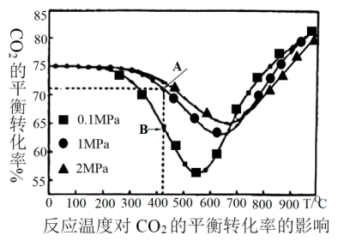
①400~600℃, 的平衡转化率随着压强的升高而增大,B点v正
的平衡转化率随着压强的升高而增大,B点v正_________ A点v逆 (填“>”或“<”或“=”)。
②根据图象可知,其他条件相同时,下列反应条件控制中能获得乙烯最多的是___________ (填序号)。
A.压强0.1MPa 温度800℃ B.压强4.0MPa 温度300℃
C.压强0.1MPa 温度300℃ D.压强4.0MPa 温度800℃
③在恒定压强下,随着温度的升高, 的平衡转化率先降低后升高。试分析可能原因
的平衡转化率先降低后升高。试分析可能原因___________ 。
④一定条件下,将 和CO2[
和CO2[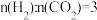 ]在某催化剂作用下,当总压稳定在p时,测得
]在某催化剂作用下,当总压稳定在p时,测得 和CO的物质的量之比为2:1,
和CO的物质的量之比为2:1, 的转化率为50.0%。则反应i的化学平衡常数Kp=
的转化率为50.0%。则反应i的化学平衡常数Kp=___________ (只列算式不计算)。
(1)在恒容密闭容器中通入
 与
与 ,使其物质的量浓度均为1.0mol/L,在一定条件下发生反应:
,使其物质的量浓度均为1.0mol/L,在一定条件下发生反应: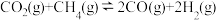 ,测得
,测得 的平衡转化率与温度及压强的关系如图所示。
的平衡转化率与温度及压强的关系如图所示。
①该反应的

 ”或“
”或“ ”或“
”或“ ”)。
”)。②压强p1、p2、p3、p4由大到小的关系为
③压强为p4时,在b点:
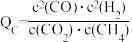
 ”或“
”或“ ”或“
”或“ ”)。
”)。(2)
 的催化加氢同时发生以下反应,如
的催化加氢同时发生以下反应,如i
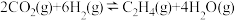
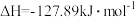
ii.

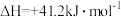
不同压强下
 的平衡转化率与温度的关系如下图:
的平衡转化率与温度的关系如下图:
①400~600℃,
 的平衡转化率随着压强的升高而增大,B点v正
的平衡转化率随着压强的升高而增大,B点v正②根据图象可知,其他条件相同时,下列反应条件控制中能获得乙烯最多的是
A.压强0.1MPa 温度800℃ B.压强4.0MPa 温度300℃
C.压强0.1MPa 温度300℃ D.压强4.0MPa 温度800℃
③在恒定压强下,随着温度的升高,
 的平衡转化率先降低后升高。试分析可能原因
的平衡转化率先降低后升高。试分析可能原因④一定条件下,将
 和CO2[
和CO2[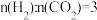 ]在某催化剂作用下,当总压稳定在p时,测得
]在某催化剂作用下,当总压稳定在p时,测得 和CO的物质的量之比为2:1,
和CO的物质的量之比为2:1, 的转化率为50.0%。则反应i的化学平衡常数Kp=
的转化率为50.0%。则反应i的化学平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g) CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。
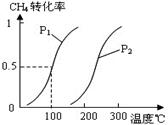
(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1 0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2 0,△S 0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值(写出计算过程及结果)
① CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1② CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。

(1)已知在P1、100℃时达到平衡所需的时间为5min,则用CH4表示的平均反应速率为______。
(2)反应①的△H1 0,图中的P1______P2(填“<”、“=”或“>”)。
(3)在压强为0.1MPa条件下,将一定量CO与H2的混合气体在催化剂作用下能自发反应生成甲醇,则反应②的△H2 0,△S 0(填“<”、“=”或“>”)。
(4)根据题中给出的数据,计算反应①在100℃时的平衡常数值(写出计算过程及结果)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。
(1)一种重要的工业制备甲醇的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
已知:①CO(g)+H2O(g) CO2(g)+H2(g)△H1=-40.9kJ·mol-1
CO2(g)+H2(g)△H1=-40.9kJ·mol-1
②CO(g)+2H2(g) CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1
试计算制备反应的△H=___ 。
(2)对于反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),v正=k正p(CO2)p3(H2),v逆=k逆p(CH3OH)p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
CH3OH(g)+H2O(g),v正=k正p(CO2)p3(H2),v逆=k逆p(CH3OH)p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
在540K下,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系图:
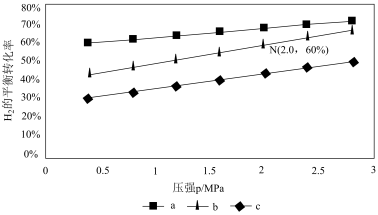
①比较a、b、c各曲线所表示的投料比大小顺序为____ (用字母表示)。
②点N在线b上,计算540K的压强平衡常数Kp=___ (用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=___ 。
(3)甲醇催化可制取丙烯,反应为:3CH3OH(g) C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-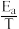 +C(Ea为活化能,k为速率常数,R和C为常数)。
+C(Ea为活化能,k为速率常数,R和C为常数)。
①该反应的活化能Ea=___ kJ·mol-1。
②当使用更高效催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图___ 。
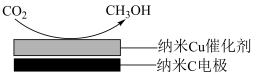
(4)在饱和KHCO3电解液中,电解活化的CO2也可以制备CH3OH。其原理如图所示,则阴极的电极反应式为____ 。
(1)一种重要的工业制备甲醇的反应为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H已知:①CO(g)+H2O(g)
 CO2(g)+H2(g)△H1=-40.9kJ·mol-1
CO2(g)+H2(g)△H1=-40.9kJ·mol-1②CO(g)+2H2(g)
 CH3OH(g)△H2=-90.4kJ·mol-1
CH3OH(g)△H2=-90.4kJ·mol-1试计算制备反应的△H=
(2)对于反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),v正=k正p(CO2)p3(H2),v逆=k逆p(CH3OH)p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
CH3OH(g)+H2O(g),v正=k正p(CO2)p3(H2),v逆=k逆p(CH3OH)p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系图:

①比较a、b、c各曲线所表示的投料比大小顺序为
②点N在线b上,计算540K的压强平衡常数Kp=
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=
(3)甲醇催化可制取丙烯,反应为:3CH3OH(g)
 C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-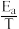 +C(Ea为活化能,k为速率常数,R和C为常数)。
+C(Ea为活化能,k为速率常数,R和C为常数)。①该反应的活化能Ea=
②当使用更高效催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图
(4)在饱和KHCO3电解液中,电解活化的CO2也可以制备CH3OH。其原理如图所示,则阴极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)已知在2 L的密闭容器中进行可逆反应aA(g)+bB(g) 2C(g),各物质的有关数据如下:
2C(g),各物质的有关数据如下:
请回答下列问题。
①该可逆反应的化学方程式可表示为____________ 。
②用物质B来表示0~2s的平均反应速率为__________ 。
③从反应开始到2 s末,A的转化率为___________ 。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是______ (填字母)。
A.vB(消耗)=vc(生成)
B.容器内气体的密度不变
C.容器内气体的总压强保持不变
D.容器内气体C的物质的量分数保持不变
E. vA: vB:vC=4:3 :2
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是____________ 。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如下,则该燃料电池工作时,负极的电极反应式为__________ ,电池的总反应方程式为____________ 。

 2C(g),各物质的有关数据如下:
2C(g),各物质的有关数据如下:物质 | A | B | C |
| 起始物质的量浓度/mol·L-1 | 1.5 | 1.2 | 0 |
| 2s末物质的量浓度/mol·L-1 | 0.7 | 0.6 | 0.4 |
请回答下列问题。
①该可逆反应的化学方程式可表示为
②用物质B来表示0~2s的平均反应速率为
③从反应开始到2 s末,A的转化率为
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
A.vB(消耗)=vc(生成)
B.容器内气体的密度不变
C.容器内气体的总压强保持不变
D.容器内气体C的物质的量分数保持不变
E. vA: vB:vC=4:3 :2
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如下,则该燃料电池工作时,负极的电极反应式为

您最近一年使用:0次
【推荐2】已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且只有I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。

回答下列问题:
(1)F的电子式:___________ ;
(2)写出反应①的化学反应方程式:___________ ;
(3)用惰性电极电解足量A溶液,一段时间后,若要使溶液恢复到电解前的状态,则可向溶液中加入适量___________ 或__________ 。
(4)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极电极反应方程式:__________ 。

回答下列问题:
(1)F的电子式:
(2)写出反应①的化学反应方程式:
(3)用惰性电极电解足量A溶液,一段时间后,若要使溶液恢复到电解前的状态,则可向溶液中加入适量
(4)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极电极反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】 溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用
溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用 溶液进行以下实验探究:
溶液进行以下实验探究:
(1)下图是根据反应 设计成的锌铜原电池:
设计成的锌铜原电池:

该原电池的正极为_______ (填“Zn”或“Cu”),电解质溶液甲是_______ (填“ ”或“
”或“ ”)溶液;若盐桥中的成分是
”)溶液;若盐桥中的成分是 溶液,则盐桥中
溶液,则盐桥中 向
向_______ (填“甲”或“乙”)烧杯中移动。
(2)以 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______ (填字母)。
a.溶液中 向阳极移动 b.粗铜接电源正极,发生还原反应
向阳极移动 b.粗铜接电源正极,发生还原反应
c.电解后 溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
(3)利用反应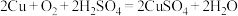 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应为
,若将该反应设计为原电池,其正极电极反应为_______ 。
(4)下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。

①该同学想在Ⅱ中实现铁上镀铜,a处电极上发生的电极反应式是_______ 。
②Ⅱ中电解前 溶液的浓度为2 mol/L,当线路中有0.2 mol电子通过时,则此时电解液
溶液的浓度为2 mol/L,当线路中有0.2 mol电子通过时,则此时电解液 溶液的浓度为
溶液的浓度为_______ 。
 溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用
溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用 溶液进行以下实验探究:
溶液进行以下实验探究:(1)下图是根据反应
 设计成的锌铜原电池:
设计成的锌铜原电池:
该原电池的正极为
 ”或“
”或“ ”)溶液;若盐桥中的成分是
”)溶液;若盐桥中的成分是 溶液,则盐桥中
溶液,则盐桥中 向
向(2)以
 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是a.溶液中
 向阳极移动 b.粗铜接电源正极,发生还原反应
向阳极移动 b.粗铜接电源正极,发生还原反应c.电解后
 溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属
溶液的浓度减小 d.利用阳极泥可回收Ag、Pt、Au等金属(3)利用反应
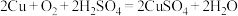 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应为
,若将该反应设计为原电池,其正极电极反应为(4)下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。

①该同学想在Ⅱ中实现铁上镀铜,a处电极上发生的电极反应式是
②Ⅱ中电解前
 溶液的浓度为2 mol/L,当线路中有0.2 mol电子通过时,则此时电解液
溶液的浓度为2 mol/L,当线路中有0.2 mol电子通过时,则此时电解液 溶液的浓度为
溶液的浓度为
您最近一年使用:0次



