CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)CO2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H=-726.5kJ/mol、△H=-285.8kJ/mol,且1mol水蒸气转化为液态水时放出44kJ的热量。
则CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=__ kJ/mol。
(2)下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有__ (填字母代号)。
a.使用适当的催化剂
b.缩小体积增大体系压强
c.降温并及时分离出CH3OH
d.增大CO2和H2的初始投料比
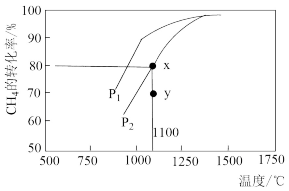
(3)CO2和CH4反应制取氢气:CO2(g)+CH4(g) 2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强P1
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强P1___ P2(填“大于”或“小于”);压强为P2时,在y点反应___ (填“正”或“逆”)向进行。
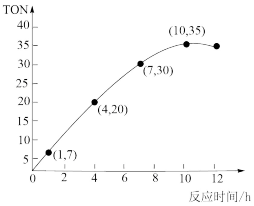
(4)CO2也可用于合成碳酸二甲酯(DMC)。一定温度时,在容积为2.0L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-2mol催化剂,容器中发生反应:2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+H2O(g)△H=-15.5kJ/mol。甲醇转化数(TON)与反应时间的关系如图所示。则该温度时,甲醇的最高转化率为
CH3OCOOCH3(g)+H2O(g)△H=-15.5kJ/mol。甲醇转化数(TON)与反应时间的关系如图所示。则该温度时,甲醇的最高转化率为__ 。4~7h内DMC的平均反应速率是__ (保留两位小数)。
已知:TON=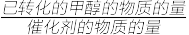
(1)CO2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H=-726.5kJ/mol、△H=-285.8kJ/mol,且1mol水蒸气转化为液态水时放出44kJ的热量。
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=(2)下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有
a.使用适当的催化剂
b.缩小体积增大体系压强
c.降温并及时分离出CH3OH
d.增大CO2和H2的初始投料比
(3)CO2和CH4反应制取氢气:CO2(g)+CH4(g)
 2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强P1
2CO(g)+2H2(g)在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则压强P1
(4)CO2也可用于合成碳酸二甲酯(DMC)。一定温度时,在容积为2.0L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-2mol催化剂,容器中发生反应:2CH3OH(g)+CO2(g)
 CH3OCOOCH3(g)+H2O(g)△H=-15.5kJ/mol。甲醇转化数(TON)与反应时间的关系如图所示。则该温度时,甲醇的最高转化率为
CH3OCOOCH3(g)+H2O(g)△H=-15.5kJ/mol。甲醇转化数(TON)与反应时间的关系如图所示。则该温度时,甲醇的最高转化率为
已知:TON=
更新时间:2020/08/22 10:50:54
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
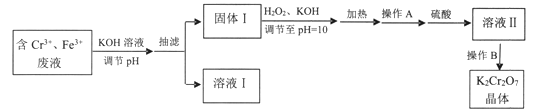
【推荐1】某研究性小组用含铬废水制取具有强氧化性的重铬酸钾(K2Cr2O7),实验方案如下:
已知:
①Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
②金属离子沉淀的PH如下:
③不同温度下化合物的溶解度如下:
请回答:
(1)操作A的名称是____ ,加入硫酸的目的是_____ 。
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式________ 。
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是__________ 。
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作__________ 。
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
则测得K2Cr2O7产品的纯度是_________ (以质量分数表示)。
已知:
①Cr2O72-(橙色)+H2O
 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+②金属离子沉淀的PH如下:
| 离子 | 开始沉淀的PH | 沉淀完全的PH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 4.1 |
| 物质 | 溶解度/(g/110g水) | ||
| 0℃ | 40℃ | 80℃ | |
| K2SO4 | 7.4 | 14.8 | 21.4 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
(1)操作A的名称是
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
| 实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 24.98 |
| 2 | 25.00 | 1.56 | 29.30 |
| 3 | 25.00 | 1.00 | 26.02 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
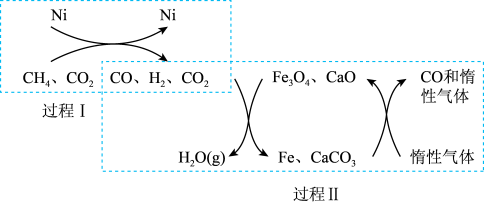
【推荐2】甲烷以天然气和可燃冰两种主要形式存在于地球上,储量巨大,充分利用甲烷对人类的未来发展具有重要意义。
(1)利用 、
、 在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
已知:
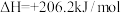

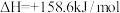
则:①过程Ⅱ中第二步反应的化学方程式为________________________ 。
②只有过程Ⅰ投料比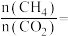
______ ,过程Ⅱ中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为_________________________ 。
(2)乙炔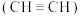 是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为:
是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为: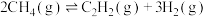 。甲烷裂解时还发生副反应:
。甲烷裂解时还发生副反应: 。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
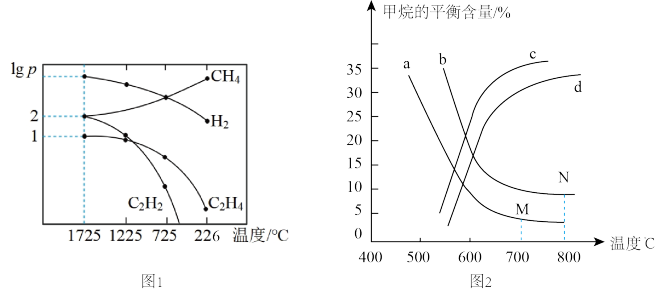
①1725℃时,向恒容密闭容器中充入 ,达到平衡时
,达到平衡时 生成
生成 的平衡转化率为
的平衡转化率为________ 。
②1725℃时,若图中 的
的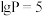 ,则反应
,则反应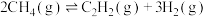 的平衡常数
的平衡常数
________ (注:用平衡分压Pa代替平衡浓度 进行计算)。
进行计算)。
③根据图判断,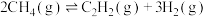

_____ 0(填“>”或“<”)。由图可知,甲烷裂解制乙炔过程中有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有__________ 。
(3)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、 ),发生反应为:
),发生反应为:
 图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是
图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是________ (填字母)。在实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是______________ 。
(1)利用
 、
、 在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
已知:

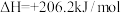

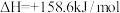
则:①过程Ⅱ中第二步反应的化学方程式为
②只有过程Ⅰ投料比
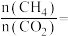
③该技术总反应的热化学方程式为
(2)乙炔
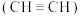 是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为:
是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为: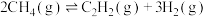 。甲烷裂解时还发生副反应:
。甲烷裂解时还发生副反应: 。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lg P与温度(℃)之间的关系如图1所示。
①1725℃时,向恒容密闭容器中充入
 ,达到平衡时
,达到平衡时 生成
生成 的平衡转化率为
的平衡转化率为②1725℃时,若图中
 的
的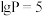 ,则反应
,则反应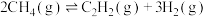 的平衡常数
的平衡常数
 进行计算)。
进行计算)。③根据图判断,
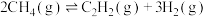

(3)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、
 ),发生反应为:
),发生反应为:
 图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是
图2中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示2MPa的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】铁元素在溶液中主要以Fe2+、Fe3+、Fe(SCN)3、FeO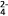 (紫红色)等形式存在。回答下列问题:
(紫红色)等形式存在。回答下列问题:
(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是___________ ,再滴加0.01 mol/L NaOH溶液3 ~5滴,现象是________________________ 。
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
①用离子方程式表示Fe(NO3)2溶液中的转化反应_________________________________________ 。
②根据A点数据,计算该转化反应的平衡常数为____________________ 。
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是______ 。石墨为电池的_____ 极,通过列式计算说明原因_______________________________ 。
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是_________________________ ,再加碱调节pH为_________ 时,铁刚好沉淀完全;继续加碱至pH为4.5时,铜开始沉淀。
已知:
(4)K2FeO4具有强氧化性。在K2FeO4溶液中加入过量稀硫酸,观察到有无色无味气体产生,还可观察到的现象是_____________________________ ;用K2FeO4处理含NH3废水,既可以把NH3氧化为N2防止水体富营养化,又能生成一种净水剂,该反应的离子方程式为______________________________ 。
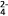 (紫红色)等形式存在。回答下列问题:
(紫红色)等形式存在。回答下列问题:(1)向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL 0.01 mol/L KSCN溶液,现象是
(2)Fe2+与Ag+在溶液中可相互转化。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如下左图所示:
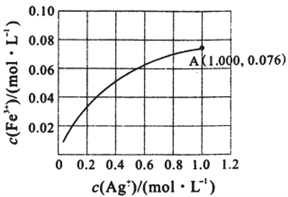
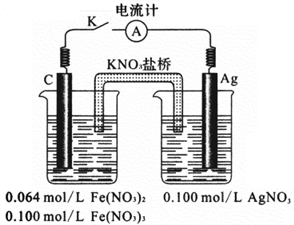
①用离子方程式表示Fe(NO3)2溶液中的转化反应
②根据A点数据,计算该转化反应的平衡常数为
③利用如上右图所示的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是
(3)印刷电路板是由高分子材料和铜箔复合而成,制印刷电路时,用FeCl3溶液作为“腐蚀液”,现从腐蚀后的溶液中分离出铁和铜,其方法是:先加H2O2,目的是
已知:
化合物 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-20 | 10-17 | 10-39 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】对温室气体二氧化碳的研究一直是科技界关注的重点。
在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
反应Ⅰ: CO2(g)+4H2(g) CH4(g)+H2O(g) ΔH1=-164.0kJ·mol-1
CH4(g)+H2O(g) ΔH1=-164.0kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
已知:①H2O(l)=H2O(g)△H=+44.0 kJ·mol-1②H2的标准燃烧热为-285.5 kJ·mol-1
(1)CH4的标准燃烧热△H=________ kJ·mol-1。一定温度下反应Ⅱ能自发进行,则该反应的△S_____ 0(填>、<或=)。
(2)一定条件下,T℃时若在体积恒为2L的密闭容器中同时发生上述反应,将物质的量之和为5mol的H2和CO2以不同的投料比进行反应。相关的变化关系见图Ⅰ; a、b表示两种反应物的转化率,c、d分别表示CH4和CO的体积分数。
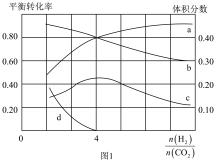
①下列有关说法正确的是_________
A.a曲线表示H2的平衡转化率
B.使用合适的催化剂可以提高CO2的平衡转化率
C.由图可知,在该实验中,当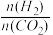 =4时,甲烷产量最高
=4时,甲烷产量最高
D.增大压强、升高温度有利于提高甲烷的平衡产率
②计算T℃下CO的产率趋于0时,反应I的化学平衡常数K=______________ 。
(3)若在体积恒定的密闭容器中,充入一定量的H2和CO2只发生反应Ⅱ,测定相同时间时不同温度下CO2的转化率,已知测得T4时反应刚好达到平衡。请画出CO2的转化率随温度的变化关系_____ 。(图2所示曲线表示CO2的平衡转化率随温度的变化关系)
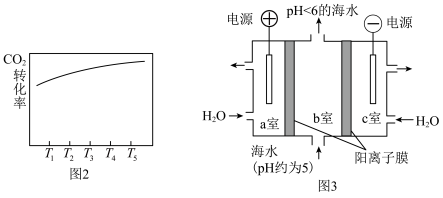
(4)溶于海水的CO295%以HCO3-形式存在。工业上利用如图3所示装置可从海水中提取CO2。结合方程式简述提取CO2的原理_______________________________________________ 。
在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
反应Ⅰ: CO2(g)+4H2(g)
 CH4(g)+H2O(g) ΔH1=-164.0kJ·mol-1
CH4(g)+H2O(g) ΔH1=-164.0kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1已知:①H2O(l)=H2O(g)△H=+44.0 kJ·mol-1②H2的标准燃烧热为-285.5 kJ·mol-1
(1)CH4的标准燃烧热△H=
(2)一定条件下,T℃时若在体积恒为2L的密闭容器中同时发生上述反应,将物质的量之和为5mol的H2和CO2以不同的投料比进行反应。相关的变化关系见图Ⅰ; a、b表示两种反应物的转化率,c、d分别表示CH4和CO的体积分数。

①下列有关说法正确的是
A.a曲线表示H2的平衡转化率
B.使用合适的催化剂可以提高CO2的平衡转化率
C.由图可知,在该实验中,当
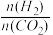 =4时,甲烷产量最高
=4时,甲烷产量最高D.增大压强、升高温度有利于提高甲烷的平衡产率
②计算T℃下CO的产率趋于0时,反应I的化学平衡常数K=
(3)若在体积恒定的密闭容器中,充入一定量的H2和CO2只发生反应Ⅱ,测定相同时间时不同温度下CO2的转化率,已知测得T4时反应刚好达到平衡。请画出CO2的转化率随温度的变化关系

(4)溶于海水的CO295%以HCO3-形式存在。工业上利用如图3所示装置可从海水中提取CO2。结合方程式简述提取CO2的原理
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)CO2与H2反应合成HCOOH,是实现“碳中和”的有效途径。 △H=
△H=_______ 。
(2)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:①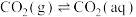 ;②
;②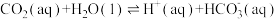 。25 ℃时,反应②的平衡常数为K2。已知溶液中CO2的浓度与其在空气中的分压成正比(分压
。25 ℃时,反应②的平衡常数为K2。已知溶液中CO2的浓度与其在空气中的分压成正比(分压 总压
总压 物质的量分数),比例系数为x mol·L-1·kPa-1。当大气压强为p kPa,大气中CO2(g)的物质的量分数为y时,溶液中c(H+)=
物质的量分数),比例系数为x mol·L-1·kPa-1。当大气压强为p kPa,大气中CO2(g)的物质的量分数为y时,溶液中c(H+)=_______ mol/L (写出表达式,考虑水的电离,忽略 的电离)。
的电离)。
(3)在催化作用下,温度为T1 ℃时,将一定量CO2和H2充入密闭容器中发生如下反应:
主反应Ⅰ:CO2(g)+H2(g) HCOOH(g);
HCOOH(g);
副反应Ⅱ:
 。
。
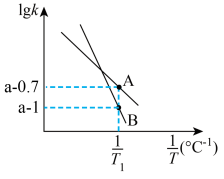
① 实验测得反应Ⅰ:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。请写出反应Ⅰ平衡常数的表达式Kc=_____ 。已知lgk与温度的关系如下图所示,T1 ℃下反应Ⅰ的Kc=_______ 。(已知10-0.3=0.5) )随温度变化如图所示。
)随温度变化如图所示。_______ 。200℃~360℃,升高温度曲线b对应纵坐标值减小的原因是 _______ 。
(1)CO2与H2反应合成HCOOH,是实现“碳中和”的有效途径。
已知: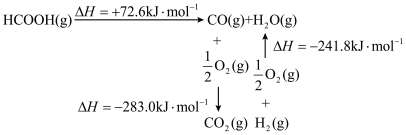
 △H=
△H=(2)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:①
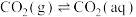 ;②
;②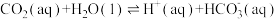 。25 ℃时,反应②的平衡常数为K2。已知溶液中CO2的浓度与其在空气中的分压成正比(分压
。25 ℃时,反应②的平衡常数为K2。已知溶液中CO2的浓度与其在空气中的分压成正比(分压 总压
总压 物质的量分数),比例系数为x mol·L-1·kPa-1。当大气压强为p kPa,大气中CO2(g)的物质的量分数为y时,溶液中c(H+)=
物质的量分数),比例系数为x mol·L-1·kPa-1。当大气压强为p kPa,大气中CO2(g)的物质的量分数为y时,溶液中c(H+)= 的电离)。
的电离)。(3)在催化作用下,温度为T1 ℃时,将一定量CO2和H2充入密闭容器中发生如下反应:
主反应Ⅰ:CO2(g)+H2(g)
 HCOOH(g);
HCOOH(g);副反应Ⅱ:

 。
。① 实验测得反应Ⅰ:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。请写出反应Ⅰ平衡常数的表达式Kc=
 )随温度变化如图所示。
)随温度变化如图所示。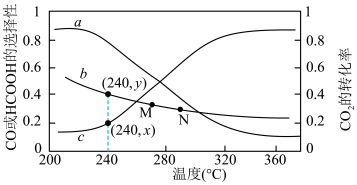
您最近一年使用:0次
【推荐3】中国科学家设计构建了结构封装双钯活性位点—纳米“蓄水”膜反应器,实现了 一步无副反应高效稳定制乙醇。回答下列问题:
一步无副反应高效稳定制乙醇。回答下列问题:
(1)已知乙醇、氢气的标准燃烧热 分别为
分别为 、
、 ,则反应
,则反应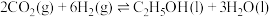 的
的
___________  ,该反应在
,该反应在___________ (填“高温下”“低温下”或“任何温度下均”)有利于自发进行。
(2)结构封装双钯活性位点—纳米“蓄水”膜反应器结构(如图所示)类似于一个胶囊,胶囊内部封装了二氧化铈载体分散的双钯催化剂,胶囊的壳层具有高选择性、疏水性,可及时分离出产物乙醇。该反应器可使 高效稳定地转化为乙醇,请分析可能原因:
高效稳定地转化为乙醇,请分析可能原因:___________ 。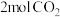 、
、 ,发生主反应I
,发生主反应I 、副反应II
、副反应II 。已知初始压强为
。已知初始压强为 ,反应
,反应 时,测得
时,测得 下,总共生成
下,总共生成 水。甲醇与乙醇的选择性[如
水。甲醇与乙醇的选择性[如 的选择性
的选择性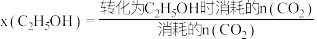 ]随温度和反应时间的变化关系如图。
]随温度和反应时间的变化关系如图。 下,当温度为
下,当温度为 时,乙醇的选择性能保持在近
时,乙醇的选择性能保持在近 的水平,但温度为
的水平,但温度为 和
和 时选择性大幅下降,其原因可能为
时选择性大幅下降,其原因可能为___________ 。
② 下,
下, 内
内 的转化率为
的转化率为___________ %,氢气分压的平均变化率为___________  。
。
(4)酸性 燃料电池的装置图如图所示,A极输入的物质为
燃料电池的装置图如图所示,A极输入的物质为___________ (填化学式), 极的电极反应式为
极的电极反应式为___________ 。
 一步无副反应高效稳定制乙醇。回答下列问题:
一步无副反应高效稳定制乙醇。回答下列问题:(1)已知乙醇、氢气的标准燃烧热
 分别为
分别为 、
、 ,则反应
,则反应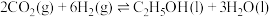 的
的
 ,该反应在
,该反应在(2)结构封装双钯活性位点—纳米“蓄水”膜反应器结构(如图所示)类似于一个胶囊,胶囊内部封装了二氧化铈载体分散的双钯催化剂,胶囊的壳层具有高选择性、疏水性,可及时分离出产物乙醇。该反应器可使
 高效稳定地转化为乙醇,请分析可能原因:
高效稳定地转化为乙醇,请分析可能原因: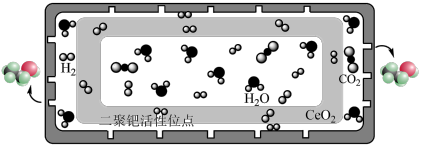
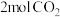 、
、 ,发生主反应I
,发生主反应I 、副反应II
、副反应II 。已知初始压强为
。已知初始压强为 ,反应
,反应 时,测得
时,测得 下,总共生成
下,总共生成 水。甲醇与乙醇的选择性[如
水。甲醇与乙醇的选择性[如 的选择性
的选择性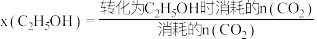 ]随温度和反应时间的变化关系如图。
]随温度和反应时间的变化关系如图。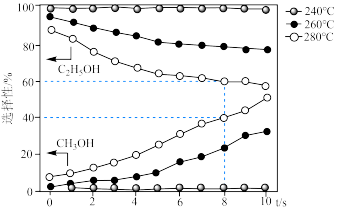
 下,当温度为
下,当温度为 时,乙醇的选择性能保持在近
时,乙醇的选择性能保持在近 的水平,但温度为
的水平,但温度为 和
和 时选择性大幅下降,其原因可能为
时选择性大幅下降,其原因可能为②
 下,
下, 内
内 的转化率为
的转化率为 。
。(4)酸性
 燃料电池的装置图如图所示,A极输入的物质为
燃料电池的装置图如图所示,A极输入的物质为 极的电极反应式为
极的电极反应式为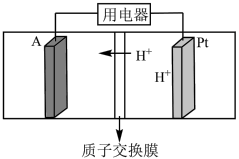
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】已知反应MgCl2+6NH3 MgCl2·6NH3具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
MgCl2·6NH3具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。

相关物质的性质见下表:
完成下列填空:
(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为_________ ,图1中虚框内装置的作用是_______________________________ 。
(2)氨化过程采用冰水浴的原因可能是_____ (选填编号)。
a.氨化过程吸热,促进反应正向进行b.加快反应速率
c.防止氨气挥发,提高氨气利用率d.增大产物的溶解度
氨化结束后,从混合体系中分离MgCl2·6NH3所需的玻璃仪器除烧杯外,还有_____ 。
(3)进行放氨实验时,三颈烧瓶中加入MgCl2·6NH3和足量烧碱的浓溶液,加热,并不断通入N2,通入N2目的是_______________________________________ 。
(4)通过观察图2烧杯中现象的变化可以监控放氨的程度,若加入MgCl2·6NH3的物质的量为0.010mol,要判断放氨率是否达到或超过90%,烧杯中溶液可以是含有少量指示剂______ (填名称)和_____ molH+的强酸溶液。
 MgCl2·6NH3具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
MgCl2·6NH3具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
相关物质的性质见下表:
| 物质名称 | 溶解性 | ||
| NH3 | MgCl2 | MgCl2·6NH3 | |
| 水 | 易溶 | 易溶 | 易溶 |
| 乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为
(2)氨化过程采用冰水浴的原因可能是
a.氨化过程吸热,促进反应正向进行b.加快反应速率
c.防止氨气挥发,提高氨气利用率d.增大产物的溶解度
氨化结束后,从混合体系中分离MgCl2·6NH3所需的玻璃仪器除烧杯外,还有
(3)进行放氨实验时,三颈烧瓶中加入MgCl2·6NH3和足量烧碱的浓溶液,加热,并不断通入N2,通入N2目的是
(4)通过观察图2烧杯中现象的变化可以监控放氨的程度,若加入MgCl2·6NH3的物质的量为0.010mol,要判断放氨率是否达到或超过90%,烧杯中溶液可以是含有少量指示剂
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】 和
和 是两种主要的温室气体,以
是两种主要的温室气体,以 和
和 为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上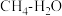 催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g) CO(g)+3H2;
CO(g)+3H2;
反应Ⅱ:CO(g)+H2O(g) CO2+H2(g);
CO2+H2(g);
 和
和 反应生成
反应生成 和
和 的热化学方程式是
的热化学方程式是___________ 。
(2)将 和
和 在一定条件下反应可制得合成气,在1 L密闭容器中通入
在一定条件下反应可制得合成气,在1 L密闭容器中通入 与
与 ,使其物质的量浓度均为
,使其物质的量浓度均为 ,在一定条件下发生反应:,CH4(g)+CO2(g)
,在一定条件下发生反应:,CH4(g)+CO2(g)  2CO(g)+2H2(g)测得CH4的平衡转化率与温度及压强的关系如下图1所示:
2CO(g)+2H2(g)测得CH4的平衡转化率与温度及压强的关系如下图1所示:
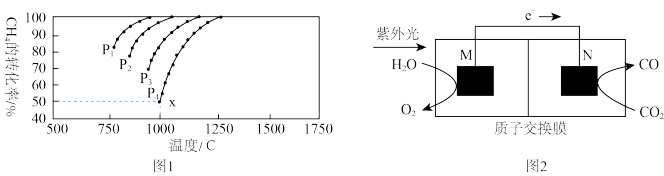
①压强 、
、 、
、 、
、 由小到大的关系为
由小到大的关系为___________ 。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作 ),如果
),如果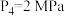 ,求x点的平衡常数
,求x点的平衡常数
___________ (用平衡分压代替平衡浓度计算)。
③下列措施中能使平衡正向移动的是___________ (填字母)。
a.升高温度
b.增大压强
c.保持温度、压强不变,充入He
d.恒温、恒容,再充入1 mol 和1 mol
和1 mol 
(3)科学家还研究了其他转化温室气体的方法,利用图2所示装置可以将 转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为
转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为___________ 极(填“正”或“负”),导线中通过2 mol电子后,假定体积不变M极电解质溶液的pH___________ (填“增大”、“减小”或“不变”),N极电解质溶液变化的质量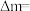
___________ g。
 和
和 是两种主要的温室气体,以
是两种主要的温室气体,以 和
和 为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:(1)工业上
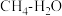 催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:反应Ⅰ:CH4(g)+H2O(g)
 CO(g)+3H2;
CO(g)+3H2;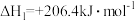
反应Ⅱ:CO(g)+H2O(g)
 CO2+H2(g);
CO2+H2(g);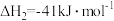
 和
和 反应生成
反应生成 和
和 的热化学方程式是
的热化学方程式是(2)将
 和
和 在一定条件下反应可制得合成气,在1 L密闭容器中通入
在一定条件下反应可制得合成气,在1 L密闭容器中通入 与
与 ,使其物质的量浓度均为
,使其物质的量浓度均为 ,在一定条件下发生反应:,CH4(g)+CO2(g)
,在一定条件下发生反应:,CH4(g)+CO2(g)  2CO(g)+2H2(g)测得CH4的平衡转化率与温度及压强的关系如下图1所示:
2CO(g)+2H2(g)测得CH4的平衡转化率与温度及压强的关系如下图1所示:
①压强
 、
、 、
、 、
、 由小到大的关系为
由小到大的关系为②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作
 ),如果
),如果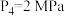 ,求x点的平衡常数
,求x点的平衡常数
③下列措施中能使平衡正向移动的是
a.升高温度
b.增大压强
c.保持温度、压强不变,充入He
d.恒温、恒容,再充入1 mol
 和1 mol
和1 mol 
(3)科学家还研究了其他转化温室气体的方法,利用图2所示装置可以将
 转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为
转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为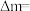
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】环氧乙烷作为一种高效消毒剂,能与微生物的蛋白质、DNA、RNA发生非特异性烷基化作用,阻碍细菌蛋白质的新陈代谢,因此,常用于一次性口罩生产过程中灭菌和新冠病毒的消杀。工业上常用乙烯氧化法生产环氧乙烷,具体反应原理为:
主反应:2CH2=CH2(g)+O2(g) 2
2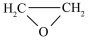 (g)△H1=-209.8kJ·mol-1
(g)△H1=-209.8kJ·mol-1
副反应:CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g)△H2=-1323.0kJ·mol-1
(1)C2H4的燃烧热△H=-1411.0kJ·mol-1,则环氧乙烷(g)的燃烧热△H=___ 。
(2)以下既能加快反应速率又能提高环氧乙烷产率的方法有___ (填标号)。
A.降低温度 B.向容器中充入N2使压强增大
C.采用改性的催化剂 D.用空气替代氧气
(3)若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生主反应,达到平衡时CH2=CH2的转化率为75%,则平衡时用各组分的物质的量分数表示的化学平衡常数Kx=___ (保留2位有效数字)。
(4)已知: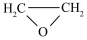 (g)+HCl(g)
(g)+HCl(g)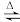
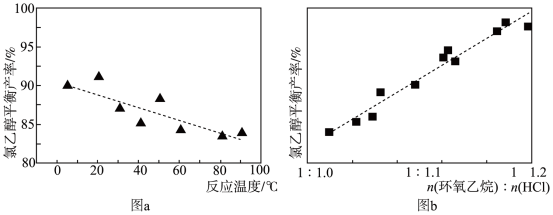
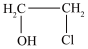 (l),测得该反应过程中温度与氯乙醇的平衡产率关系如图a。30℃时,原料投料比
(l),测得该反应过程中温度与氯乙醇的平衡产率关系如图a。30℃时,原料投料比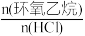 与氯乙醇的平衡产率关系如图b。则随着反应温度的升高,氯乙醇平衡产率降低的可能原因是
与氯乙醇的平衡产率关系如图b。则随着反应温度的升高,氯乙醇平衡产率降低的可能原因是___ ;其它条件不变时,降低原料投料比,环氧乙烷的平衡转化率将___ (填“增大”、“减小”或“不变”)。
(5)用电解法也能制备环氧乙烷,具体方法为:使用惰性电极电解KCl溶液,用Cl-交换膜将电解液分为阴极区和阳极区,其中一区持续通入乙烯;电解结束,移出交换膜,两区混合反应即得环氧乙烷。若阳极区的生成物为HOCH2CH2Cl,则乙烯应从___ (填“阳极”或“阴极”)通入,阴极的电极反应式为___ 。
主反应:2CH2=CH2(g)+O2(g)
 2
2 (g)△H1=-209.8kJ·mol-1
(g)△H1=-209.8kJ·mol-1副反应:CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g)△H2=-1323.0kJ·mol-1
(1)C2H4的燃烧热△H=-1411.0kJ·mol-1,则环氧乙烷(g)的燃烧热△H=
(2)以下既能加快反应速率又能提高环氧乙烷产率的方法有
A.降低温度 B.向容器中充入N2使压强增大
C.采用改性的催化剂 D.用空气替代氧气
(3)若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生主反应,达到平衡时CH2=CH2的转化率为75%,则平衡时用各组分的物质的量分数表示的化学平衡常数Kx=
(4)已知:
 (g)+HCl(g)
(g)+HCl(g)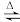
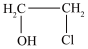 (l),测得该反应过程中温度与氯乙醇的平衡产率关系如图a。30℃时,原料投料比
(l),测得该反应过程中温度与氯乙醇的平衡产率关系如图a。30℃时,原料投料比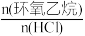 与氯乙醇的平衡产率关系如图b。则随着反应温度的升高,氯乙醇平衡产率降低的可能原因是
与氯乙醇的平衡产率关系如图b。则随着反应温度的升高,氯乙醇平衡产率降低的可能原因是
(5)用电解法也能制备环氧乙烷,具体方法为:使用惰性电极电解KCl溶液,用Cl-交换膜将电解液分为阴极区和阳极区,其中一区持续通入乙烯;电解结束,移出交换膜,两区混合反应即得环氧乙烷。若阳极区的生成物为HOCH2CH2Cl,则乙烯应从
您最近一年使用:0次



