C、Si在元素周期表中属于同主族元素,其常见的氧化物分别为CO2、SiO2。请回答下列问题:
(1)锗与碳、硅同主族,写出锗原子基态时的核外电子排布式:____________ 。
(2)C、O、Si三种元素的电负性由大到小的顺序为____________ (用元素符号表示)。
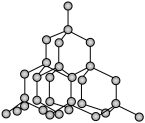
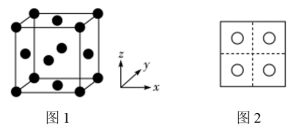
(3)二氧化硅结构跟硅晶体结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察下图中硅晶体的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目为____________ ;晶体硅中硅原子与共价键的数目比为____________ 。
(4)下图是二氧化碳的晶胞模型,从晶体类型来看,CO2属于_______ 晶体。图中显示出的二氧化碳分子数有________ 个,实际上一个二氧化碳晶胞中含有_______ 个二氧化碳分子。标准状况下2.24 L的CO2分子中含有的π键的数目为______ 。
(5)在二氧化碳晶胞中,最近的两个二氧化碳分子间的距离为a nm,NA为阿伏加 德罗常数的值,则晶体密度为____________ g·cm-3。
(1)锗与碳、硅同主族,写出锗原子基态时的核外电子排布式:
(2)C、O、Si三种元素的电负性由大到小的顺序为
(3)二氧化硅结构跟硅晶体结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察下图中硅晶体的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目为
(4)下图是二氧化碳的晶胞模型,从晶体类型来看,CO2属于
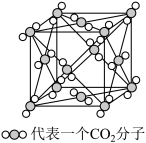
(5)在二氧化碳晶胞中,最近的两个二氧化碳分子间的距离为a nm,NA为阿伏加 德罗常数的值,则晶体密度为
更新时间:2020-09-22 21:56:16
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】铜是常见的、用途广泛的金属元素之一。
(1)基态Cu原子核外未成对电子所在的原子轨道是_______ 。
(2)一价铜离子配合物的结构如图所示:
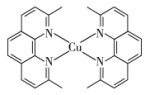
①上述配合物中 (Ⅰ)的配位数是
(Ⅰ)的配位数是_______ 。
②上述配合物分子中碳原子的杂化方式为_______ 。
③上述配合物中所含元素电负性由大到小的顺序为_______ (用元素符号表示)。
(3)常见的铜的氧化物有CuO和 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是 。
。
①CuO晶胞中,铜离子的坐标参数是 、
、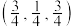 、
、_______ 和_______ 。
② 晶体的密度是
晶体的密度是_______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态Cu原子核外未成对电子所在的原子轨道是
(2)一价铜离子配合物的结构如图所示:

①上述配合物中
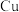 (Ⅰ)的配位数是
(Ⅰ)的配位数是②上述配合物分子中碳原子的杂化方式为
③上述配合物中所含元素电负性由大到小的顺序为
(3)常见的铜的氧化物有CuO和
 两种。已知:CuO晶胞中
两种。已知:CuO晶胞中 的位置如图1所示;两种晶胞中
的位置如图1所示;两种晶胞中 和
和 的位置相同,其在晶胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是
的位置相同,其在晶胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是 。
。
①CuO晶胞中,铜离子的坐标参数是
 、
、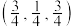 、
、②
 晶体的密度是
晶体的密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
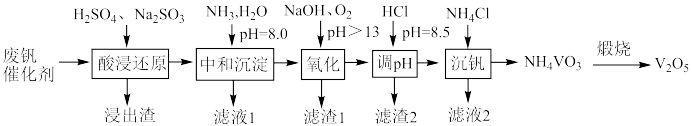
【推荐2】五氧化二饥广泛用于冶金、化工等行业。某废钒催化剂主要含有 、
、 、CaO、
、CaO、 、
、 、
、 等,采取如下工艺流程回收其中的钒制备
等,采取如下工艺流程回收其中的钒制备 ;
;
回答下列问题:
(1)基态V原子的价电子轨道表示式为________ 。
(2)浸出渣的主要成分是________ ,“酸浸还原”中 ;和
;和 均转化为
均转化为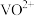 ,写出
,写出 转化为
转化为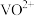 反应的离子方程式为
反应的离子方程式为________ 。
(3)“氧化”中被氧化的元素主要有________ (填元素符号)。
(4)“调pH”中有沉淀生成,写出生成沉淀反应的离子方程式________ 。
(5)“沉钒”中需要加入过量 ,其原因是
,其原因是________ 。 晶体未经洗涤直接进行“煅烧”,将导致
晶体未经洗涤直接进行“煅烧”,将导致 产品中混有
产品中混有________ 杂质。
(6)工艺中可循环利用的物质有________ 。
(7)一定温度下, 溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。________ 。
②碳化钒晶胞中与碳原子距离最近且相等的碳原子个数为________ 。
③若碳化钒合金的密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则晶胞参数
,则晶胞参数________ nm。
 、
、 、CaO、
、CaO、 、
、 、
、 等,采取如下工艺流程回收其中的钒制备
等,采取如下工艺流程回收其中的钒制备 ;
;
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH | 12.4 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 13.8 | 4.7 | 3.2 | 9.0 |
(1)基态V原子的价电子轨道表示式为
(2)浸出渣的主要成分是
 ;和
;和 均转化为
均转化为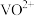 ,写出
,写出 转化为
转化为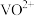 反应的离子方程式为
反应的离子方程式为(3)“氧化”中被氧化的元素主要有
(4)“调pH”中有沉淀生成,写出生成沉淀反应的离子方程式
(5)“沉钒”中需要加入过量
 ,其原因是
,其原因是 晶体未经洗涤直接进行“煅烧”,将导致
晶体未经洗涤直接进行“煅烧”,将导致 产品中混有
产品中混有(6)工艺中可循环利用的物质有
(7)一定温度下,
 溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
②碳化钒晶胞中与碳原子距离最近且相等的碳原子个数为
③若碳化钒合金的密度为
 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则晶胞参数
,则晶胞参数
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐(N5)6(H3O)3(NH4)4Cl,时隔不久,他们又成功制得全氮阴离子(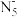 )金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
)金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
(1)基态氨原子最高能层电子所占用能级的电子云形状为___________ 。与N2互为等电子体的全氧离子化学式为___________ ;具有空间网状结构的高聚氮结构如图所示,则N70的端点小于高聚氮的沸点,原因是___________ ;N70和高聚氮属于___________ (填序号)。
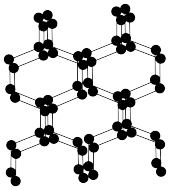
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氙化物见研究较早的含全氮阴离子的化合物,如:氢叠氦酸(HN3)、叠氮化钠(NaN3)等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钻的配体是NH3和______ , 的立体构型为
的立体构型为_______ 。
(3)N2H4分子中N原子均采取_______ 杂化;NaN3的晶格能大于KN3的晶格能,原因是________ 。
(4)试就胡炳成教授团队合成的上述两种盐进行有关分析:
①热分析结果显示盐(N5)6(H3O)3(NH4)4Cl分解温度高达116.8吨,具有非常好的热稳定性。这与其结构中含有类似苯分子中的大π键有关。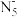 中的σ键总数为
中的σ键总数为___________ 个。
②试画出金属盐Co(N5)2(H2O)4·4H2O中钴离子的价电子排布图:___________
(5)一种氨铁化合物的结构如图所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为___________ g·cm-3。
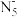 )金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
)金属盐Co(N5)2(H2O)4·4H2O,使氦原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:(1)基态氨原子最高能层电子所占用能级的电子云形状为

A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氙化物见研究较早的含全氮阴离子的化合物,如:氢叠氦酸(HN3)、叠氮化钠(NaN3)等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钻的配体是NH3和
 的立体构型为
的立体构型为(3)N2H4分子中N原子均采取
(4)试就胡炳成教授团队合成的上述两种盐进行有关分析:
①热分析结果显示盐(N5)6(H3O)3(NH4)4Cl分解温度高达116.8吨,具有非常好的热稳定性。这与其结构中含有类似苯分子中的大π键有关。
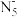 中的σ键总数为
中的σ键总数为②试画出金属盐Co(N5)2(H2O)4·4H2O中钴离子的价电子排布图:
(5)一种氨铁化合物的结构如图所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加德罗常数的值,则该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】C、N和Si能形成多种高硬度材料,如Si3N4,C3N4,SiC.
(1)Si3N4和C3N4中硬度较高的是______ ,理由是_________ .
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为_________ 。其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有_____________ 。

(3)C和N还能形成一种五元环状有机物咪唑(im),其结构为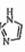 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下:
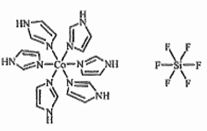
①Co原子的价层电子轨道表达式(价层电子排布图)为_____ 。N与Co之间的化学键类型是___ ,判断的理由是__________ 。
②阴离子SiF62-中心原子Si的价层电子对数为______ 。阳离子(Co(im)6]2+和SiF62-之间除了阴阳离子间的静电作用力,还存在氢键作用,画出该氢键的表示式_______ 。
例如水中氢键的表示式为: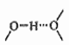
(4)SiC为立方晶系晶体,晶胞参数为a,已知Si原子半径为rSi,C原子半径为rC,该晶胞中原子的分数坐标为:
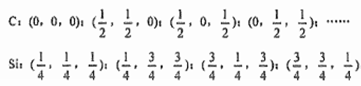
则SiC立方晶胞中含有____ 个Si原子、____ 个C原子,该晶胞中原子的体积占晶胞体积的百分率为__________ (列出计算式即可)。
(1)Si3N4和C3N4中硬度较高的是
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为

(3)C和N还能形成一种五元环状有机物咪唑(im),其结构为
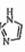 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下:
①Co原子的价层电子轨道表达式(价层电子排布图)为
②阴离子SiF62-中心原子Si的价层电子对数为
例如水中氢键的表示式为:
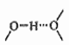
(4)SiC为立方晶系晶体,晶胞参数为a,已知Si原子半径为rSi,C原子半径为rC,该晶胞中原子的分数坐标为:
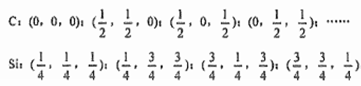
则SiC立方晶胞中含有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】 在催化剂作用下,与水反应生成
在催化剂作用下,与水反应生成 的前2步可能机理为:
的前2步可能机理为:
第1步: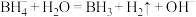
第2步:
……完成下列填空:
(1)已知电负性: 。
。 中B的化合价为
中B的化合价为_______ 。第1步反应的氧化产物是_______ ,(填化学式或离子符号)。
(2) 的分子空间构型是
的分子空间构型是_______ , 中B原子的杂化类型是
中B原子的杂化类型是_______ 。比较 与
与 的键角:
的键角:
_______ 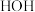 (填“>”、“<”或“=”),其原因是:
(填“>”、“<”或“=”),其原因是:_______ 。
(3)上述机理的第3、4步与第2步类似,最终生成 。用化学方程式表示第3步的机理:
。用化学方程式表示第3步的机理:_______ 。写出 的结构式:
的结构式:_______ 。根据上述机理, 与
与 反应时,所得气体产物为
反应时,所得气体产物为_______ (填写化学式)。
(4) 分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是
分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是_______ 。
(5) 溶液中存在平衡:
溶液中存在平衡: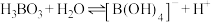 。下列叙述正确的是
。下列叙述正确的是
 在催化剂作用下,与水反应生成
在催化剂作用下,与水反应生成 的前2步可能机理为:
的前2步可能机理为:第1步:
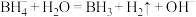
第2步:

……完成下列填空:
(1)已知电负性:
 。
。 中B的化合价为
中B的化合价为(2)
 的分子空间构型是
的分子空间构型是 中B原子的杂化类型是
中B原子的杂化类型是 与
与 的键角:
的键角:
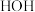 (填“>”、“<”或“=”),其原因是:
(填“>”、“<”或“=”),其原因是:(3)上述机理的第3、4步与第2步类似,最终生成
 。用化学方程式表示第3步的机理:
。用化学方程式表示第3步的机理: 的结构式:
的结构式: 与
与 反应时,所得气体产物为
反应时,所得气体产物为(4)
 分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是
分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是(5)
 溶液中存在平衡:
溶液中存在平衡: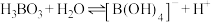 。下列叙述正确的是
。下列叙述正确的是A. 的水溶液显酸性 的水溶液显酸性 |
B.B原子杂化轨道中s轨道的成分: 大于 大于 |
| C.上述反应的2种反应物分子中,所有原子都达到8电子构型 |
D. 溶液中还可能存在 溶液中还可能存在 、 、 等系列微粒 等系列微粒 |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
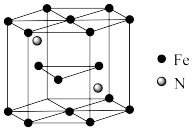
【推荐3】我国科学家及其合作团队研究发现,六方相(hcp)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:
(1)基态铁原子最外层电子所在能级的电子云轮廓图为_______ 形。
(2)H、C、O三种元素的电负性由大到小的排序为_______ (填元素符号)。
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释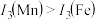 的主要原因:
的主要原因:_______ 。
(4)H、C,O三种元素可以组成很多种物质。
① 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有_______ (填化学式),其中 的立体构型为
的立体构型为_______ 。
② 的沸点
的沸点_______ (填“大于”、“小于”或“等于”) 的沸点。
的沸点。
(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
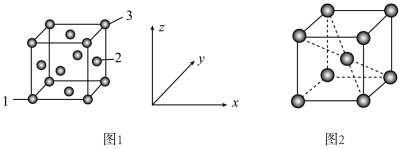
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为_______ 。
②若图2中晶胞参数为apm,设 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为_______ (用含a、 的代数式表示)
的代数式表示) 。
。
(1)基态铁原子最外层电子所在能级的电子云轮廓图为
(2)H、C、O三种元素的电负性由大到小的排序为
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | 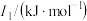 |  |  |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
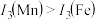 的主要原因:
的主要原因:(4)H、C,O三种元素可以组成很多种物质。
①
 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有 的立体构型为
的立体构型为②
 的沸点
的沸点 的沸点。
的沸点。(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。

①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为
②若图2中晶胞参数为apm,设
 为阿伏加德罗常数的值,则晶体的密度为
为阿伏加德罗常数的值,则晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】环烷酸金属( 、
、 、
、 、
、 、
、 )盐常作为合成聚氨酯过程中的有效催化剂。请回答下列问题:
)盐常作为合成聚氨酯过程中的有效催化剂。请回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)镍的氨合离子 中存在的化学键有
中存在的化学键有___________ 。
A.离子键 B.共价键 C.配位键 D.氢键 E. 键 F.
键 F. 键
键
(3) 、
、 的第二电离能比较:
的第二电离能比较:
___________  (填>、=或<)。
(填>、=或<)。
(4)锡元素可形成白锡、灰锡、脆锡三种单质。其中灰锡晶体与金刚石结构相似,但灰锡不如金刚石稳定,其原因是___________ 。
(5)硒化锌晶胞结构如图所示,其晶胞参数为 。
。
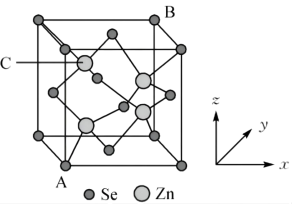
①已知原子坐标: 点为
点为 ,
, 点为
点为 ,则C点原子坐标为
,则C点原子坐标为___________ 。
②若硒化锌晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________ (用含 、
、 的计算式表示)。
的计算式表示)。
 、
、 、
、 、
、 、
、 )盐常作为合成聚氨酯过程中的有效催化剂。请回答下列问题:
)盐常作为合成聚氨酯过程中的有效催化剂。请回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)镍的氨合离子
 中存在的化学键有
中存在的化学键有A.离子键 B.共价键 C.配位键 D.氢键 E.
 键 F.
键 F. 键
键(3)
 、
、 的第二电离能比较:
的第二电离能比较:
 (填>、=或<)。
(填>、=或<)。(4)锡元素可形成白锡、灰锡、脆锡三种单质。其中灰锡晶体与金刚石结构相似,但灰锡不如金刚石稳定,其原因是
(5)硒化锌晶胞结构如图所示,其晶胞参数为
 。
。
①已知原子坐标:
 点为
点为 ,
, 点为
点为 ,则C点原子坐标为
,则C点原子坐标为②若硒化锌晶体的密度为
 ,则阿伏加德罗常数
,则阿伏加德罗常数
 、
、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】【化学一选修3:物质结构与性质】
卤族元素单质与许多物质反应形成多种化合物。请利用所学物质结构与性质的相关知识回答:
(1)写出基态碘原子的价电子排布式___________ ;
(2)卤族元素的含氧酸中酸性最强的是____ (写化学式),该酸根离子的立体构型为_________ 。
(3)比较下列锗的卤化物的熔点和沸点,分析其变化规律及原因_________ 。
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6
)和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6_____ HIO4(填“>”、“<”或“=”)。H5IO6中σ键与π键的个数比为________ 。
(5)已知氯元素与第四周期最外层只有1个电子、次外层的所有原子轨道均充满电子的元素M形成的一种化合物的立方晶胞如图所示。
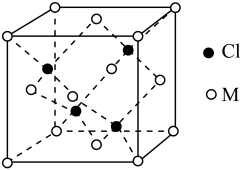
①该化合物的化学式为_______ ,已知晶胞参数a=0.542 nm,此晶体的密度为_____ g/cm3。(写出计算式,不要求计算结果,阿伏伽德罗常数为NA)
卤族元素单质与许多物质反应形成多种化合物。请利用所学物质结构与性质的相关知识回答:
(1)写出基态碘原子的价电子排布式
(2)卤族元素的含氧酸中酸性最强的是
(3)比较下列锗的卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
 )和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6
)和HIO4,前者为五元酸,后者为一元酸,二者酸性强弱顺序为H5IO6(5)已知氯元素与第四周期最外层只有1个电子、次外层的所有原子轨道均充满电子的元素M形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐3】化合物F是合成某种祛痰止咳药的重要中间体,其合成路线如下:
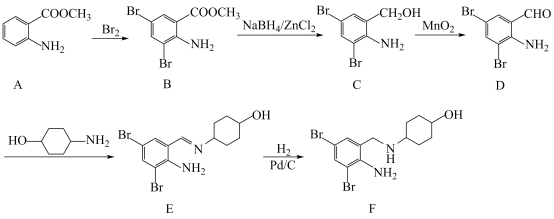
(1)1 mol 有机物C中含σ键的数目为_______ 。
(2)D→E的过程中,涉及的反应类型有:加成反应、_______ 。
(3)若E中有D残留,则产物F中可能含有杂质C7H7NOBr2,其结构简式为_______ 。
(4)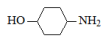 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______ 。
①分子中有一个含氮五元环;
②核磁共振氢谱显示分子中有5种不同化学环境的氢原子;
③红外光谱显示分子中无甲基。
(5)已知: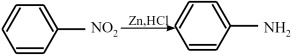 ,
, 易被氧化(R为H或烃基)。设计以
易被氧化(R为H或烃基)。设计以 和
和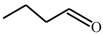 为原料制备
为原料制备 的合成路线
的合成路线_______ 。(无机试剂和有机溶剂任用,合成路线示例见本题题干)。

(1)1 mol 有机物C中含σ键的数目为
(2)D→E的过程中,涉及的反应类型有:加成反应、
(3)若E中有D残留,则产物F中可能含有杂质C7H7NOBr2,其结构简式为
(4)
 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:①分子中有一个含氮五元环;
②核磁共振氢谱显示分子中有5种不同化学环境的氢原子;
③红外光谱显示分子中无甲基。
(5)已知:
 ,
, 易被氧化(R为H或烃基)。设计以
易被氧化(R为H或烃基)。设计以 和
和 为原料制备
为原料制备 的合成路线
的合成路线
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5.为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3.回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是______ (填字母序号)。
a.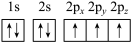 b.
b. 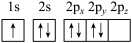
c.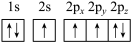 d.
d. 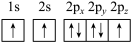
(2)写出CO的一种常见等电子体分子的结构式:______ ;C、N、O的第一电离能由大到小的顺序为______ (用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是______ 。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是______ ,NH3分子的价电子对互斥理论模型是______ 。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:

①若坐标参数A为(0,0,0),B为(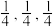 ),则C的坐标参数为
),则C的坐标参数为______ ;
②若阿伏加 德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为______ g•cm-3。
(1)下列氮原子的电子排布图表示的状态中,能量最低的是
a.
 b.
b. 
c.
 d.
d. 
(2)写出CO的一种常见等电子体分子的结构式:
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:

①若坐标参数A为(0,0,0),B为(
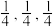 ),则C的坐标参数为
),则C的坐标参数为②若阿伏加 德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同。
___________________ 。
(2)B、C、D三元素第一电离能由大到小的顺序为____________ (用元素符号表示)
(3)BD 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为__________ 杂化;CA 的空间构型为
的空间构型为_________________ 。
(4)1mol BC-中含有π键的数目为______________ 。
(5)比较D、E元素最简单氢化物的沸点高低:_________ (用化学式表示)。
(6)C、F两元素形成的某化合物的晶胞结构如右图所示,顶点为C原子。则该化合物的化学式是________ ,C原子的配位数是__________ 。若相邻C原子和F原子间的距离为a cm,阿伏加德罗常数为NA,则该晶体的密度为________________ g/cm3(用含a、NA的代数式表示)。

(2)B、C、D三元素第一电离能由大到小的顺序为
(3)BD
 中心原子杂化轨道的类型为
中心原子杂化轨道的类型为 的空间构型为
的空间构型为(4)1mol BC-中含有π键的数目为
(5)比较D、E元素最简单氢化物的沸点高低:
(6)C、F两元素形成的某化合物的晶胞结构如右图所示,顶点为C原子。则该化合物的化学式是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】硼、硅、硒等元素及其化合物用途广泛。请回答下列问题:
(1)基态硒原子的价电子排布式为_______ ;SeO2常温下为白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体为________ 晶体。
(2)在硼、硅、硒的气态氢化物中,其立体构型为正四面体的是_______ (填化学式),在硅的氢化物中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性大小为Se_____ Si(填“>”或“<”)。
(3)在周期表的第二周期中,第一电离能介于硼元素和氮元素之间的元素有_____ 种。
(4)硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3,BF3·NH3中B与N之间形成______ 键;NH3中N原子的杂化轨道类型为______ ,写出与NH3等电子体的一种离子符号________ 。
(5)金刚砂(SiC)的摩氏硬度为9.5,其晶胞结构如图所示。在SiC中,每个Si原子周围距离最近的Si原子数目为________ ;若金刚砂的密度为ρg·cm-3,NA表示阿伏加 德罗常数的值,则晶胞中碳原子与硅原子的最近距离为________ pm。(用含ρ和NA的式子表示)
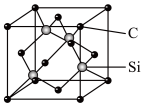
(1)基态硒原子的价电子排布式为
(2)在硼、硅、硒的气态氢化物中,其立体构型为正四面体的是
(3)在周期表的第二周期中,第一电离能介于硼元素和氮元素之间的元素有
(4)硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3,BF3·NH3中B与N之间形成
(5)金刚砂(SiC)的摩氏硬度为9.5,其晶胞结构如图所示。在SiC中,每个Si原子周围距离最近的Si原子数目为

您最近一年使用:0次



