C(s)+2NO(g)
 CO2(g)+N2(g)
CO2(g)+N2(g)(1)在其它条件不变时,有下列措施:①加入固体C②使用催化剂③压缩容器容积增大压强④使CO2转化成干冰从体系中脱离,要提高NO的转化率,你认为可行的是
(2)这个反应的平衡常数表达式是
(3)在恒容恒温密闭容器中,科学家得到下列实验数据:
| 时间(min) | 浓度(mol/L) | ||
| NO | N2 | CO2 | |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
反应在该温度下的平衡常数K=
(4)若在(3)的实验中30min时开始升温,36min时达平衡,测得NO的转化率变为50%,则该反应的△H
(5)若科学家在30min后改变了某一条件,反应进行到40min时达平衡浓度分别为c(NO)=0.032mol/L,c(N2)=0.034mol/L,c(CO2)=0.017mol/L,则改变的条件可能是
相似题推荐
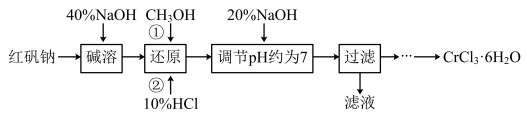
已知:
①Cr2O72-+H2O⇌2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式
(3)使用下列用品来测定溶液的pH,合理的是
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体21.32g,则该实验的产率为
 氢化制备
氢化制备 的反应称为逆水煤气变换反应
的反应称为逆水煤气变换反应 ,工业上常利用
,工业上常利用 反应制备化工原料
反应制备化工原料 ,此举可有效缓解温室效应。涉及反应如下:
,此举可有效缓解温室效应。涉及反应如下: 反应I:
反应I: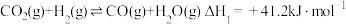
副反应II:

回答下列问题:
(1)反应
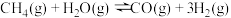

 。
。相比
 反应,副反应II在化学热力学上进行的趋势很大,原因为
反应,副反应II在化学热力学上进行的趋势很大,原因为(2)研究表明由不同的方法制备得到的
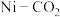 催化剂对
催化剂对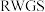 反应的催化活性和选择性不同。在某恒压密闭容器中充入一定量
反应的催化活性和选择性不同。在某恒压密闭容器中充入一定量 和
和 ,在不同的温度下反应相同的时间,实验测得
,在不同的温度下反应相同的时间,实验测得 转化率、
转化率、 的选择性与反应温度的关系分别如图1和图2所示:
的选择性与反应温度的关系分别如图1和图2所示:
①
 时,为提高
时,为提高 的产率,适宜选择的催化剂为
的产率,适宜选择的催化剂为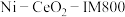 ”或“
”或“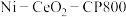 ”),原因为
”),原因为②研究表明,
 催化剂中,进入立方
催化剂中,进入立方 晶胞(结构如图所示)的
晶胞(结构如图所示)的 会替代部分
会替代部分 而变成
而变成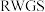 反应的活化中心。立方
反应的活化中心。立方 晶胞参数为
晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶胞的密度为
晶胞的密度为 (列式即可)。
(列式即可)。
(3)
 时,在某刚性密闭容器中充入
时,在某刚性密闭容器中充入 和
和 ,发生反应I和反应II,达到平衡时测得
,发生反应I和反应II,达到平衡时测得 转化率为
转化率为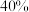 ,生成
,生成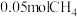 。平衡时,该温度下
。平衡时,该温度下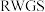 反应的平衡常数为
反应的平衡常数为(4)对于反应Ⅰ和反应Ⅱ同时发生的体系,在投料比一定时测得
 的平衡转化率与压强
的平衡转化率与压强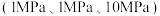 、温度的关系如图所示。
、温度的关系如图所示。 三条曲线中表征压强是
三条曲线中表征压强是 的是
的是 ”“
”“ ”或“
”或“ ”)。
”)。
【推荐3】氧和硫的化合物在化工生产上应用非常广泛.试回答下列问题:
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。
已知:6Ag(s)+O3(g)═3Ag2O(s);△H=﹣235kJ/mol;
2Ag2O(s)═4Ag(s)+O2(g);△H=+60kJ/mol;
则反应2O3(g)=3O2(g)的△H=
(2)SO2Cl2常用于制造医药品、染料、表面活性剂等.已知:SO2Cl2(g) SO2(g)+Cl2(g)△H=akJ•mol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为
SO2(g)+Cl2(g)△H=akJ•mol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为
(3)对(2)中的反应,在400℃,1.01×105Pa条件下,向容积为2L的恒容密闭容器中充入一定量的SO2Cl2,n(SO2)和n(SO2Cl2)随时间的变化曲线如图所示。

①0~20min反应的平均速率v(SO2Cl2)=
②下列叙述正确的是
A.A点v正(SO2Cl2)>v逆(SO2Cl2)
B.密度和平均摩尔质量不变均说明处于平衡状态
C.其它条件不变,若增大压强,n(SO2)比图中D点的值大
D.其它条件不变,500℃时反应达平衡,n(SO2)比图中D点的值大
 CH3OH(g)。常温常压下反应的能量变化如图1所示:
CH3OH(g)。常温常压下反应的能量变化如图1所示: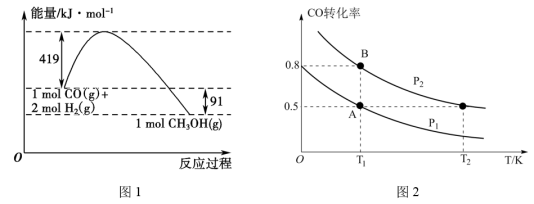
②
| 化学键 | H—H | H—O | O=O |
| 键能kJ/mol | 436 | x | 496 |
③CO(g)+
 O2(g)=CO2(g) △H=-280kJ/mol
O2(g)=CO2(g) △H=-280kJ/molH2(g)+
 O2(g)=H2O(l) △H=-284kJ/mol
O2(g)=H2O(l) △H=-284kJ/molH2O(l)=H2O(g) △H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为
(2)请写出表示气态甲醇燃烧热的热化学方程式
(3)H—O的键能x值为
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L。如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
 、
、 对构建低碳社会有重要意义。
对构建低碳社会有重要意义。(1)利用
 与
与 制备合成气
制备合成气 、
、 ,可能的反应历程为:
,可能的反应历程为:反应①:
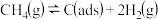
②:
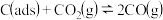
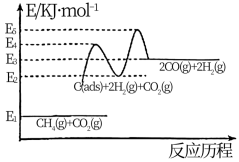
说明:
 为吸附性活性炭,
为吸附性活性炭, 为对应物质的总能量
为对应物质的总能量①利用
 与
与 制备合成气
制备合成气 、
、 的总反应的热化学方程式为
的总反应的热化学方程式为②该反应历程中决定反应速率快慢的是(填“反应①”或“反应②”)
(2)工业上用
 和
和 合成甲醇:
合成甲醇: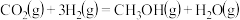
 。一定条件下,向容积均为
。一定条件下,向容积均为 的恒容密闭容器中通入
的恒容密闭容器中通入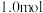
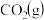 和
和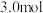
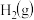 ,在不同催化剂
,在不同催化剂 、
、 的催化下发生反应。测得
的催化下发生反应。测得 时,
时, 转化率与温度的变化关系如图实线所示(虚线表示
转化率与温度的变化关系如图实线所示(虚线表示 平衡转化率)。
平衡转化率)。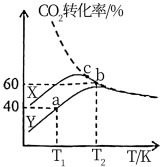
①该反应选用的适宜催化剂为
 ”或“
”或“ ”)。
”)。②
 时,
时, 点对应容器在
点对应容器在 内的平均反应速率
内的平均反应速率
③
 、
、 点对应状态下反应物的有效碰撞几率
点对应状态下反应物的有效碰撞几率
 (填“>”“<”或“。”),
(填“>”“<”或“。”), 段
段 转化率减小的原因是
转化率减小的原因是④
 时,该反应平衡常数
时,该反应平衡常数
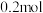
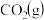 、
、
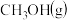 ,平衡将
,平衡将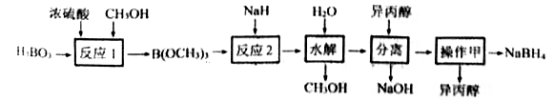
已知: ①H3BO3电离:H3BO3+H2O
 [B(OH)4]-+H+
[B(OH)4]-+H+②反应1: H3BO3+3CH3OH
 B(OCH3)3+3H2O
B(OCH3)3+3H2O③反应2:B(OCH3)3+4NaH=NaBH4+ 3CH3ONa
(1)H3BO3是
(2)NaBH4与水剧烈反应放出H2。反应的化学方程式为
(3)反应1属于
(4)“水解”时产生的大量NaOH,减缓了NaBH4与水的反应。在该步骤中,与水反应生成大量NaOH的物质是
(5)“分离”后得到NaBH4的异丙醇溶液。操作甲是
(6)上述流程中可以循环使用的物质是
(7)以惰性电极电解Na[B(OH)4]与NaOH 混合溶液也能制得NaBH4。阴极的电极反应式为



