A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的 通过
通过 、
、 分别充入A、B中,反应起始时,A、B的体积相同。(已知:
分别充入A、B中,反应起始时,A、B的体积相同。(已知: 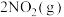

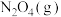
 )
)

(1).一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA_____ vB (填“>”、“<”或“=”);若打开活塞 ,气球B将
,气球B将__________ (填“变大”、“变小”或“不变”).
(2).关闭活塞 ,若在A、B中再充入与初始量相等的
,若在A、B中再充入与初始量相等的 ,则达到平衡时, 再分别通入等量的氖气,则达到平衡时,A中
,则达到平衡时, 再分别通入等量的氖气,则达到平衡时,A中 的转化率将
的转化率将__________ ,B中 的转化率将
的转化率将__________ (填“变大”、“变小”或“不变”).
(3)若在A中充入4.6g NO2,达到平衡后容器内混合气体的平均摩尔质量为57.5g/mol,则平衡时N2O4的物质的量为_____ 。
 通过
通过 、
、 分别充入A、B中,反应起始时,A、B的体积相同。(已知:
分别充入A、B中,反应起始时,A、B的体积相同。(已知: 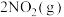

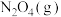
 )
)
(1).一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA
 ,气球B将
,气球B将(2).关闭活塞
 ,若在A、B中再充入与初始量相等的
,若在A、B中再充入与初始量相等的 ,则达到平衡时, 再分别通入等量的氖气,则达到平衡时,A中
,则达到平衡时, 再分别通入等量的氖气,则达到平衡时,A中 的转化率将
的转化率将 的转化率将
的转化率将(3)若在A中充入4.6g NO2,达到平衡后容器内混合气体的平均摩尔质量为57.5g/mol,则平衡时N2O4的物质的量为
更新时间:2020-10-22 10:56:07
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】2019年诺贝尔化学奖授予锂离子电池领域。LiFePO4(磷酸亚铁锂) 是锂离子电池的一种电极材料,可通过下列方法制备:
方法一:2FePO4(s)+ ___Li2CO3(s)+ ___C(s)⇌ ___LiFePO4(s)+ ___CO(g)
(1)配平该化学方程式_______ 。发生还原反应的物质是_______ (填化学式)。
(2)该反应的平衡常数表达式为_______ 。若在容积不变的容器中,上述反应达到平衡时,一氧化碳的浓度为amol⋅L−1,再充入bmol一氧化碳,则平衡向_______ 方向移动,达到新平衡时,一氧化碳的浓度为_______ 。
(3)一定温度下,在2L密闭容器中发生上述反应。反应进行到20min时,容器内固体的质量减少了5.6g,则0∼20min内一氧化碳的平均反应速率是_______ 。
方法二:LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
(4)共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合,其原因是_______ 。
(5)磷酸亚铁锂电池总反应为:FePO4+Li→LiFePO4,放电时,负极为_______ (填写化学式)。
方法一:2FePO4(s)+ ___Li2CO3(s)+ ___C(s)⇌ ___LiFePO4(s)+ ___CO(g)
(1)配平该化学方程式
(2)该反应的平衡常数表达式为
(3)一定温度下,在2L密闭容器中发生上述反应。反应进行到20min时,容器内固体的质量减少了5.6g,则0∼20min内一氧化碳的平均反应速率是
方法二:LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
(4)共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合,其原因是
(5)磷酸亚铁锂电池总反应为:FePO4+Li→LiFePO4,放电时,负极为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】根据下列实验设计,回答问题:

(1)利用实验(I)探究锌与 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___________ 。
(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在: (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
①依据题意写出其中的离子方程式___________ ,
②用平衡移动原理解释D颜色变浅的原因:___________ ;
③加水稀释,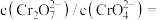
___________ (答“变大”、“变小”或“不变”)
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应: 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:
①由实验i、实验ii可得出的结论是___________ 。
②关于实验i中 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂: 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入 酸性
酸性 溶液,
溶液,___________ ,最后加入 草酸溶液。
草酸溶液。
③基于以上实验与分析,推测实验(III)设计___________ (填“能”或“不能”)达到实验目的。

(1)利用实验(I)探究锌与
 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在:
 (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,①依据题意写出其中的离子方程式
②用平衡移动原理解释D颜色变浅的原因:
③加水稀释,
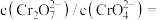
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应:
 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入 酸性 酸性 溶液,再加入1滴 溶液,再加入1滴 硫酸和9滴蒸馏水、最后加入 硫酸和9滴蒸馏水、最后加入 草酸溶液 草酸溶液 | 前 内溶液紫色无明显变化,后颜色逐渐变浅, 内溶液紫色无明显变化,后颜色逐渐变浅, 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入 酸性 酸性 溶液,再加入10滴 溶液,再加入10滴 硫酸,最后加入 硫酸,最后加入 草酸溶液 草酸溶液 |  内溶液紫色无明显变化,后颜色迅速变浅,约 内溶液紫色无明显变化,后颜色迅速变浅,约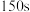 后几乎变为无色 后几乎变为无色 |
②关于实验i中
 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。提供的试剂:
 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。补全实验ⅲ的操作:向试管中先加入
 酸性
酸性 溶液,
溶液, 草酸溶液。
草酸溶液。③基于以上实验与分析,推测实验(III)设计
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】反应Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
(1)计算温度为973K时,反应CO2(g)+H2(g) CO(g)+H2O(g) K=
CO(g)+H2O(g) K=__________ ;
(2)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
①该反应能够自发进行的原因是___________________________ 。
②下列措施中能使c(CH3OH)增大的是________ 。
a.降低温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
③在温度T1时,当反应达到平衡时,测得n(H2)=2.4 mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82 mol,则T2________ T1(填“>”、“<”或“=”)。
(3)某实验将一定量的CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
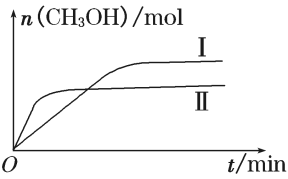
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ________ KⅡ(填“>”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的浓度相等,且起始时维持反应逆向进行,则c的取值范围为________________ 。
 FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表:| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)计算温度为973K时,反应CO2(g)+H2(g)
 CO(g)+H2O(g) K=
CO(g)+H2O(g) K=(2)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。
CH3OH(g)+H2O(g), 在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2进行反应。①该反应能够自发进行的原因是
②下列措施中能使c(CH3OH)增大的是
a.降低温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2
③在温度T1时,当反应达到平衡时,测得n(H2)=2.4 mol;其他条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82 mol,则T2
(3)某实验将一定量的CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g) +3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物 投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的浓度相等,且起始时维持反应逆向进行,则c的取值范围为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】结构和原理阐释化学反应的类型、限度、速率和历程是重要的化学学科思维。回答下列问题:
(1)用过氧化氢检验Cr(Ⅵ)的反应是Cr2O72-+4H2O2+2H+=2CrO5+5H2O。CrO5结构式为 ,该反应是否为氧化还原反应?
,该反应是否为氧化还原反应?___ (填“是”或“否”)。
(2)已知:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
H2(g)+O2(g)=H2O2(l) △H=-187.8kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) △H=___ kJ·mol-1。
(3)一定条件下,H2O2分解时的c(H2O2)随t变化如图所示。已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),k为速率常数。
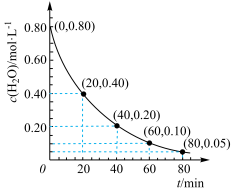
①0-20min内,v(H2O2)=___ 。
②据图分析,n=___ 。
③其它条件相同,使用活性更高的催化剂,下列说法正确的是___ (填标号)。
A.v(H2O2)增大 B.k增大 C.△H减小 D.Ea(活化能)不变
(4)气体分压pi=p总×xi(物质的量分数)。恒温50℃、恒压101kPa,将足量的CuSO4·5H2O、NaHCO3置于一个密闭容器中,再充入已除去CO2的干燥空气。假设只发生以下反应,达平衡时两者分解的物质的量比为2:1。
CuSO4·5H2O(s)⇌CuSO4·3H2O(s)+2H2O(g) Kp1=36(kPa)2
2NaHCO3(s)⇌Na2CO3(s)+H2O(g)+CO2(g) Kp2
①平衡时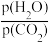 =
=___ ,Kp2=___ 。
②平衡后,用总压为101kPa的潮湿空气[其中p(H2O)=8kPa、p(CO2)=0.4kPa]替换容器中的气体,50℃下达到新平衡。容器内CuSO4·5H2O的质量将___ (填“增加”“减少”或“不变”,下同),NaHCO3质量将___ 。
(1)用过氧化氢检验Cr(Ⅵ)的反应是Cr2O72-+4H2O2+2H+=2CrO5+5H2O。CrO5结构式为
 ,该反应是否为氧化还原反应?
,该反应是否为氧化还原反应?(2)已知:
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
H2(g)+O2(g)=H2O2(l) △H=-187.8kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) △H=
(3)一定条件下,H2O2分解时的c(H2O2)随t变化如图所示。已知该反应的瞬时速率可表示为v(H2O2)=k·cn(H2O2),k为速率常数。

①0-20min内,v(H2O2)=
②据图分析,n=
③其它条件相同,使用活性更高的催化剂,下列说法正确的是
A.v(H2O2)增大 B.k增大 C.△H减小 D.Ea(活化能)不变
(4)气体分压pi=p总×xi(物质的量分数)。恒温50℃、恒压101kPa,将足量的CuSO4·5H2O、NaHCO3置于一个密闭容器中,再充入已除去CO2的干燥空气。假设只发生以下反应,达平衡时两者分解的物质的量比为2:1。
CuSO4·5H2O(s)⇌CuSO4·3H2O(s)+2H2O(g) Kp1=36(kPa)2
2NaHCO3(s)⇌Na2CO3(s)+H2O(g)+CO2(g) Kp2
①平衡时
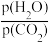 =
=②平衡后,用总压为101kPa的潮湿空气[其中p(H2O)=8kPa、p(CO2)=0.4kPa]替换容器中的气体,50℃下达到新平衡。容器内CuSO4·5H2O的质量将
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】 与
与 既是温室气体,又是丰富的碳源,研究
既是温室气体,又是丰富的碳源,研究 与
与 的化学转化和利用对于降低
的化学转化和利用对于降低 使用量、消除温室气体等具有重大意义。利用等离子体协同催化剂重整制合成气的反应原理为
使用量、消除温室气体等具有重大意义。利用等离子体协同催化剂重整制合成气的反应原理为 。
。
(1)已知:常温常压下, 、
、 、
、 的燃烧热如表:
的燃烧热如表:
则

___________  ,
,___________ (填“高温”、“低温”或“任何温度均”)有利于该反应自发进行。
(2)若在恒温恒容密闭容器中充入一定量的 与
与 ,下列条件能判断该反应达到平衡状态的是
,下列条件能判断该反应达到平衡状态的是___________ (填标号)。
a.容器中混合气体的密度保持不变
b. 的生成速率与CO的消耗速率相等
的生成速率与CO的消耗速率相等
c.容器中气体的平均摩尔质量保持不变
d. 的百分含量保持不变
的百分含量保持不变
(3)向某密闭容器中充入 和
和 ,测得平衡时
,测得平衡时 的体积分数与压强和温度的关系如图所示。
的体积分数与压强和温度的关系如图所示。
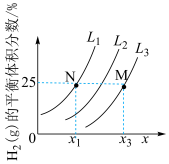
①x表示的是___________ (填“温度”或“压强”); 、
、 、
、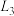 由大到小的顺序为
由大到小的顺序为___________ ;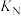
___________ (填“>”、“<”或“=”)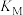 。
。
②N点时,甲烷的平衡转化率为___________ (保留3位有效数字)%。
③若N点时的总压强为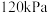 ,则N点所处条件下,该反应的压强平衡常数
,则N点所处条件下,该反应的压强平衡常数 [
[ 为用平衡分压代替平衡浓度表示的平衡常数(分压=总压×物质的量分数)]为
为用平衡分压代替平衡浓度表示的平衡常数(分压=总压×物质的量分数)]为___________  。
。
 与
与 既是温室气体,又是丰富的碳源,研究
既是温室气体,又是丰富的碳源,研究 与
与 的化学转化和利用对于降低
的化学转化和利用对于降低 使用量、消除温室气体等具有重大意义。利用等离子体协同催化剂重整制合成气的反应原理为
使用量、消除温室气体等具有重大意义。利用等离子体协同催化剂重整制合成气的反应原理为 。
。(1)已知:常温常压下,
 、
、 、
、 的燃烧热如表:
的燃烧热如表:| 物质 |  |  |  |
燃烧热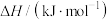 |  | 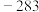 |  |


 ,
,(2)若在恒温恒容密闭容器中充入一定量的
 与
与 ,下列条件能判断该反应达到平衡状态的是
,下列条件能判断该反应达到平衡状态的是a.容器中混合气体的密度保持不变
b.
 的生成速率与CO的消耗速率相等
的生成速率与CO的消耗速率相等c.容器中气体的平均摩尔质量保持不变
d.
 的百分含量保持不变
的百分含量保持不变(3)向某密闭容器中充入
 和
和 ,测得平衡时
,测得平衡时 的体积分数与压强和温度的关系如图所示。
的体积分数与压强和温度的关系如图所示。
①x表示的是
 、
、 、
、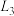 由大到小的顺序为
由大到小的顺序为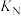
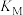 。
。②N点时,甲烷的平衡转化率为
③若N点时的总压强为
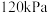 ,则N点所处条件下,该反应的压强平衡常数
,则N点所处条件下,该反应的压强平衡常数 [
[ 为用平衡分压代替平衡浓度表示的平衡常数(分压=总压×物质的量分数)]为
为用平衡分压代替平衡浓度表示的平衡常数(分压=总压×物质的量分数)]为 。
。
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氮的化合物应用广泛,但氮氧化物是主要的空气污染物,应降低其排放量。
(1) 用CO2和NH3可合成氮肥尿素[CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ·mol-1;
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ·mol-1;
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1。
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为_______ 。
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)ΔH在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:
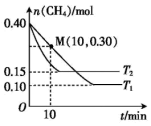
①据图判断该反应的ΔH_______ (填“>”“<”“=”)0,理由是 _______ 。
②温度为T1时,0~10 min内,NO2的平均反应速率v(NO2)=_______ 。
③该反应达到平衡后,为提高反应速率同时提高NO2的转化率,可采取的措施有_______ (填字母)。
A.改用高效催化剂 B.升高温度 C.缩小容器的体积 D.增大CH4的浓度
(3) 利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液。工作一段时间后,该电池正极附近溶液的pH_______ (填“增大” “减小”或“不变”),负极的电极反应式为_______ 。
(4)氮的一种氢化物为HN3,其水溶液酸性强弱与醋酸相似,25℃时,将a mol·L-1HN3与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N ),则该混合溶液呈
),则该混合溶液呈_______ (填“酸”“碱”或“中”)性,溶液中c(HN3)=_______ mol·L-1。此温度下Ka(HN3)=_______ (用a.b表示)
(1) 用CO2和NH3可合成氮肥尿素[CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ·mol-1;
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ·mol-1;
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1。
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)ΔH在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①据图判断该反应的ΔH
②温度为T1时,0~10 min内,NO2的平均反应速率v(NO2)=
③该反应达到平衡后,为提高反应速率同时提高NO2的转化率,可采取的措施有
A.改用高效催化剂 B.升高温度 C.缩小容器的体积 D.增大CH4的浓度
(3) 利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液。工作一段时间后,该电池正极附近溶液的pH
(4)氮的一种氢化物为HN3,其水溶液酸性强弱与醋酸相似,25℃时,将a mol·L-1HN3与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N
 ),则该混合溶液呈
),则该混合溶液呈
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______ (用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
①该反应的逆反应为______ (填“吸热”或“放热”)反应;实验2的平衡常数K=________ 。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______ (用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______ (填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
a.点②所示溶液中的电荷守恒式为________________________ 。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________ 。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________ mol/L。
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)
 H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
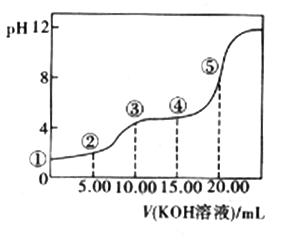
a.点②所示溶液中的电荷守恒式为
b.点③所示溶液中所有离子的浓度由大到小的顺序为
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=
您最近半年使用:0次
【推荐2】碳及其化合物在生产、生活中广泛存在。请回答下列问题:K=
 已知某温度下某反应的化学平衡常数表达式为:
已知某温度下某反应的化学平衡常数表达式为: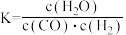 ,它所对应的化学反应为:
,它所对应的化学反应为:__________ 。
 已知在一定温度下,
已知在一定温度下,
①
 平衡常数
平衡常数
②
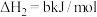 平衡常数
平衡常数
③
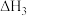 平衡常数
平衡常数
则 、
、 、
、 之间的关系是
之间的关系是
________ ,
___________  用含a、b的代数式表示
用含a、b的代数式表示 。
。
 煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:
煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: ;该反应平衡常数随温度的变化如表所示:
;该反应平衡常数随温度的变化如表所示:
该反应的正反应方向是____ 反应 填“吸热”或“放热”
填“吸热”或“放热” ,若在
,若在 时进行,设起始时CO和
时进行,设起始时CO和 的起始浓度均为
的起始浓度均为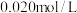 ,在该条件下,CO的平衡转化率为
,在该条件下,CO的平衡转化率为________ 。
 高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和 反应制备甲醇:
反应制备甲醇: 。请回答下列问题:
。请回答下列问题:
①若在相同温度和恒容且容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系不正确的是___________ 。

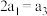



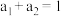

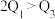
 该反应若生成
该反应若生成 ,则放出
,则放出 热量
热量
②若在一体积可变的密闭容器中充入 、
、 和
和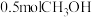 ,达到平衡时测得混合气体的密度是同温同压下起始的
,达到平衡时测得混合气体的密度是同温同压下起始的 倍,则该反应向
倍,则该反应向___  填“正”或“逆”
填“正”或“逆” 反应方向移动。
反应方向移动。
 已知某温度下某反应的化学平衡常数表达式为:
已知某温度下某反应的化学平衡常数表达式为: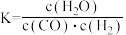 ,它所对应的化学反应为:
,它所对应的化学反应为: 已知在一定温度下,
已知在一定温度下,①

 平衡常数
平衡常数
②

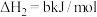 平衡常数
平衡常数
③

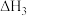 平衡常数
平衡常数
则
 、
、 、
、 之间的关系是
之间的关系是

 用含a、b的代数式表示
用含a、b的代数式表示 。
。 煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:
煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: ;该反应平衡常数随温度的变化如表所示:
;该反应平衡常数随温度的变化如表所示:温度 | 400 | 500 | 800 |
| 平衡常数K |  | 9 | 1 |
 填“吸热”或“放热”
填“吸热”或“放热” ,若在
,若在 时进行,设起始时CO和
时进行,设起始时CO和 的起始浓度均为
的起始浓度均为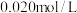 ,在该条件下,CO的平衡转化率为
,在该条件下,CO的平衡转化率为 高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和 反应制备甲醇:
反应制备甲醇: 。请回答下列问题:
。请回答下列问题:①若在相同温度和恒容且容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 |  的浓度 的浓度 | 能量变化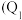 、 、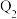 、 、 均大于 均大于 |
| 甲 | 1molCO和 | 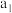 | 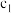 | 放出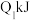 热量 热量 |
| 乙 |  | 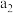 | 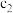 | 吸收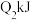 热量 热量 |
| 丙 | 2molCO和 | 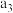 | 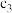 | 放出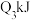 热量 热量 |

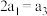



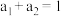

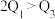
 该反应若生成
该反应若生成 ,则放出
,则放出 热量
热量②若在一体积可变的密闭容器中充入
 、
、 和
和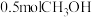 ,达到平衡时测得混合气体的密度是同温同压下起始的
,达到平衡时测得混合气体的密度是同温同压下起始的 倍,则该反应向
倍,则该反应向 填“正”或“逆”
填“正”或“逆” 反应方向移动。
反应方向移动。
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______ .
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别 加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g) CO2(g)+2H2(g)其相关数 据如下表所示:
CO2(g)+2H2(g)其相关数 据如下表所示:
①T1℃时,该反应的平衡常数
______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度____  填选项字母
填选项字母 .
.
A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入a mol CO2(g)和b mol H2(g),反应达到平衡时,测得CO2的转化率大于 的转化率,则
的转化率,则 的值需满足的条件为
的值需满足的条件为 ______ ;
④丁容器的容积为1L, 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______  填选项字母
填选项字母 .
.
A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0 mol、0 mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电 解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示

 甲醚燃料电池的负极反应式为
甲醚燃料电池的负极反应式为 ______
 口导出的物质为
口导出的物质为 ______  填化学式
填化学式 .
.
 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为 ______ .
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙
 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为 (2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别 加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)
 CO2(g)+2H2(g)其相关数 据如下表所示:
CO2(g)+2H2(g)其相关数 据如下表所示:| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mol | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 |  | 2 | 4 |  | 8 |
| 乙 | 1 |  | 1 | 2 |  | 3 |
①T1℃时,该反应的平衡常数

②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度
 填选项字母
填选项字母 .
.A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入a mol CO2(g)和b mol H2(g),反应达到平衡时,测得CO2的转化率大于
 的转化率,则
的转化率,则 的值需满足的条件为
的值需满足的条件为 ④丁容器的容积为1L,
 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是  填选项字母
填选项字母 .
.A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0 mol、0 mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电 解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示

 甲醚燃料电池的负极反应式为
甲醚燃料电池的负极反应式为  口导出的物质为
口导出的物质为  填化学式
填化学式 .
. 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为
您最近半年使用:0次



