将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A.b>f |
| B.平衡常数K(1000℃)<K(810℃) |
| C.915℃、2.0MPa该反应的平衡常数为Kp=4.5MPa |
| D.1000℃、3.0MPa时E的转化率为83% |
更新时间:2021-01-03 10:04:01
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)  x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是

 x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
| A.x可能为4 |
| B.M为容器甲 |
| C.容器乙达平衡时B的转化率为25% |
| D.M的平衡常数大于N |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知,t3~t4阶段为使用催化剂。下列说法不正确的是( )


| A.若t1=15 s,则用C的浓度变化表示在t0~t1时间段的平均反应速率为0.004 mol·L-1·s-1 |
| B.t4—t5阶段改变的条件一定是减小压强 |
| C.B的起始物质的量为0.02 mol |
D.t5—t6阶段,容器内A的物质的量减少了0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g) B(g)+2C(g)△H=+100a kJ/mol B(g)+2C(g)△H=+100a kJ/mol |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】可逆反应①X(g)+2Y(g) ⇌ 2Z(g); ②2M(g) ⇌ N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可运动的密封圆板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是

下列判断正确的是
| A.反应①的正反应是吸热反应 |
| B.达平衡(I)时,X的转化率约为45% |
| C.在平衡(I)和平衡(Ⅱ)中,M的体积分数相等 |
| D.达平衡(I)时体系的压强与反应开始时体系的压强之比为11∶10 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】恒压密闭容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应2H2S(g)+CH4(g) CS2(g)+4H2(g) ΔH。0.11MPa时,温度变化对平衡时各物质的物质的量分数的影响如图所示。下列说法正确的是
CS2(g)+4H2(g) ΔH。0.11MPa时,温度变化对平衡时各物质的物质的量分数的影响如图所示。下列说法正确的是
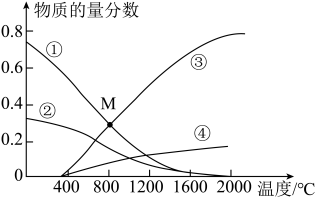
 CS2(g)+4H2(g) ΔH。0.11MPa时,温度变化对平衡时各物质的物质的量分数的影响如图所示。下列说法正确的是
CS2(g)+4H2(g) ΔH。0.11MPa时,温度变化对平衡时各物质的物质的量分数的影响如图所示。下列说法正确的是 
| A.ΔH<0 |
| B.将CS2液化或提高H2S与CH4物质的量的比例均可提高H2S的平衡转化率 |
| C.若向容器中充入Ar(g),反应速率不变,平衡不移动 |
| D.M点的Kp=8×10-4(MPa)2(Kp为以分压表示的平衡常数) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】中国旅美教授JingjieWu及其学生利用石墨烯量子点为催化剂,将 转化为燃料甲烷,空间站基于该反应将宇航员呼出的
转化为燃料甲烷,空间站基于该反应将宇航员呼出的 转化为火箭燃料。将
转化为火箭燃料。将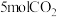 和
和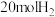 通入某恒压(压强为
通入某恒压(压强为 )密闭容器中,发生如下反应:
)密闭容器中,发生如下反应:
I.
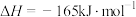 (主反应)
(主反应)
II.
 (副反应)
(副反应)
平衡时容器中含碳元素物质的物质的量 随温度
随温度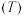 的变化如图甲、乙、丙曲线所示:
的变化如图甲、乙、丙曲线所示:

下列说法正确的是
 转化为燃料甲烷,空间站基于该反应将宇航员呼出的
转化为燃料甲烷,空间站基于该反应将宇航员呼出的 转化为火箭燃料。将
转化为火箭燃料。将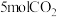 和
和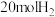 通入某恒压(压强为
通入某恒压(压强为 )密闭容器中,发生如下反应:
)密闭容器中,发生如下反应:I.

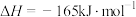 (主反应)
(主反应)II.

 (副反应)
(副反应)平衡时容器中含碳元素物质的物质的量
 随温度
随温度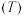 的变化如图甲、乙、丙曲线所示:
的变化如图甲、乙、丙曲线所示:
下列说法正确的是
A.空间站中使 转化为燃料 转化为燃料 的反应可以采用高温 的反应可以采用高温 |
B.曲线甲、乙、丙分别表示 |
C. 后,曲线丙逐渐下降的原因是以反应 后,曲线丙逐渐下降的原因是以反应 为主 为主 |
D. 时反应I的压强平衡常数 时反应I的压强平衡常数 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应:3A(g)+B(g) xC(g)+2D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论不正确的是
xC(g)+2D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论不正确的是
 xC(g)+2D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论不正确的是
xC(g)+2D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论不正确的是| A.A的平均反应速率为0.15mol/(L·min) |
| B.平衡时,A的转化率为20% |
| C.平衡时,C的浓度为 0.25 mol/L |
| D.容器内的起始压强和平衡压强之比为11:10 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
下列说法正确的是
 N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
| A.T2时,CH4的平衡转化率为30.0% |
| B.该反应的△H>0、T1<T2 |
| C.保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80mol H2O(g),平衡向正反应方向移动 |
| D.保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】在温度、容积相同的3个密闭容器中按不同方式投入反应物,保持恒温恒容,测得反应达到平衡时的有关数据如下(已知:N2(g)+3H2(g) 2NH3(g) ΔH=92.4kJ/mol)
2NH3(g) ΔH=92.4kJ/mol)
下列说法正确的是( )
 2NH3(g) ΔH=92.4kJ/mol)
2NH3(g) ΔH=92.4kJ/mol)| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2 3H2 mol | 2mol NH3 | 2mol N2 6molH2 |
| NH3浓度(mol·L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出a KJ | 吸收b KJ | 放出cKJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
| A.C1+C2=C3 | B.α2+α3>1 | C.P1+P2<P3 | D.a=b<92.4 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】丙酮的碘代反应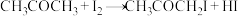 的速率方程为
的速率方程为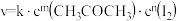 ,其半衰期(反应物浓度降低为起始浓度的
,其半衰期(反应物浓度降低为起始浓度的 所需的时间)为
所需的时间)为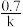 (k为速率方程中k)。改变反应物浓度时,反应的瞬时速率如表所示。
(k为速率方程中k)。改变反应物浓度时,反应的瞬时速率如表所示。
下列说法正确的是
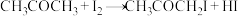 的速率方程为
的速率方程为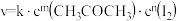 ,其半衰期(反应物浓度降低为起始浓度的
,其半衰期(反应物浓度降低为起始浓度的 所需的时间)为
所需的时间)为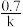 (k为速率方程中k)。改变反应物浓度时,反应的瞬时速率如表所示。
(k为速率方程中k)。改变反应物浓度时,反应的瞬时速率如表所示。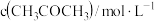 | 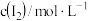 | 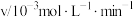 |
 | 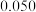 |  |
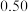 | 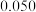 |  |
 | 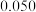 | 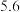 |
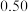 |  |  |
A.速率方程中的 、 、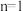 | B.该反应的速率常数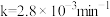 |
C.增大 的浓度,反应的瞬时速率加快 的浓度,反应的瞬时速率加快 | D.该反应的半衰期为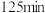 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的 NO,进行反应C(s)+2NO(g)  N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )

 N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
| A.达到平衡状态时,2v 正(NO)= v 逆(N2) |
| B.活性炭的质量不再改变不能说明反应已达平衡状态 |
| C.丙容器中,从反应开始到建立平衡时的平均反应速率为 v (NO) >0.01125mol·L-1·min-1 |
| D.由表格数据可知:T<400℃ |
您最近一年使用:0次

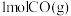 和
和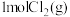 发生反应:
发生反应: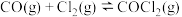
 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是


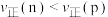
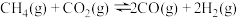 ,测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是
,测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是


