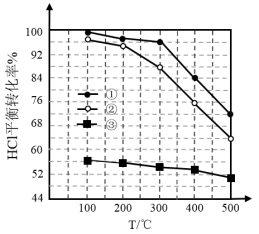
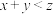随着聚酯工业的快速发展,氯化氢的产出量迅速增长。将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的催化氧化法为:4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)。下图为体积不变的密闭容器中,进料总物质的量一定,进料比c(HCl)∶c(O2)分别为1∶1、4∶1、7∶1时HCl的平衡转化率随温度变化的关系。下列说法正确的是
2Cl2(g)+2H2O(g)。下图为体积不变的密闭容器中,进料总物质的量一定,进料比c(HCl)∶c(O2)分别为1∶1、4∶1、7∶1时HCl的平衡转化率随温度变化的关系。下列说法正确的是
 2Cl2(g)+2H2O(g)。下图为体积不变的密闭容器中,进料总物质的量一定,进料比c(HCl)∶c(O2)分别为1∶1、4∶1、7∶1时HCl的平衡转化率随温度变化的关系。下列说法正确的是
2Cl2(g)+2H2O(g)。下图为体积不变的密闭容器中,进料总物质的量一定,进料比c(HCl)∶c(O2)分别为1∶1、4∶1、7∶1时HCl的平衡转化率随温度变化的关系。下列说法正确的是
A.反应4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)的ΔH>0 2Cl2(g)+2H2O(g)的ΔH>0 |
| B.①对应的曲线表示的c(HCl)∶c(O2)=7∶1 |
C.300℃时,对于②表示的反应,若压缩容器的体积增大压强,则达到平衡时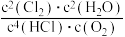 不变 不变 |
| D.对于③表示的反应,与100℃时相比,用更高效的催化剂在常温下反应不能改变HCl的平衡转化率 |
更新时间:2021/02/23 20:23:13
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】5 mL 0.1mol·L−1KI溶液与10 mL 0.1 mol·L−1FeCl3溶液发生反应:2Fe3+(aq)+2I−(aq) 2Fe2+(aq)+I2(aq),达到平衡。下别说法不正确的是
2Fe2+(aq)+I2(aq),达到平衡。下别说法不正确的是
 2Fe2+(aq)+I2(aq),达到平衡。下别说法不正确的是
2Fe2+(aq)+I2(aq),达到平衡。下别说法不正确的是| A.加入一定量铁粉,平衡逆向移动 |
| B.向该水溶液中加入CCl4,振荡,平衡正向移动 |
| C.经过CCl4多次萃取分离后,向水溶液中滴加KSCN溶液,若溶液出现血红色,证明该化学反应存在限度 |
D.该反应的平衡常数K= |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知苯酚(C6H5OH)与Fe3+反应生成[Fe(C6H5O)6]3-(紫色)。将6mL0. 1mol·L-1KI溶液和1mL 0.1 mol·L-1FeCl3溶液混合,发生反应:2Fe3+(aq) +2I-( aq)  2Fe2+ (aq) +I2(aq) ,下列有关该反应的说法错误的是
2Fe2+ (aq) +I2(aq) ,下列有关该反应的说法错误的是
 2Fe2+ (aq) +I2(aq) ,下列有关该反应的说法错误的是
2Fe2+ (aq) +I2(aq) ,下列有关该反应的说法错误的是| A.加入2 mL四氯化碳,振荡,平衡向右移动 |
| B.经四氯化碳多次萃取,在分离后的水溶液中滴加苯酚溶液,若溶液呈紫色,说明该反应是可逆反应 |
| C.加入少量I2固体,平衡向左移动 |
D.平衡常数的表达式为K=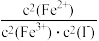 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1,达到化学平衡状态时,下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ·mol-1,达到化学平衡状态时,下列说法正确的是( )
 2NH3(g) ΔH=-92.4kJ·mol-1,达到化学平衡状态时,下列说法正确的是( )
2NH3(g) ΔH=-92.4kJ·mol-1,达到化学平衡状态时,下列说法正确的是( )| A.降低温度,可提高反应速率 |
| B.反应物和生成物的浓度都不再发生变化 |
| C.N2的正反应速率等于NH3的逆反应速率 |
| D.加入合适的催化剂,可提高N2的转化率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列实验操作不能达到实验目的的是
| A | B | C | D |
| 探究温度对化学平衡的影响 | 探究不同催化剂的催化能力 | 探究浓度对化学平衡的影响 | 验证Ksp(AgI)<Ksp(AgCl) |
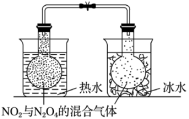 | 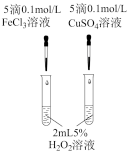 | 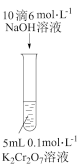 | 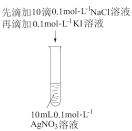 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知反应A2(g)+2B2(g) 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是
 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或增大压强都有利于该反应平衡逆向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】甲醇是一种绿色能源。工业上用 和CO合成
和CO合成 的反应为
的反应为 。将2 mol
。将2 mol  和1 mol CO充入1 L密闭容器中,在恒温恒压条件下,充分反应一段时间后达到平衡状态1。下列说法不正确的是
和1 mol CO充入1 L密闭容器中,在恒温恒压条件下,充分反应一段时间后达到平衡状态1。下列说法不正确的是
 和CO合成
和CO合成 的反应为
的反应为 。将2 mol
。将2 mol  和1 mol CO充入1 L密闭容器中,在恒温恒压条件下,充分反应一段时间后达到平衡状态1。下列说法不正确的是
和1 mol CO充入1 L密闭容器中,在恒温恒压条件下,充分反应一段时间后达到平衡状态1。下列说法不正确的是| A.若反应在恒温恒容条件下进行,平衡时CO的转化率小于平衡状态1的 |
B.容器中CO和 的体积分数之比保持不变不能说明反应达到平衡状态 的体积分数之比保持不变不能说明反应达到平衡状态 |
C.若平衡状态1中再充入a mol  ,达到新平衡时, ,达到新平衡时, 的体积分数比原平衡状态的小 的体积分数比原平衡状态的小 |
D.若平衡状态1中通入 ,达到新平衡时, ,达到新平衡时, 的平衡浓度减小 的平衡浓度减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】根据下列图示所得出的结论正确的是


A.图甲表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0 |
| C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 |
| D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】羰基硫(COS)催化水解的反应为:COS(g)+H2O(g) CO2(g)+H2S(g) △H<0,在相同投料比、相同气流速度、相同时间内,测得不同温度及不同催化剂下COS水解反应的转化率如图所示,下列说法正确的是
CO2(g)+H2S(g) △H<0,在相同投料比、相同气流速度、相同时间内,测得不同温度及不同催化剂下COS水解反应的转化率如图所示,下列说法正确的是
 CO2(g)+H2S(g) △H<0,在相同投料比、相同气流速度、相同时间内,测得不同温度及不同催化剂下COS水解反应的转化率如图所示,下列说法正确的是
CO2(g)+H2S(g) △H<0,在相同投料比、相同气流速度、相同时间内,测得不同温度及不同催化剂下COS水解反应的转化率如图所示,下列说法正确的是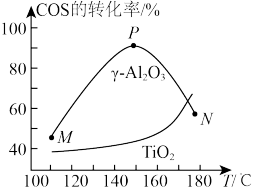
| A.该反应M点未达到平衡状态,N点已达到平衡状态 |
| B.正反应的平均反应速率:P>N>M |
| C.任何温度下,γ-Al2O3的催化效果都比TiO2好 |
| D.150℃,用γ-Al2O3做催化剂达到平衡时CO2的体积分数最大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】在压强、CO2和H2起始投料一定的条件下,发生反应Ⅰ、Ⅱ:
反应Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) ΔH1=-49.0kJ•mol-1
反应Ⅱ.2CO2(g)+5H2(g) C2H2(g)+4H2O(g) ΔH1=+37.1kJ•mol-1
C2H2(g)+4H2O(g) ΔH1=+37.1kJ•mol-1
实验测得CO2的平衡转化率和平衡时CH3OH的选择性(CH3OH的选择性=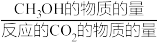 ×100%)随温度的变化如图所示。下列说法正确的是
×100%)随温度的变化如图所示。下列说法正确的是

反应Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) ΔH1=-49.0kJ•mol-1反应Ⅱ.2CO2(g)+5H2(g)
 C2H2(g)+4H2O(g) ΔH1=+37.1kJ•mol-1
C2H2(g)+4H2O(g) ΔH1=+37.1kJ•mol-1实验测得CO2的平衡转化率和平衡时CH3OH的选择性(CH3OH的选择性=
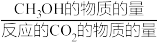 ×100%)随温度的变化如图所示。下列说法正确的是
×100%)随温度的变化如图所示。下列说法正确的是
| A.曲线②表示CO2的平衡转化率 |
| B.其他条件不变,升高温度,C2H2的含量增大 |
| C.温度高于280℃时,曲线①随温度升高而升高说明此时主要发生反应Ⅰ |
| D.同时提高CO2的平衡转化率和平衡时CH3OH的选择性,应选择在低温低压条件下反应 |
您最近一年使用:0次



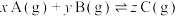 ,达到平衡时,测得A的浓度为
,达到平衡时,测得A的浓度为 ,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测得A的浓度降低为
,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测得A的浓度降低为 ,下列有关判断正确的是
,下列有关判断正确的是