甲醇是一种可再生能源,由CO2制备甲醇可能涉及的反应如下:
反应I:CO2(g)+3H2=CH3OH+H2O(g) ΔH1=-49.58 kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的ΔH2=_______ ,若反应I、II、III平衡常数分别为K1、K2、K3,则K2=_______ (用K1、K3表示)。
(2)反应II自发进行的条件是_______ (填“低温”“高温”或“任意温度”)。
(3)在一定条件下,2L恒容密闭容器中充入3molH2和1.5molCO2,仅发生反应I,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示。
①T_______ 500℃(填“<”“>”或“=”)
②温度为500℃时,该反应10min时达到平衡,则用H2表示的反应速率为_______ ,该温度下,反应I的平衡常数K1=_______ 。
(4)某研究小组将一定量的H2和CO2充入恒温密闭容器中,加入合适的催化剂(发生反应I、II、III),测得不同温度下体系达到平衡时,CO2的转化率和CH3OH的产率如图所示。
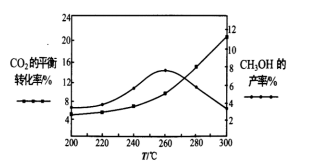
①该反应达到平衡后,为了同时提高反应速率和甲醇的产量,以下措施一定可行的是___ (填标号)。
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2浓度
②温度高于260℃时,随温度的升高甲醇产率下降的原因是_______ 。
反应I:CO2(g)+3H2=CH3OH+H2O(g) ΔH1=-49.58 kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的ΔH2=
(2)反应II自发进行的条件是
(3)在一定条件下,2L恒容密闭容器中充入3molH2和1.5molCO2,仅发生反应I,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示。
温度/℃ | 500 | T |
CO2的平衡转化率 | 60% | 40% |
①T
②温度为500℃时,该反应10min时达到平衡,则用H2表示的反应速率为
(4)某研究小组将一定量的H2和CO2充入恒温密闭容器中,加入合适的催化剂(发生反应I、II、III),测得不同温度下体系达到平衡时,CO2的转化率和CH3OH的产率如图所示。

①该反应达到平衡后,为了同时提高反应速率和甲醇的产量,以下措施一定可行的是
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2浓度
②温度高于260℃时,随温度的升高甲醇产率下降的原因是
21-22高三上·湖北武汉·阶段练习 查看更多[3]
更新时间:2021-02-23 20:55:02
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】环氧乙烷可用于口罩等医用品的消毒。工业上以乙烯为原料利用氧化法生产环氧乙烷,涉及如下反应:
I.2CH2=CH2(g)+O2(g) 2
2 ∆H1=-210kJ∙mol-1
∆H1=-210kJ∙mol-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l) ∆H2=-1413.0kJ∙mol-1
已知:环氧乙烷的选择性=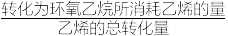 。
。
回答下列问题:
(1)环氧乙烷的燃烧热(∆H)=_______ kJ·mol-1。
(2)反应II在_______ (填“低温”或“高温”)下自发进行。
(3)一定条件下,在一密闭容器中只发生反应I,达到平衡后,再压缩容器体积,环氧乙烷的产率将_______ (填“增大”或“减小”,下同),乙烯的浓度将_______ 。
(4)在一定温度和压强下,为了增大反应速率和环氧乙烷的选择性,应_______ 。
(5)向一密闭容器中通入2molCH2=CH2(g)和1.5molO2(g),乙烯的平衡转化率、环氧乙烷的选择性与温度或压强的关系如图所示。

①图中X代表_______ (填“温度”或“压强”)。
②M、P两点正反应速率较大的是_______ (填“M”或“P”)点,理由是_______ 。
③在x和L2的条件下,达到平衡时容器的体积为1L,反应II的平衡常数是_______ (结果精确到0.001)L2·mol-2。
I.2CH2=CH2(g)+O2(g)
 2
2 ∆H1=-210kJ∙mol-1
∆H1=-210kJ∙mol-1II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l) ∆H2=-1413.0kJ∙mol-1
已知:环氧乙烷的选择性=
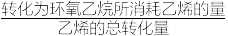 。
。回答下列问题:
(1)环氧乙烷的燃烧热(∆H)=
(2)反应II在
(3)一定条件下,在一密闭容器中只发生反应I,达到平衡后,再压缩容器体积,环氧乙烷的产率将
(4)在一定温度和压强下,为了增大反应速率和环氧乙烷的选择性,应
(5)向一密闭容器中通入2molCH2=CH2(g)和1.5molO2(g),乙烯的平衡转化率、环氧乙烷的选择性与温度或压强的关系如图所示。

①图中X代表
②M、P两点正反应速率较大的是
③在x和L2的条件下,达到平衡时容器的体积为1L,反应II的平衡常数是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是_______ 。
(2)已知:2Cu(s)+ O2(g)=Cu2O(s) ∆H=-akJ·mol-1
O2(g)=Cu2O(s) ∆H=-akJ·mol-1
C(s)+ O2(g)=CO(g) ∆H=-bkJ·mol-1
O2(g)=CO(g) ∆H=-bkJ·mol-1
Cu(s)+ O2(g)=CuO(s) ∆H=-ckJ·mol-1
O2(g)=CuO(s) ∆H=-ckJ·mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);∆H=_______ kJ·mol-1。
(3)方法III为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为_______ 。
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:2H2O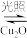 2H2(g)+O2(g) ΔH>0,水蒸气的浓度随时间t变化如下表所示。
2H2(g)+O2(g) ΔH>0,水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是_______ (填字母代号)。
A.实验温度:T1<T2
B.实验②比实验①所用的催化剂效率低
C.实验①前20min的平均反应速率v(O2)=7×10-5mol·L-1min-1
D.T2条件下该反应的化学平衡常数为6.17×10-5mol/L
(5)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀,若已知Ksp(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=_______ 。(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL0.01mol/L盐酸,是否继续产生沉淀_______ (填“是”或“否”)。
| 方法I | 用炭粉在高温条件下还原CuO |
| 方法II | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
| 方法III | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法I,其原因是
(2)已知:2Cu(s)+
 O2(g)=Cu2O(s) ∆H=-akJ·mol-1
O2(g)=Cu2O(s) ∆H=-akJ·mol-1C(s)+
 O2(g)=CO(g) ∆H=-bkJ·mol-1
O2(g)=CO(g) ∆H=-bkJ·mol-1Cu(s)+
 O2(g)=CuO(s) ∆H=-ckJ·mol-1
O2(g)=CuO(s) ∆H=-ckJ·mol-1则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);∆H=
(3)方法III为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:2H2O
 2H2(g)+O2(g) ΔH>0,水蒸气的浓度随时间t变化如下表所示。
2H2(g)+O2(g) ΔH>0,水蒸气的浓度随时间t变化如下表所示。| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是
A.实验温度:T1<T2
B.实验②比实验①所用的催化剂效率低
C.实验①前20min的平均反应速率v(O2)=7×10-5mol·L-1min-1
D.T2条件下该反应的化学平衡常数为6.17×10-5mol/L
(5)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀,若已知Ksp(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=
您最近一年使用:0次
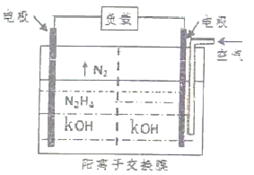
【推荐3】氨和肼(N2H4)都是氮元素的重要氢化物,在工农业生产、生活中有广泛应用。
(1)工业中常用以下反应合成氨:N2+3H2 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:

装置③仅有一个反应条件与①不同,该条件为_______________ ,实验②平衡时H2的转化率为_____________ ;
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为_____________________________________________________ 。
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为_________ kJ。(假设空气中氧气的体积含量为20%,产物为液态水)
(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为____________ .(已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)
N2H5+的K=8.7×107;KW=1.0×10-14)
(1)工业中常用以下反应合成氨:N2+3H2
 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示:
装置③仅有一个反应条件与①不同,该条件为
(2)肼是一种具有强还原性的无色油状液体,可用作燃料。
①在火箭推进器中装有胼(N2H4)和液态H2O2,已知0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量。该反应的热化学方程式为
②肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液。已知肼在101kPa、25℃条件下的燃烧热为624kJ·mol-1,如果此燃料电池的能量转化率为50%,当消耗空气2.24L(已折算为标准状况下体积)时,则此电池产生的电能约为

(3)肼又称“联氨”,为二元弱碱,在水中的电离方程式与氨相似,肼第一步电离反应的平衡常数值为
 N2H5+的K=8.7×107;KW=1.0×10-14)
N2H5+的K=8.7×107;KW=1.0×10-14)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】不同的化学反应具有不同的反应热,人们可以通过不同的方法获得反应热数据,可以实验测定,也可以理论推算。
(1)已知:在稀溶液中,强酸与强碱发生中和反应生成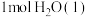 时释放的热量为
时释放的热量为 ,若改用醋酸与氢氧化钠溶液进行测量中和热,测量值
,若改用醋酸与氢氧化钠溶液进行测量中和热,测量值_______ (填偏大或偏小),写出醋酸电离方程式并分析误差原因_______ ,某化学兴趣小组用盐酸, 溶液(稍过量)进行中和热测定,计算结果
溶液(稍过量)进行中和热测定,计算结果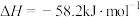 ,其原因可能是
,其原因可能是_______ 。(填字母标号)
A.盐酸与 溶液混合后立即记录温度 B.分三次将盐酸溶液缓慢倒入
溶液混合后立即记录温度 B.分三次将盐酸溶液缓慢倒入 溶液中
溶液中
C.用量筒量取盐酸时仰视读数 D.使用玻璃搅拌器搅拌
(2)标准状况下,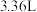 仅由C、H两种元素组成的某气体质量为
仅由C、H两种元素组成的某气体质量为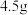 ,在25℃和
,在25℃和 下完全燃烧生成
下完全燃烧生成 和
和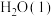 时,放出
时,放出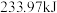 的热量。
的热量。
①该气体的分子式为_______ 。
②表示该气体燃烧热的热化学方程式为_______
(3)2022年北京冬奥会用 作为火炬燃料,而热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下所示:
作为火炬燃料,而热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下所示:
反应I:
反应II: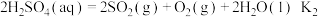
反应I: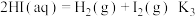
则反应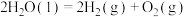

_______ 。(用 表示)
表示)
2008年北京奥运会火炬燃料是丙烷( ),已知丙烷的燃烧热为
),已知丙烷的燃烧热为 ,氢气的燃烧热为
,氢气的燃烧热为 。室温下将
。室温下将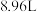 (已折算为标准状况下体积)
(已折算为标准状况下体积) 和
和 的混合气体完全燃烧,共放
的混合气体完全燃烧,共放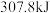 热量,则该混合气体中
热量,则该混合气体中 和
和 的体积比为
的体积比为_______ 。
(1)已知:在稀溶液中,强酸与强碱发生中和反应生成
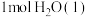 时释放的热量为
时释放的热量为 ,若改用醋酸与氢氧化钠溶液进行测量中和热,测量值
,若改用醋酸与氢氧化钠溶液进行测量中和热,测量值 溶液(稍过量)进行中和热测定,计算结果
溶液(稍过量)进行中和热测定,计算结果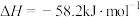 ,其原因可能是
,其原因可能是A.盐酸与
 溶液混合后立即记录温度 B.分三次将盐酸溶液缓慢倒入
溶液混合后立即记录温度 B.分三次将盐酸溶液缓慢倒入 溶液中
溶液中C.用量筒量取盐酸时仰视读数 D.使用玻璃搅拌器搅拌
(2)标准状况下,
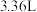 仅由C、H两种元素组成的某气体质量为
仅由C、H两种元素组成的某气体质量为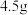 ,在25℃和
,在25℃和 下完全燃烧生成
下完全燃烧生成 和
和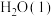 时,放出
时,放出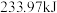 的热量。
的热量。①该气体的分子式为
②表示该气体燃烧热的热化学方程式为
(3)2022年北京冬奥会用
 作为火炬燃料,而热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下所示:
作为火炬燃料,而热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下所示:反应I:

反应II:
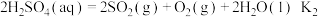
反应I:
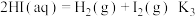
则反应
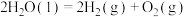

 表示)
表示)2008年北京奥运会火炬燃料是丙烷(
 ),已知丙烷的燃烧热为
),已知丙烷的燃烧热为 ,氢气的燃烧热为
,氢气的燃烧热为 。室温下将
。室温下将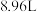 (已折算为标准状况下体积)
(已折算为标准状况下体积) 和
和 的混合气体完全燃烧,共放
的混合气体完全燃烧,共放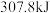 热量,则该混合气体中
热量,则该混合气体中 和
和 的体积比为
的体积比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】炼铁高炉尾气中可发生反应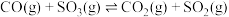 。已知:
。已知:
①
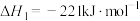 ;
;
②
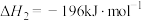 。
。
回答下列问题:
(1)计算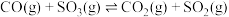

___________ 。
(2)反应①、②的平衡常数分别用 ,
, 表示,则反应
表示,则反应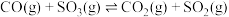 的平衡常数
的平衡常数
___________ (用 、
、 表示)。高炉尾气处理常使用催化剂,下列说法正确的是
表示)。高炉尾气处理常使用催化剂,下列说法正确的是___________ 。
A.使用催化剂可以降低活化能
B.使用催化剂可以增大反应的平衡常数
C.使用催化剂可以增大平衡时的反应物转化率
D.使用催化剂可以增大活化分子百分数
(3)对于反应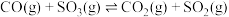 ,下列条件可以加快反应速率,并能提高
,下列条件可以加快反应速率,并能提高 转化率的是___________。
转化率的是___________。
(4)在723K时,将
 和
和
 通入抽空的2L恒容密闭容器中,发生如下反应:
通入抽空的2L恒容密闭容器中,发生如下反应: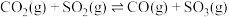 ,经过
,经过 达到平衡,
达到平衡, 的物质的量分数为10%,
的物质的量分数为10%, 的平衡转化率等于
的平衡转化率等于___________ ,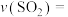
___________ ,反应平衡常数
___________ (保留两位有效数字)。
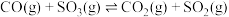 。已知:
。已知:①

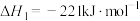 ;
;②

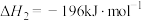 。
。回答下列问题:
(1)计算
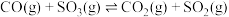

(2)反应①、②的平衡常数分别用
 ,
, 表示,则反应
表示,则反应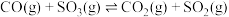 的平衡常数
的平衡常数
 、
、 表示)。高炉尾气处理常使用催化剂,下列说法正确的是
表示)。高炉尾气处理常使用催化剂,下列说法正确的是A.使用催化剂可以降低活化能
B.使用催化剂可以增大反应的平衡常数
C.使用催化剂可以增大平衡时的反应物转化率
D.使用催化剂可以增大活化分子百分数
(3)对于反应
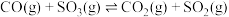 ,下列条件可以加快反应速率,并能提高
,下列条件可以加快反应速率,并能提高 转化率的是___________。
转化率的是___________。| A.升高温度 | B.缩小容器体积 |
C.再向容器中充入 | D.恒容条件下,充入稀有气体 |

 和
和
 通入抽空的2L恒容密闭容器中,发生如下反应:
通入抽空的2L恒容密闭容器中,发生如下反应: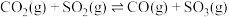 ,经过
,经过 达到平衡,
达到平衡, 的物质的量分数为10%,
的物质的量分数为10%, 的平衡转化率等于
的平衡转化率等于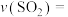

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】苯乙烯(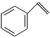 )是合成树脂、离子交换树脂及合成橡胶等的重要单体。目前生产苯乙烯的主要方法是乙苯催化脱氢法,其反应原理为:
)是合成树脂、离子交换树脂及合成橡胶等的重要单体。目前生产苯乙烯的主要方法是乙苯催化脱氢法,其反应原理为:
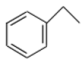 (g)
(g)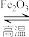
 (g)+H2(g)∆H2=+120kJ∙mol-1
(g)+H2(g)∆H2=+120kJ∙mol-1
(1)其他条件不变时,升高反应温度,乙苯的转化率___________ ,反应速率___________ 。(填“增大”“减小”或“不变”)。
(2)通入水蒸气可延缓催化剂 被还原而失活,其原因是
被还原而失活,其原因是______ (用化学平衡原理解释)。
(3)一定条件下,在体积不变的密闭容器中上述反应达到平衡,在t1时刻加入 ,t2时刻反应再次达到平衡,反应过程中各物质浓度随时间变化的关系如图所示。
,t2时刻反应再次达到平衡,反应过程中各物质浓度随时间变化的关系如图所示。
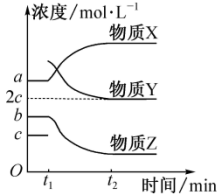
①物质X为___________ (填名称),判断理由是___________ 。
②t2时刻,苯乙烯的浓度为___________ 。
③ 时间内,乙苯的反应速率为
时间内,乙苯的反应速率为___________ 。
 )是合成树脂、离子交换树脂及合成橡胶等的重要单体。目前生产苯乙烯的主要方法是乙苯催化脱氢法,其反应原理为:
)是合成树脂、离子交换树脂及合成橡胶等的重要单体。目前生产苯乙烯的主要方法是乙苯催化脱氢法,其反应原理为: (g)
(g)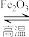
 (g)+H2(g)∆H2=+120kJ∙mol-1
(g)+H2(g)∆H2=+120kJ∙mol-1(1)其他条件不变时,升高反应温度,乙苯的转化率
(2)通入水蒸气可延缓催化剂
 被还原而失活,其原因是
被还原而失活,其原因是(3)一定条件下,在体积不变的密闭容器中上述反应达到平衡,在t1时刻加入
 ,t2时刻反应再次达到平衡,反应过程中各物质浓度随时间变化的关系如图所示。
,t2时刻反应再次达到平衡,反应过程中各物质浓度随时间变化的关系如图所示。
①物质X为
②t2时刻,苯乙烯的浓度为
③
 时间内,乙苯的反应速率为
时间内,乙苯的反应速率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】向一体积不变的密闭容器中充入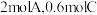 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中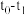 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且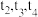 各改变一种不同的条件。
各改变一种不同的条件。
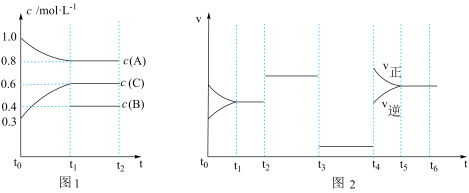
(1) 时改变的条件为
时改变的条件为___________ ,B的起始物质的量为____________ 。
(2)各阶段平衡时对应的平衡常数如下表所示:
则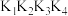 之间的关系为
之间的关系为___________ 。(用“>”、“<”或“=”)。
(3)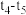 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________ 。
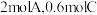 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中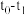 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且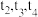 各改变一种不同的条件。
各改变一种不同的条件。
(1)
 时改变的条件为
时改变的条件为(2)各阶段平衡时对应的平衡常数如下表所示:
 |  | 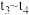 | 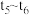 |
 |  |  | 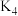 |
则
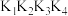 之间的关系为
之间的关系为(3)
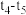 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.回答下列问题:
(1)二氧化碳、二氧化硫和氮氧化物( )对环境都有很大影响,采用化学方法进行合理利用和转化是消除其影响的重要措施。
)对环境都有很大影响,采用化学方法进行合理利用和转化是消除其影响的重要措施。 、
、 在一定条件下可转化为无害气体,其反应为
在一定条件下可转化为无害气体,其反应为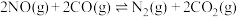
 。
。
某研究小组将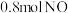 和
和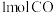 充入体积为
充入体积为 的恒容密闭容器中,在不同温度下
的恒容密闭容器中,在不同温度下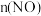 随反应时间的变化如图所示。
随反应时间的变化如图所示。
已知: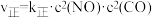 ,
,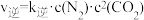 。(
。( 、
、 为速率常数,只与温度有关)
为速率常数,只与温度有关)
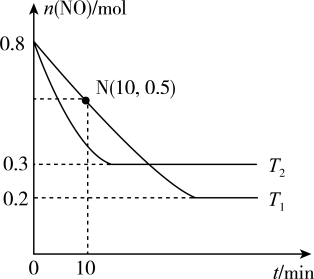
①该反应的
_______ 0(填“ ”、“
”、“ ”或“
”或“ ”)
”)
② 时,
时, 内用
内用 表示的平均反应速率
表示的平均反应速率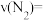
_______ 。
③下列措施能使生成 的反应速率增大的是
的反应速率增大的是_______ 。(填序号)
A. 使用催化剂 B. 充入稀有气体 C. 降低反应温度 D. 将 及时分离出来
及时分离出来
④ 时,
时,
_______ 。
II.在一固定容积的密闭容器中,进行如下化学反应: ,其化学平衡常数
,其化学平衡常数 和温度
和温度 的关系如表:
的关系如表:
试回答下列问题:
(2)能判断该反应是否达到化学平衡状态的依据是_______。
(3) 时,向固定容积的密闭容器中放入混合物,起始浓度分别为
时,向固定容积的密闭容器中放入混合物,起始浓度分别为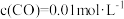 ,
,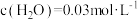 ,
,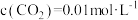 ,
,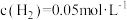 ,则反应开始时,
,则反应开始时, 的消耗速率比生成速率
的消耗速率比生成速率_______ (填“大”“小”或“不确定”)。
(1)二氧化碳、二氧化硫和氮氧化物(
 )对环境都有很大影响,采用化学方法进行合理利用和转化是消除其影响的重要措施。
)对环境都有很大影响,采用化学方法进行合理利用和转化是消除其影响的重要措施。 、
、 在一定条件下可转化为无害气体,其反应为
在一定条件下可转化为无害气体,其反应为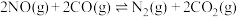
 。
。某研究小组将
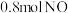 和
和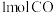 充入体积为
充入体积为 的恒容密闭容器中,在不同温度下
的恒容密闭容器中,在不同温度下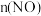 随反应时间的变化如图所示。
随反应时间的变化如图所示。已知:
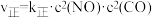 ,
,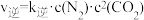 。(
。( 、
、 为速率常数,只与温度有关)
为速率常数,只与温度有关)
①该反应的

 ”、“
”、“ ”或“
”或“ ”)
”)②
 时,
时, 内用
内用 表示的平均反应速率
表示的平均反应速率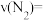
③下列措施能使生成
 的反应速率增大的是
的反应速率增大的是A. 使用催化剂 B. 充入稀有气体 C. 降低反应温度 D. 将
 及时分离出来
及时分离出来④
 时,
时,
II.在一固定容积的密闭容器中,进行如下化学反应:
 ,其化学平衡常数
,其化学平衡常数 和温度
和温度 的关系如表:
的关系如表: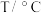 | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应是否达到化学平衡状态的依据是_______。
| A.容器中气体压强不变 | B.混合气体中 不变 不变 |
C.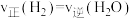 | D.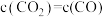 |
 时,向固定容积的密闭容器中放入混合物,起始浓度分别为
时,向固定容积的密闭容器中放入混合物,起始浓度分别为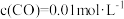 ,
,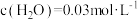 ,
,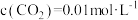 ,
,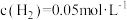 ,则反应开始时,
,则反应开始时, 的消耗速率比生成速率
的消耗速率比生成速率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
由此计算ΔH1=___ kJ·mol-1;已知ΔH2=-58kJ·mol-1,则ΔH3=___ kJ·mol-1。
(2)下列说法不能 够用勒夏特勒原理来解释的是___ 。
Ⅲ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3kJ/mol
SO2Cl2(l) △H=-97.3kJ/mol
(3)试写出常温常压下上述反应化学平衡常数K的表达式:___ ;若在此条件下,将化学平衡常数K增大,化学反应速率v正也增大,可采取的措施___ (选填编号)。
a.降温 b.移走SO2Cl2 c.增大反应物浓度 d.无法满足上述条件
(4)300℃时,体积为1L的密闭容器中充入0.12molSO2Cl2,达到平衡时容器中含SO20.119mol,则300℃时合成SO2Cl2反应的平衡常数为___ 。(只写数学表达式,不需计算)
(5)在2L真空密闭容器中加入一定量PH4I固体,T1℃时发生如下反应:PH4I(s) PH3(g)+HI(g),下列可以作为反应达到平衡的判据是
PH3(g)+HI(g),下列可以作为反应达到平衡的判据是___ 。
A.容器内气体的压强不变
B.容器内HI的气体体积分数不变
C.容器内PH4I质量不变
D.容器内气体的密度不变
E.容器内气体的平均相对分子质量不变
(6)工业上可采用CO和H2合成甲醇,发生的反应为CO(g)+2H2(g) CH3OH(g) ΔH<0,若该反应在绝热、恒容的密闭容器中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
CH3OH(g) ΔH<0,若该反应在绝热、恒容的密闭容器中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是___ 。
(1)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2③CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/kJ•mol-1 | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=
(2)下列说法
| A.夏天,打开啤酒瓶时会在瓶口逸出气体 |
B.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅 |
| C.SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率 |
D.恒温、恒压条件下,在2NO2 N2O4平衡体系中充入He后,体系颜色变浅 N2O4平衡体系中充入He后,体系颜色变浅 |
Ⅲ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g)
 SO2Cl2(l) △H=-97.3kJ/mol
SO2Cl2(l) △H=-97.3kJ/mol(3)试写出常温常压下上述反应化学平衡常数K的表达式:
a.降温 b.移走SO2Cl2 c.增大反应物浓度 d.无法满足上述条件
(4)300℃时,体积为1L的密闭容器中充入0.12molSO2Cl2,达到平衡时容器中含SO20.119mol,则300℃时合成SO2Cl2反应的平衡常数为
(5)在2L真空密闭容器中加入一定量PH4I固体,T1℃时发生如下反应:PH4I(s)
 PH3(g)+HI(g),下列可以作为反应达到平衡的判据是
PH3(g)+HI(g),下列可以作为反应达到平衡的判据是A.容器内气体的压强不变
B.容器内HI的气体体积分数不变
C.容器内PH4I质量不变
D.容器内气体的密度不变
E.容器内气体的平均相对分子质量不变
(6)工业上可采用CO和H2合成甲醇,发生的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH<0,若该反应在绝热、恒容的密闭容器中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
CH3OH(g) ΔH<0,若该反应在绝热、恒容的密闭容器中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是A.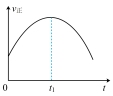 | B. |
C. | D. |
您最近一年使用:0次



