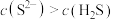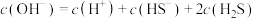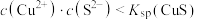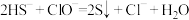在某温度时,将n mol/L氨水滴入10 mL 1.0 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法错误的是
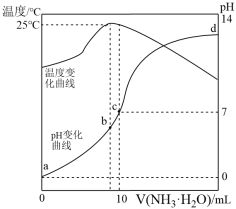

| A.a点的Kw≠1.0×10-14 |
B.b点:c(Cl-)>c( )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| C.水的电离程度:b>c>a>d |
D.c点:25℃时c(Cl-)=c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
20-21高二·浙江·期中 查看更多[1]
(已下线)【绍兴新东方】绍兴高中化学00011
更新时间:2021-03-05 19:45:10
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】室温下,向V mL c mol/L的NaOH溶液中通入 气体,pH与通入气体的关系如图所示(设反应过程中溶液体积不变),下列说法错误的是
气体,pH与通入气体的关系如图所示(设反应过程中溶液体积不变),下列说法错误的是
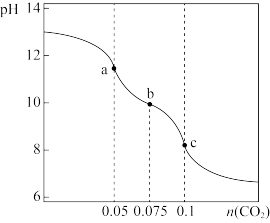
 气体,pH与通入气体的关系如图所示(设反应过程中溶液体积不变),下列说法错误的是
气体,pH与通入气体的关系如图所示(设反应过程中溶液体积不变),下列说法错误的是
A.通入 的过程中,a、b、c三点水的电离程度 的过程中,a、b、c三点水的电离程度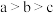 |
B.b点溶液中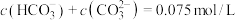 |
C.a点溶液中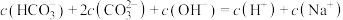 |
D.c点一定存在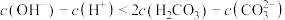 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,将0.1mol•L-1的NH3•H2O逐滴滴入10mL0.1mol•L-1HR溶液中,所得溶液pH及导电性变化如图,下列分析正确的是( )


| A.水电离出c(H+):b>a |
| B.相同温度下,电离平衡常数:HR>NH3•H2O |
| C.溶液中Kw:b>a=c |
D.c点溶液中:c(R-)>c(NH )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】在0.1 mol·L-1的NaHCO3溶液中,下列关系正确的是
| A.c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
B.c(Na+)=c(HCO3-)>c(OH -)>c(H+) -)>c(H+) |
| C.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| D.c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】下列比较中正确的是
| A.相同浓度的溶液:①氨水、②NaOH溶液、③Ba(OH)2溶液,其中由水电离出的c(H+):③>②>① |
B.相同浓度的三种溶液:①(NH4)2CO3溶液、②NH4HCO3溶液、③NH4NO3溶液中,c( ):③>①>② ):③>①>② |
| C.相同pH的溶液:①CH3COONa溶液、②NaHCO3溶液、③NaClO溶液中c(Na+):①>②>③ |
| D.同浓度、同体积的溶液:①NaAlO2溶液、②NH4Cl溶液、③NaNO3溶液中阳离子浓度之和:①>②>③ |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,向20mL0.2mol·L-1的H2B溶液中滴加0.2mol·L-1的NaOH溶液过程中,有关微粒的物质的量变化如图所示,下列说法不正确 的是


| A.I表示H2B,Ⅱ代表HB-、Ⅲ代表B2- |
| B.当c(Na+)=2c(B2-)+c(HB-)时,溶液呈中性 |
| C.初始时H2B第一级电离的电离度为90% |
| D.V(NaOH)=20mL时:c(Na+)>c(HB-)>c(B2-)>c(H2B) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,某酸H2A溶液中含A物种的浓度之和为amol·L-1,溶液中各含A物种的pc—pOH关系如图所示。图中pc表示各含A物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法不正确的是


| A.曲线③表示pc(H2A)随pOH的变化 |
| B.pH=2的溶液中:c(H2A)>c(HA-)>c(A2-) |
| C.pH=4的溶液中:c(HA-)=amol/L-2c(A2-) |
| D.H2A+A2-⇌2HA-的平衡常数K>1.0×105 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】已知:pKa=-lgKa,25℃时,H2XO3的pKa1=10-1.85,pKa2=10-7.19,常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2XO3溶液的滴定曲线如图所示下列说法不正确的是
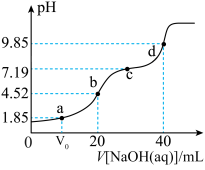

A.a点溶液中:c(H2XO3)=c(HXO ) ) |
B.b点溶液中:c(H2XO3)+c(H+)=c(XO )+c(OH-) )+c(OH-) |
C.c点溶液中:c(Na+)=3c(HXO ) ) |
D.d点溶液中:c(Na+)>c(XO )>c(OH-)>c(HXO )>c(OH-)>c(HXO )>c(H+) )>c(H+) |
您最近一年使用:0次


 NaHS溶液的性质。
NaHS溶液的性质。 溶液,产生黑色沉淀
溶液,产生黑色沉淀