下列有关溶液(室温下)的说法正确的是
A.Na2CO3和NaHCO3形成的混合溶液中:2c(Na+)=3[c(CO )+c(HCO )+c(HCO )+c(H2CO3)] )+c(H2CO3)] |
B.0.10mol•L-1NaHSO3溶液中通入NH3至溶液pH=7:c(Na+)>c(NH )>c(SO )>c(SO ) ) |
C.物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中,c(NH )的大小关系:④>①>②>③ )的大小关系:④>①>②>③ |
| D.0.10mol•L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) |
2020高三·全国·专题练习 查看更多[12]
吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题(已下线)微专题 溶液中“粒子”浓度关系(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 溶液中粒子浓度的判断-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)(已下线)第八章 水溶液中的离子反应与平衡 第50练 溶液中“粒子”浓度关系天津市第八中学2021-2022学年高二上学期12月月考化学试题(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)江西省吉安市第一中学2021-2022学年高二上学期期中考试(理科)化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)山东省济南市外国语学校2021届高三下学期3月月考化学试题2020届高三化学二轮冲刺新题专练—混合溶液中微粒浓度大小的比较
更新时间:2021-03-16 19:53:04
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知:Ka1(H2SO3)=1.0×10-2、Ka2(H2SO3)=5.0×10-8。室温下,通过下列实验探究Na2SO3、NaHSO3溶液的性质。
实验1:用pH计测得某Na2SO3和NaHSO3混合溶液的pH为7。
实验2:将等体积、等物质的量浓度的Na2SO3和NaHSO3溶液混合,无明显现象。
实验3:向Na2SO3溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向NaHSO3溶液中滴加少量Ba(OH)2溶液,产生白色沉淀。
下列说法正确的是
实验1:用pH计测得某Na2SO3和NaHSO3混合溶液的pH为7。
实验2:将等体积、等物质的量浓度的Na2SO3和NaHSO3溶液混合,无明显现象。
实验3:向Na2SO3溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向NaHSO3溶液中滴加少量Ba(OH)2溶液,产生白色沉淀。
下列说法正确的是
A.实验1混合溶液中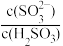 =5.0×104 =5.0×104 |
B.实验2混合后的溶液中存在:3c(Na+)=2[c( )+c( )+c(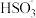 )+c(H2SO3)] )+c(H2SO3)] |
C.实验3中随水的不断加入,溶液中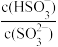 的值逐渐变小 的值逐渐变小 |
D.实验4中反应的离子方程式为Ba2++ =BaSO3↓ =BaSO3↓ |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温条件下,向V1mL浓度均为c mol·L-1的弱酸HA和HCl混合溶液中逐滴加入0.1mol·L-1弱碱BOH,溶液的导电能力随BOH溶液加入量的变化如图所示(忽略溶液混合时的体积变化)。下列说法错误的是


| A.c = 0.1 mol·L-1 |
| B.b点溶液中c(B+) +c( BOH) =c(A-) +c( HA) |
| C.若c点溶液中c(BOH) >2c(HA),则BA溶液显碱性 |
| D.滴加BOH溶液过程中,水的电离程度先增大后减小 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐1】常温下甲为pH=2的醋酸溶液,乙为pH=2的醋酸和盐酸的混合溶液,下列说法正确的是
| A.甲溶液中c(CH3COO-)一定大于乙溶液中c(CH3COO-) |
| B.甲、乙等体积混合后pH大于2 |
| C.乙溶液离子浓度大小关系为:c(Cl-)>c(CH3COO-)> c(H+)>c(OH-) |
| D.加入相同浓度的NaOH溶液至中性,甲乙两溶液消耗NaOH溶液的体积相同 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列溶液中有关微粒的物质的量浓度关系正确的是
| A.常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中:c(Na+)=c(CH3COO-) |
| B.相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的c(H+):①>②>③ |
| C.pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中,c(NH4+)大小顺序:①=②>③ |
| D.0.1mol/L醋酸钡溶液中,c (Ba2+)>c(CH3COO-)>c(OH-)> c (H+) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如下图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
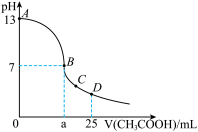
| A.在A、B间任一点,溶液中一定都c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B.在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C.在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.在D点:c(CH3COO-)+c(CH3COOH)=0.1mol·L-1 |
您最近半年使用:0次


 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)

