下列溶液中各微粒的浓度关系不正确的是
A.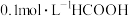 溶液中: 溶液中: |
B. 的溶液中: 的溶液中: |
C.浓度为 氨水和 氨水和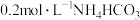 溶液等体积混合: 溶液等体积混合: |
D. 的电离常数 的电离常数 ,在 ,在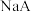 和 和 混合溶液中,当 混合溶液中,当 时, 时, |
更新时间:2021-03-27 21:57:28
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列叙述正确的是
| A.由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- |
| B.向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液的离子方程式:HA-+OH-=A2-+H2O |
| C.两种醋酸的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| D.常温下,pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合后,溶液pH<7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】10mL 0.1mol·L-1CH3COOH 溶液中滴入VmL 0.1mol·L-1NaOH 溶液,当( )
| A.V=0mL 时,c(H+)=c(CH3COO-) |
| B.V=5mL 时,c(CH3COOH)=c(CH3COO-) |
| C.V=10mL 时,c(CH3COOH)+c(CH3COO-)<c(Na+) |
| D.V=15mL 时,c(Na+)<c(CH3COO-)+c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】电解质溶液导电能力越强,电导率越大,常温下用0.1000 mol ·L-1NaOH溶液分别滴定10.00 mL浓度均为0.1000 mol ·L-1的盐酸和亚硝酸(HNO2)溶液(已知亚硝酸在常温下pKa= -lgKa=3.3 ,酸性强于乙酸) ,利用传感器测得滴定过程中溶液的电导率如图(1)所示(溶液混合后体积变化忽略不计)。下列说法正确的是


| A.c、d两点溶液中离子总浓度相等 |
B.e点溶液中c( ) +c(HNO2) +c(Na+)=0.2000 mol·L-1 ) +c(HNO2) +c(Na+)=0.2000 mol·L-1 |
| C.a点溶液和d点溶液的混合后溶液的pH <7 |
| D.乙酸、亚硝酸加水稀释时,溶液的电导率变化如图(2)所示,则曲线Ⅰ表示亚硝酸 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】室温下,向 0.01 mol·L-1的醋酸溶液中滴入 pH=7 的醋酸铵溶液,溶液 pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是


| A.a点,pH = 2 |
| B.b点,c(CH3COO-) > c(NH4+) |
| C.c点,pH可能大于7 |
| D.ac段,pH的增大仅是因为醋酸电离平衡逆向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列室温下的溶液中,有关溶液中各粒子的浓度关系判断正确的有
①0.1 mol·L-1 CH3COOH溶液中:c(CH3COO-)=c(H+) - c(OH-)
②0.1 mol·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中:
c(NH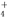 )>c(SO
)>c(SO )>c(Cu2+)>c(H+)>c(OH-)
)>c(Cu2+)>c(H+)>c(OH-)
③等体积、等物质的量浓度的弱酸HX和NaX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
④pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+) >c(OH-)
⑤0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
⑥向醋酸钠溶液中加入醋酸,得到的酸性混合溶液中:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
⑦pH=7的NH3—NH4Cl混合溶液中:c(NH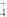 )=c(Cl-)
)=c(Cl-)
⑧0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
①0.1 mol·L-1 CH3COOH溶液中:c(CH3COO-)=c(H+) - c(OH-)
②0.1 mol·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中:
c(NH
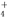 )>c(SO
)>c(SO )>c(Cu2+)>c(H+)>c(OH-)
)>c(Cu2+)>c(H+)>c(OH-)③等体积、等物质的量浓度的弱酸HX和NaX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
④pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+) >c(OH-)
⑤0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO
 )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)⑥向醋酸钠溶液中加入醋酸,得到的酸性混合溶液中:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
⑦pH=7的NH3—NH4Cl混合溶液中:c(NH
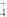 )=c(Cl-)
)=c(Cl-)⑧0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次





 按
按 由小到大排列的顺序是
由小到大排列的顺序是 ④
④

