室温下,向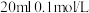 的
的 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中由水电离出
溶液,溶液中由水电离出 浓度的负对数
浓度的负对数 与所加
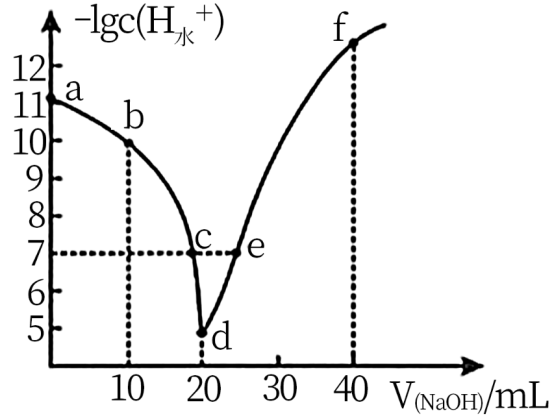
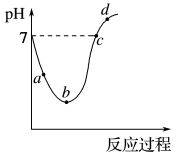
与所加 溶液体积关系如图所示(忽略溶液混合引起的体积变化)。下列说法不正确的是
溶液体积关系如图所示(忽略溶液混合引起的体积变化)。下列说法不正确的是
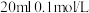 的
的 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液中由水电离出
溶液,溶液中由水电离出 浓度的负对数
浓度的负对数 与所加
与所加 溶液体积关系如图所示(忽略溶液混合引起的体积变化)。下列说法不正确的是
溶液体积关系如图所示(忽略溶液混合引起的体积变化)。下列说法不正确的是
| A.b点溶液中:c(CH3COO-)>c(CH3COOH) |
| B.c点溶液显酸性,e点溶液显中性 |
| C.d点溶液中:c(Na+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L |
| D.f点溶液:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
20-21高二下·四川广安·期中 查看更多[3]
更新时间:2021-05-14 08:58:23
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】某温度下,向10mL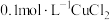 溶液中滴加
溶液中滴加 的
的 溶液,滴加过程中
溶液,滴加过程中 与
与 溶液体积的关系如图所示。已知:
溶液体积的关系如图所示。已知: ,该温度下,
,该温度下,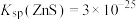 。下列有关说法正确的是
。下列有关说法正确的是

 溶液中滴加
溶液中滴加 的
的 溶液,滴加过程中
溶液,滴加过程中 与
与 溶液体积的关系如图所示。已知:
溶液体积的关系如图所示。已知: ,该温度下,
,该温度下,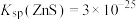 。下列有关说法正确的是
。下列有关说法正确的是
A. 溶液中: 溶液中: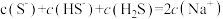 |
| B.a、b、c三点对应的溶液中,水的电离程度最大的为b点 |
C.向100mL 、 、 均为 均为 的混合溶液中逐滴加入 的混合溶液中逐滴加入 的 的 溶液, 溶液, 先沉淀 先沉淀 |
D.该温度下,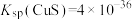 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是


| A.直线b、d分别对应H+、OH- |
| B.pH=6时,c(HAc)>c(Ac-)>c(H+) |
| C.HAc电离常数的数量级为10-5 |
| D.从曲线a与c的交点可知pKa=pH=4.74 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】某同学在两个相同的特制容器中分别加入20mL 0.4mol·L-1 Na2CO3溶液和40mL 0.2mol·L-1 NaHCO3溶液,再分别用0.4 mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:

下列说法不正确的的是

下列说法不正确的的是
A.图中丙e→f过程中:c (Na+)>c(HCO )+ c(CO )+ c(CO )+ c(H2CO3) )+ c(H2CO3) |
B.当滴加盐酸的体积为V1 mL时(a点、b点),所发生的反应用离子方程式表示为:HCO +H+ = H2CO3 +H+ = H2CO3 |
| C.若换成0.5 mol·L-1醋酸溶液滴定,则曲线甲中c点将向左平移至(16,8.3) |
D.C(20,8.3)点处,c(HCO ) + 2c(H2CO3) + c(H+)= (0.2+10-5.7) mol/L ) + 2c(H2CO3) + c(H+)= (0.2+10-5.7) mol/L |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,向一定浓度的 溶液中滴加NaOH溶液,混合液中
溶液中滴加NaOH溶液,混合液中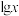 随pOH的变化如图所示,下列说法错误的是
随pOH的变化如图所示,下列说法错误的是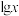 中x表示
中x表示 、
、 、
、 ;
;
② 。
。
 溶液中滴加NaOH溶液,混合液中
溶液中滴加NaOH溶液,混合液中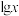 随pOH的变化如图所示,下列说法错误的是
随pOH的变化如图所示,下列说法错误的是
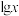 中x表示
中x表示 、
、 、
、 ;
;②
 。
。A.曲线III表示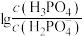 随pOH的变化关系 随pOH的变化关系 |
B.M点时,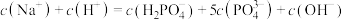 |
C.当溶液 时, 时, |
D. 的平衡常数为 的平衡常数为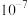 |
您最近一年使用:0次

 或
或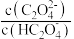 ]随pH的变化关系如图所示。下列说法正确的是
]随pH的变化关系如图所示。下列说法正确的是
 随pH的变化
随pH的变化
 的平衡常数K=1×10-3.21,则Ksp(CaC2O4)=10-8.63
的平衡常数K=1×10-3.21,则Ksp(CaC2O4)=10-8.63

