 和
和 是温室气体,将
是温室气体,将 和
和 转化为可利用的化学品,其能源和环境的双重意义不言自明,请回答以下问题:
转化为可利用的化学品,其能源和环境的双重意义不言自明,请回答以下问题:(1)天然气还原
 制备合成气的有关反应如下:
制备合成气的有关反应如下:①
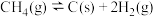
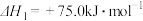
②


③

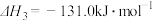
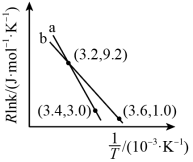
则

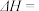
 。该反应自发进行的条件是
。该反应自发进行的条件是 (2)H2在一定条件下还原
 制备
制备 (沸点:100.7℃),能量变化如图所示。
(沸点:100.7℃),能量变化如图所示。
已知:
 ,
, 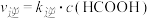 (
(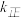 、
、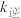 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。在1L恒容密闭容器中充入一定量
 、
、 ,发生如下反应:
,发生如下反应: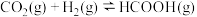

某温度下反应达到平衡,
 的平衡转化率为80%,
的平衡转化率为80%,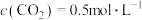 。
。①达到平衡后,仅升高温度,
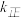 增大的倍数
增大的倍数 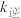 增大的倍数。
增大的倍数。②
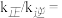
③使用高效催化剂,下列活化能变化合理的是
| 选项 | A | B | C | D |
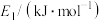 | 384 | 404 | 344 | 374 |
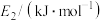 | 359 | 389 | 329 | 399 |
更新时间:2021-06-27 09:42:34
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇既是重要的化工原料,可用于制备甲醛、醋酸等产品,又可作为清洁燃料。利用CO2与H2合成甲醇涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=41kJ•mol−1
回答下列问题:
(1)已知CO(g)+2H2(g)⇌CH3OH(g) △H3 = −99 kJ•mol−1,则△H1=______ kJ•mol−1
(2)向刚性容器中充入一定量的CO2和H2,在不同催化剂(Cat.1,Cat.2)下反应相同时间,CO2的转化率和甲醇的选择性[甲醇的选择性= ×100%]随温度的变化如图所示:
×100%]随温度的变化如图所示:
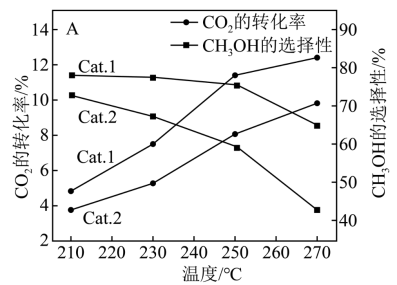
①由上图可知,催化效果Cat.1____ Cat.2(填“>”“<”或“=”)。
②在210~270℃间,CH3OH的选择性随温度的升高而下降,请写出一条可能原因_____________ 。
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应。
①有利于提高甲醇平衡产率的条件是________ (填标号)。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②达到平衡时CO2的转化率为20%,CH3OH的选择性为75%,则 (H2)=
(H2)=________ ;反应Ⅱ的压强平衡常数Kp=________________ 。
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=41kJ•mol−1
回答下列问题:
(1)已知CO(g)+2H2(g)⇌CH3OH(g) △H3 = −99 kJ•mol−1,则△H1=
(2)向刚性容器中充入一定量的CO2和H2,在不同催化剂(Cat.1,Cat.2)下反应相同时间,CO2的转化率和甲醇的选择性[甲醇的选择性=
 ×100%]随温度的变化如图所示:
×100%]随温度的变化如图所示:
①由上图可知,催化效果Cat.1
②在210~270℃间,CH3OH的选择性随温度的升高而下降,请写出一条可能原因
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应。
①有利于提高甲醇平衡产率的条件是
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②达到平衡时CO2的转化率为20%,CH3OH的选择性为75%,则
 (H2)=
(H2)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
 △H=+180 kJ·mol−1
△H=+180 kJ·mol−1
 △H=+68 kJ·mol−1
△H=+68 kJ·mol−1
则 △H=
△H=__________ kJ·mol−1
(2)对于反应 的反应历程如下:
的反应历程如下:
第一步:
第二步:
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1正·c2(NO),υ逆=
k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是______ (填标号)。
A.整个反应的速率由第一步反应速率决定
B.同一温度下,平衡时第一步反应的k1正/k1逆越大,反应正向程度越大
C.第二步反应速率低,因而转化率也低
D.第二步反应的活化能比第一步反应的活化能高
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为: △H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
△H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
在此温度下,反应的平衡常数Kp=___________ kPa−1(Kp为以分压表示的平衡常数);若降低温度,再次平衡后,与原平衡相比体系压强(P总)减小的原因是____________________ 。
(4)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下
I: NO+Pt(s)=NO(*) [Pt(s)表示催化剂,NO(*)表示吸附态NO,下同]
Ⅱ:CO+Pt(s)=CO(*)
Ⅲ:NO(*)=N(*)+O(*)
Ⅳ:CO(*)+O(*)=CO2+2Pt(s)
V:N(*)+N(*)=N2+2 Pt(s)
Ⅵ:NO(*)+N(*)=N2O+2 Pt(s)
尾气中反应物及生成物浓度随温度的变化关系如图。

①330℃以下的低温区发生的主要反应的化学方程式是__________________________ 。
②反应V的活化能_____ 反应VI的活化能(填“<”、“>”或“=”),理由是_________________ 。
(1)已知汽车气缸中氮及其化合物发生如下反应:
 △H=+180 kJ·mol−1
△H=+180 kJ·mol−1 △H=+68 kJ·mol−1
△H=+68 kJ·mol−1则
 △H=
△H=(2)对于反应
 的反应历程如下:
的反应历程如下:第一步:

第二步:

其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1正·c2(NO),υ逆=
k1逆·c(N2O2),k1正、k1逆为速率常数,仅受温度影响。下列叙述正确的是
A.整个反应的速率由第一步反应速率决定
B.同一温度下,平衡时第一步反应的k1正/k1逆越大,反应正向程度越大
C.第二步反应速率低,因而转化率也低
D.第二步反应的活化能比第一步反应的活化能高
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:
 △H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
△H<0。某温度下,向10 L密闭容器中分别充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
(4)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下
I: NO+Pt(s)=NO(*) [Pt(s)表示催化剂,NO(*)表示吸附态NO,下同]
Ⅱ:CO+Pt(s)=CO(*)
Ⅲ:NO(*)=N(*)+O(*)
Ⅳ:CO(*)+O(*)=CO2+2Pt(s)
V:N(*)+N(*)=N2+2 Pt(s)
Ⅵ:NO(*)+N(*)=N2O+2 Pt(s)
尾气中反应物及生成物浓度随温度的变化关系如图。

①330℃以下的低温区发生的主要反应的化学方程式是
②反应V的活化能
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氯气是一种重要的化工原料。
(1)工业生产氯化物通常用由氧化物经氯化作用生成的方法,例如工业上常采用“加碳氯化”的方法以高钛渣(主要成分为 )为原料生产
)为原料生产 。
。
已知:
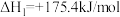 ;
;
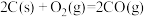
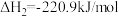 。
。
沸腾炉中“加碳氯化”生成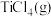 和
和 的热化学方程式:
的热化学方程式:___________ 。
(2) 合成有机物时会产生副产物
合成有机物时会产生副产物 。利用反应
。利用反应 可实现氯的循环利用。
可实现氯的循环利用。
①该反应的
___________ 0(填“>”“<”或“=”)。
②若反应物按物质的量 (
(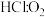 )在体积不变的密闭容器中发生该反应,下列叙述正确的是
)在体积不变的密闭容器中发生该反应,下列叙述正确的是___________ (填字母)。
A.当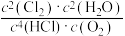 不变时,说明反应已达到平衡状态
不变时,说明反应已达到平衡状态
B.当 时,说明反应已达到平衡状态
时,说明反应已达到平衡状态
C.平衡后,继续按 的物质的量之比投入
的物质的量之比投入 和
和 ,再次达到新平衡时,
,再次达到新平衡时, 的转化率增大
的转化率增大
D.平衡后,分离出 ,可以提高
,可以提高 的平衡产率,并加快正反应速率
的平衡产率,并加快正反应速率
③下图是在两个不同温度 和
和 下,改变
下,改变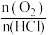 时
时 在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是
在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是___________ (填字母)。

A.a点未达到平衡,c点一定已经平衡
B.平衡常数: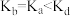
C.达到平衡时 的转化率大小为a>b>c
的转化率大小为a>b>c
D.若平衡常数K值变大,达新平衡前 始终减小
始终减小
(3)在一定温度下,以 为催化剂,氯苯(
为催化剂,氯苯(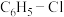 )和
)和 在
在 中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:
中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:
i.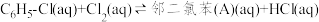
ii.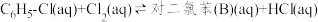
向盛有 含有
含有 的
的 的容器中加入
的容器中加入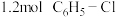 和
和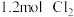 发生反应,忽略
发生反应,忽略 溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。

①该温度下,反应ii的化学平衡常数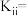
___________ 。
②工业生产上,提高生成邻二氯苯(A)反应选择性的关键因素是选择合适的___________ 。
(1)工业生产氯化物通常用由氧化物经氯化作用生成的方法,例如工业上常采用“加碳氯化”的方法以高钛渣(主要成分为
 )为原料生产
)为原料生产 。
。已知:

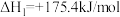 ;
;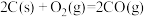
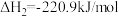 。
。沸腾炉中“加碳氯化”生成
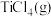 和
和 的热化学方程式:
的热化学方程式:(2)
 合成有机物时会产生副产物
合成有机物时会产生副产物 。利用反应
。利用反应 可实现氯的循环利用。
可实现氯的循环利用。①该反应的

②若反应物按物质的量
 (
(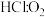 )在体积不变的密闭容器中发生该反应,下列叙述正确的是
)在体积不变的密闭容器中发生该反应,下列叙述正确的是A.当
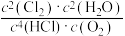 不变时,说明反应已达到平衡状态
不变时,说明反应已达到平衡状态B.当
 时,说明反应已达到平衡状态
时,说明反应已达到平衡状态C.平衡后,继续按
 的物质的量之比投入
的物质的量之比投入 和
和 ,再次达到新平衡时,
,再次达到新平衡时, 的转化率增大
的转化率增大D.平衡后,分离出
 ,可以提高
,可以提高 的平衡产率,并加快正反应速率
的平衡产率,并加快正反应速率③下图是在两个不同温度
 和
和 下,改变
下,改变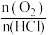 时
时 在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是
在平衡混合物中的体积分数的变化规律曲线。下列叙述正确的是
A.a点未达到平衡,c点一定已经平衡
B.平衡常数:
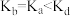
C.达到平衡时
 的转化率大小为a>b>c
的转化率大小为a>b>cD.若平衡常数K值变大,达新平衡前
 始终减小
始终减小(3)在一定温度下,以
 为催化剂,氯苯(
为催化剂,氯苯(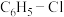 )和
)和 在
在 中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:
中发生平行反应,分别生成邻二氯苯(A)和对二氯苯(B),其反应的化学方程式如下:i.
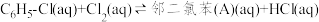
ii.
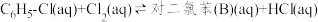
向盛有
 含有
含有 的
的 的容器中加入
的容器中加入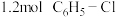 和
和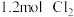 发生反应,忽略
发生反应,忽略 溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
溶液体积的变化,达到平衡时生成邻二氯苯(A)和对二氯苯(B)的物质的量(n)随时间(t)变化的曲线如图所示。
①该温度下,反应ii的化学平衡常数
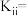
②工业生产上,提高生成邻二氯苯(A)反应选择性的关键因素是选择合适的
您最近一年使用:0次
【推荐1】甲醇有广泛的用途和广阔的应用前景,工业上利用CO2生产甲醇,再利用甲醇生产丙烯。回答下列问题:
(1)常温下,H2和甲醇的燃烧热分别为285.8kJ·mol-1和726.4kJ·mol-1,1mol甲醇汽化需要吸收82.0kJ的热量,则CO2和H2在Cu/ZnO催化作用下合成气态甲醇的热化学方程式为___________ 。
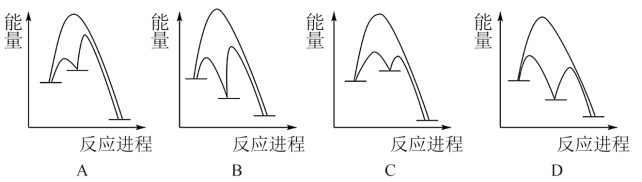
(2)在Cu/ZnO催化作用下,CO2和H2合成甲醇的总反应分两步进行:
第一步为___________ (写化学方程式) △H>0;
第二步为Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH △H<0.
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示Cu/ZnO催化CO2和H2合成甲醇反应过程的示意图为___________ 。
(3)甲醇催化制取丙烯的过程中发生如下反应:
I.3CH3OH(g)⇌C3H6(g)+3H2O(g)
II.2CH3OH(g)⇌C2H4(g)+2H2O(g)
反应I的Arrhenius经验公式的实验数据如下图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能 =
=___________ kJ/mol。当改变外界条件时,实验数据如下图中的曲线b所示,则实验可能改变的外界条件是___________ 。
(1)常温下,H2和甲醇的燃烧热分别为285.8kJ·mol-1和726.4kJ·mol-1,1mol甲醇汽化需要吸收82.0kJ的热量,则CO2和H2在Cu/ZnO催化作用下合成气态甲醇的热化学方程式为
(2)在Cu/ZnO催化作用下,CO2和H2合成甲醇的总反应分两步进行:
第一步为
第二步为Cu/Zn*+2H2+CO2=Cu/ZnO*+CH3OH △H<0.
第二步反应几乎不影响总反应达到平衡所用的时间,由此推知以下能正确表示Cu/ZnO催化CO2和H2合成甲醇反应过程的示意图为

(3)甲醇催化制取丙烯的过程中发生如下反应:
I.3CH3OH(g)⇌C3H6(g)+3H2O(g)
II.2CH3OH(g)⇌C2H4(g)+2H2O(g)
反应I的Arrhenius经验公式的实验数据如下图中曲线a所示,已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数)。则该反应的活化能
为活化能,k为速率常数,R和C为常数)。则该反应的活化能 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮氧化合物的处理对建设生态文明具有重要意义,可采用多种方法消除。
方法一:氢气还原法
(1)氢气在富氧条件下催化还原NOx,反应在低温时仍具有高活性和选择性。已知催化剂Rh表面H2催化还原NO的部分反应机理如表:
其他条件一定时,决定H2催化还原NO的反应速率的基元反应为__ (填标号),基元反应H(s)+O(s)=OH(s)+Rh(s)的△H=__ kJ·mol-1。
(2)在低温区催化剂Pt/Al—M—10—A对生成N2O具有敏感性,发生反应H2(g)+2NO(g) N2O(g)+H2O(g)。在恒温恒容密闭容器中,H2和NO以物质的量比1:2充入,容器压强为p0,达平衡时,N2O的体积分数为0.2。
N2O(g)+H2O(g)。在恒温恒容密闭容器中,H2和NO以物质的量比1:2充入,容器压强为p0,达平衡时,N2O的体积分数为0.2。
①下列有关说法正确的是__ 。
a.平衡时,气体平均相对分子质量不再变化
b.任意时刻,2v正(NO)=v逆(H2O)
c.若向容器内充入少量O2,平衡不移动
d.平衡后,向容器中按照1:2再充入H2和NO,平衡向右移动
②反应达到平衡时,H2的平衡转化率为__ ;Kp=__ (用含P0的代数式表示)。
方法二:碳还原法
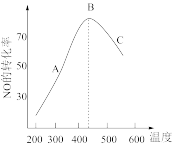
(3)利用反应C(s)+2NO(g)=N2(g)+CO2(g)ΔH=-34.0kJ·mol-1催化还原NO,若为恒温容器,经相同时间测得不同温度下NO的转化率随温度的变化如图所示:由图可知最高转化率B点对应温度为440℃,高于440℃时,NO的转化率降低的原因可能是___ ,也可能是___ 。
方法三:NH3还原法
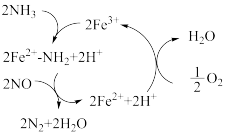
(4)研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图。写出脱氮过程的总反应的化学方程式___ 。
方法一:氢气还原法
(1)氢气在富氧条件下催化还原NOx,反应在低温时仍具有高活性和选择性。已知催化剂Rh表面H2催化还原NO的部分反应机理如表:
| 序号 | 基元反应 | 活化能Ea(kJ•mol-1) |
| ① | H2(g)+Rh(s)+Rh(s)=H(s)+H(s) | 12.6 |
| ④ | H(s)+O(s)=OH(s)+Rh(s) | 83.7 |
| ⑦ | N(s)+N(s)=N2(s)+Rh(s)+Rh(s) | 120.9 |
| ⑧ | OH(s)+Rh(s)=H(s)+O(s) | 37.7 |
| ⑩ | NO(s)=NO(g)+Rh(s) | 108.9 |
其他条件一定时,决定H2催化还原NO的反应速率的基元反应为
(2)在低温区催化剂Pt/Al—M—10—A对生成N2O具有敏感性,发生反应H2(g)+2NO(g)
 N2O(g)+H2O(g)。在恒温恒容密闭容器中,H2和NO以物质的量比1:2充入,容器压强为p0,达平衡时,N2O的体积分数为0.2。
N2O(g)+H2O(g)。在恒温恒容密闭容器中,H2和NO以物质的量比1:2充入,容器压强为p0,达平衡时,N2O的体积分数为0.2。①下列有关说法正确的是
a.平衡时,气体平均相对分子质量不再变化
b.任意时刻,2v正(NO)=v逆(H2O)
c.若向容器内充入少量O2,平衡不移动
d.平衡后,向容器中按照1:2再充入H2和NO,平衡向右移动
②反应达到平衡时,H2的平衡转化率为
方法二:碳还原法
(3)利用反应C(s)+2NO(g)=N2(g)+CO2(g)ΔH=-34.0kJ·mol-1催化还原NO,若为恒温容器,经相同时间测得不同温度下NO的转化率随温度的变化如图所示:由图可知最高转化率B点对应温度为440℃,高于440℃时,NO的转化率降低的原因可能是

方法三:NH3还原法
(4)研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图。写出脱氮过程的总反应的化学方程式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】铁及其化合物在生产、生活中有广泛的应用。
(1)中科院兰州化学物理研究所用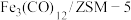 催化
催化 加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂
加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂 (也起催化作用)后可改变反应的选择性。
(也起催化作用)后可改变反应的选择性。
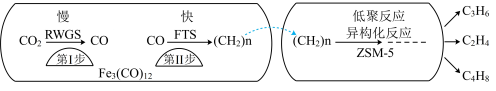
下列说法正确的是___________ 。
a.第1步所发生的反应为: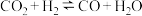
b.第1步反应的活化能低于第2步
c.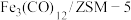 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小
d.添加不同助剂后,各反应的平衡常数不变
(2)纳米铁是重要的储氢材料,可用反应 制得。在
制得。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和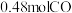 ,在
,在 不同温度下进行反应,测得
不同温度下进行反应,测得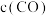 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。

___________ 0(填“>”或“<”);
(3) 温度下,平衡时体系的压强为
温度下,平衡时体系的压强为 ,反应的标准平衡常数
,反应的标准平衡常数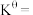
___________ (已知:标准平衡常数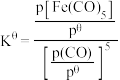 ,其中
,其中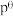 为标准压强
为标准压强 为各组分的平衡分压。)
为各组分的平衡分压。)
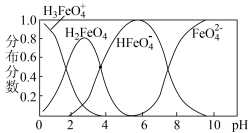
(4)高铁酸钾 被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
①电解法可制得 ,装置如图,阳极电极反应式为
,装置如图,阳极电极反应式为___________ 。

② 在水解过程中铁元素形成的微粒分布分数与
在水解过程中铁元素形成的微粒分布分数与 的关系如图所示,向
的关系如图所示,向 的溶液中加入
的溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(5)复合氧化物铁酸锰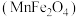 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下:
①

②

③

则: 与
与 、
、 的关系为
的关系为
___________
(1)中科院兰州化学物理研究所用
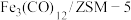 催化
催化 加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂
加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂 (也起催化作用)后可改变反应的选择性。
(也起催化作用)后可改变反应的选择性。
下列说法正确的是
a.第1步所发生的反应为:
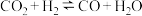
b.第1步反应的活化能低于第2步
c.
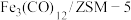 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小d.添加不同助剂后,各反应的平衡常数不变
(2)纳米铁是重要的储氢材料,可用反应
 制得。在
制得。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和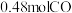 ,在
,在 不同温度下进行反应,测得
不同温度下进行反应,测得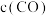 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。

(3)
 温度下,平衡时体系的压强为
温度下,平衡时体系的压强为 ,反应的标准平衡常数
,反应的标准平衡常数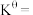
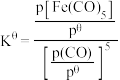 ,其中
,其中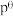 为标准压强
为标准压强 为各组分的平衡分压。)
为各组分的平衡分压。)(4)高铁酸钾
 被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。①电解法可制得
 ,装置如图,阳极电极反应式为
,装置如图,阳极电极反应式为
②
 在水解过程中铁元素形成的微粒分布分数与
在水解过程中铁元素形成的微粒分布分数与 的关系如图所示,向
的关系如图所示,向 的溶液中加入
的溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
(5)复合氧化物铁酸锰
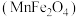 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下: ①


②


③


则:
 与
与 、
、 的关系为
的关系为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】2023年杭州亚运会开幕式首次使用“零碳甲醇”作为主火炬塔燃料。以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1) 的电子式为
的电子式为______________ 。
(2)已知 分子中
分子中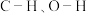 的键长分别为
的键长分别为 和
和 的大小关系为a
的大小关系为a_______ b(填“>”或“<”)。
(3)甲醇的沸点( )高于甲硫醇
)高于甲硫醇 的原因是
的原因是_______ 。
(4)在 和
和 下,
下,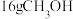 在
在 中完全燃烧生成
中完全燃烧生成 和液态水,放出
和液态水,放出 的热量,写出
的热量,写出 燃烧热的热化学方程式:
燃烧热的热化学方程式:______________ 。
(5)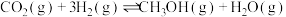

_______ 
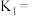
_______ (用含 和
和 的代数式表示)。
的代数式表示)。
(6)不同压强下,按照 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。

已知: 的平衡产率
的平衡产率
其中纵坐标表示 平衡产率的是图
平衡产率的是图_______ (填“甲”或“乙”);压强 的大小关系为
的大小关系为
_______  (填“>”或“<”);图乙中
(填“>”或“<”);图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是_______ 。
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)
 的电子式为
的电子式为(2)已知
 分子中
分子中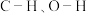 的键长分别为
的键长分别为 和
和 的大小关系为a
的大小关系为a(3)甲醇的沸点(
 )高于甲硫醇
)高于甲硫醇 的原因是
的原因是(4)在
 和
和 下,
下,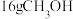 在
在 中完全燃烧生成
中完全燃烧生成 和液态水,放出
和液态水,放出 的热量,写出
的热量,写出 燃烧热的热化学方程式:
燃烧热的热化学方程式:(5)
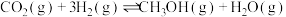


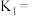
 和
和 的代数式表示)。
的代数式表示)。(6)不同压强下,按照
 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡产率
的平衡产率
其中纵坐标表示
 平衡产率的是图
平衡产率的是图 的大小关系为
的大小关系为
 (填“>”或“<”);图乙中
(填“>”或“<”);图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在 0.5L 的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较 K1、K2的大小,K1___ K2(填“<”“>”或“=”);
②400℃时,反应 2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为___ 。当测得 NH3、N2和 H2物质的量分别为 3mol、2mol 和 1mol 时,则该反应的 v(N2)正__ v(N2)逆(填“<”“>”或“=”)。
(2)平衡后,若提高H2的转化率,可以采取的措施有_____ 。
A.加入催化剂 B.恒温恒压下充入一定量氩气
C.其他条件不变降低反应体系的温度 D.恒温恒容下充入一定量 N2
(3)已知稀氨水和稀硫酸反应生成 1mol (NH4)2SO4时ΔH= -24.2kJ·mol-1;强酸、强碱稀溶液反应的中和热ΔH= -57.3kJ·mol-1。则 NH3·H2O(aq)
 (aq)+OH-(aq) ΔH 等于
(aq)+OH-(aq) ΔH 等于_____ 。
(1)若在 0.5L 的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较 K1、K2的大小,K1
②400℃时,反应 2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为(2)平衡后,若提高H2的转化率,可以采取的措施有
A.加入催化剂 B.恒温恒压下充入一定量氩气
C.其他条件不变降低反应体系的温度 D.恒温恒容下充入一定量 N2
(3)已知稀氨水和稀硫酸反应生成 1mol (NH4)2SO4时ΔH= -24.2kJ·mol-1;强酸、强碱稀溶液反应的中和热ΔH= -57.3kJ·mol-1。则 NH3·H2O(aq)

 (aq)+OH-(aq) ΔH 等于
(aq)+OH-(aq) ΔH 等于
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】研究碳及其化合物的反应对缓解环境污染、能源危机具有重要意义。
CO2的捕获与利用
(1)CO2可以被NaOH溶液捕获。若所得溶液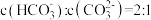 ,溶液pH=
,溶液pH=_______ 。(室温下, 的
的 )
)
(2)利用CO2和H2合成二甲醚(CH3OCH3)的过程包括如下反应
甲醇合成:
甲醇脱水:
则合成二甲醚总反应热化学方程式:
_________ mol∙L-1
(3)合成二甲醚所用的CO2可利用氨水从工业废气中捕获,捕获过程中会生成中间产物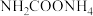 为测定该反应的有关热力学参数,将一定量纯净的
为测定该反应的有关热力学参数,将一定量纯净的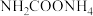 置于5L的真空钢瓶中,一定温度下发生反应:
置于5L的真空钢瓶中,一定温度下发生反应: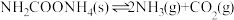 ,实验测得气体总浓度(10-3mol/L)与温度、时间的关系如表所示:
,实验测得气体总浓度(10-3mol/L)与温度、时间的关系如表所示:
①该反应能自发进行的原因_______ 。
②35℃时, 到
到 时间段用
时间段用 表示的反应速率为
表示的反应速率为_______ (用含 、
、 的式子表示)
的式子表示)
③25℃, 时刻将钢瓶体积压缩为2.5L,达到新平衡时CO2的浓度为
时刻将钢瓶体积压缩为2.5L,达到新平衡时CO2的浓度为_______  。
。
(4)我国科学家设计 熔盐捕获与转化装置如图所示,c极电极反应式为
熔盐捕获与转化装置如图所示,c极电极反应式为_______ 。

CO2的捕获与利用
(1)CO2可以被NaOH溶液捕获。若所得溶液
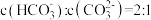 ,溶液pH=
,溶液pH= 的
的 )
)(2)利用CO2和H2合成二甲醚(CH3OCH3)的过程包括如下反应
甲醇合成:

甲醇脱水:

则合成二甲醚总反应热化学方程式:

(3)合成二甲醚所用的CO2可利用氨水从工业废气中捕获,捕获过程中会生成中间产物
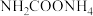 为测定该反应的有关热力学参数,将一定量纯净的
为测定该反应的有关热力学参数,将一定量纯净的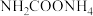 置于5L的真空钢瓶中,一定温度下发生反应:
置于5L的真空钢瓶中,一定温度下发生反应: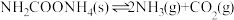 ,实验测得气体总浓度(10-3mol/L)与温度、时间的关系如表所示:
,实验测得气体总浓度(10-3mol/L)与温度、时间的关系如表所示:| 温度 总浓度(10-3mol/L) 时间 | 15℃ | 25℃ | 35℃ |
| 0 | 0 | 0 | 0 |
 | 0.9 | 2.7 | 8.1 |
 | 2.4 | 4.8 | 9.4 |
 | 2.4 | 4.8 | 9.4 |
①该反应能自发进行的原因
②35℃时,
 到
到 时间段用
时间段用 表示的反应速率为
表示的反应速率为 、
、 的式子表示)
的式子表示)③25℃,
 时刻将钢瓶体积压缩为2.5L,达到新平衡时CO2的浓度为
时刻将钢瓶体积压缩为2.5L,达到新平衡时CO2的浓度为 。
。(4)我国科学家设计
 熔盐捕获与转化装置如图所示,c极电极反应式为
熔盐捕获与转化装置如图所示,c极电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) △H>0。已知在1100°C时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) △H>0。已知在1100°C时,该反应的化学平衡常数K=0.263。
①温度升高,平衡移动后达到新平衡,此时平衡常数值____ (填“增大”“减小”“不变”);
②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向_______ 进行(填“左”或“右”)。
(2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
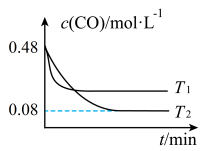
CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.

①反应开始至平衡,氢气的平均反应速率v(H2)=______ ,CO2的转化率为_____ ;该温度下上述反应的平衡常数K=_____ (分数表示);
②反应达到平衡后,下列能使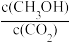 的值增大的措施是
的值增大的措施是______ (填符号)。
a.升高温度 b.再充入H2 c.再充入CO2 d.将H2O(g)从体系中分离 e.充入He(g)
③有人提出,可以设计反应2CO(g)=2C(s)+O2(g) (△H>0)来消除CO的污染,请你判断上述反应是否能自发进行并说明理由________ 。
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)
 Fe(s)+CO2(g) △H>0。已知在1100°C时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) △H>0。已知在1100°C时,该反应的化学平衡常数K=0.263。①温度升高,平衡移动后达到新平衡,此时平衡常数值
②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向
(2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①反应开始至平衡,氢气的平均反应速率v(H2)=
②反应达到平衡后,下列能使
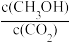 的值增大的措施是
的值增大的措施是a.升高温度 b.再充入H2 c.再充入CO2 d.将H2O(g)从体系中分离 e.充入He(g)
③有人提出,可以设计反应2CO(g)=2C(s)+O2(g) (△H>0)来消除CO的污染,请你判断上述反应是否能自发进行并说明理由
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发利用二氧化碳技术,降低空气中二氧化碳含量成为重要的任务。
(1)倡导绿色低碳的生活方式,下列措施与节能减碳矛盾的是_____
(2) 加氢合成
加氢合成 的反应为
的反应为 。
。
①下列说法正确的是_____
A.调控反应条件不能改变反应限度
B.投入 和
和 能得到
能得到
C.当 的消耗速率等于其生成速率时,该反应已停止
的消耗速率等于其生成速率时,该反应已停止
D.该反应在一定温度下能自发进行,则
②一般认为,该反应经过如下步骤来实现:
反应Ⅰ: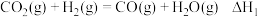 ;
;
反应Ⅱ: 。
。
则总反应的焓变
___________ (用包含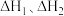 的代数式表示)。若某温度下,反应Ⅰ的平衡常数为
的代数式表示)。若某温度下,反应Ⅰ的平衡常数为 ,反应Ⅱ的平衡常数为
,反应Ⅱ的平衡常数为 ,则总反应的平衡常数
,则总反应的平衡常数
___________ (用包含 的代数式表示)
的代数式表示)
(3)二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应: ;
;
①写出主反应的平衡常数表达式:___________
②某容器中加入一定量的 和
和 ,保持温度和压强不变的情况下,达平衡后再向该容器中注入
,保持温度和压强不变的情况下,达平衡后再向该容器中注入 稀释,主反应的化学平衡将
稀释,主反应的化学平衡将___________ (填“正向移动”、“逆向移动”或“不移动”),达到新平衡后, 的体积分数将
的体积分数将___________ (填“增大”、“减小”或“不变”)
(4) 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线:
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线: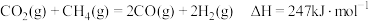
①该反应
___________ 0(填“>”或“<”)
②有传闻 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?___________ (填“正确”或“错误”),并写出原因___________ 。
(1)倡导绿色低碳的生活方式,下列措施与节能减碳矛盾的是_____
| A.购物时使用环保袋 | B.就餐时践行光盘行动 |
| C.使用节能灯代替白炽灯 | D.为食品保鲜,冰箱温度越低越好 |
 加氢合成
加氢合成 的反应为
的反应为 。
。①下列说法正确的是
A.调控反应条件不能改变反应限度
B.投入
 和
和 能得到
能得到
C.当
 的消耗速率等于其生成速率时,该反应已停止
的消耗速率等于其生成速率时,该反应已停止D.该反应在一定温度下能自发进行,则

②一般认为,该反应经过如下步骤来实现:
反应Ⅰ:
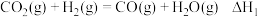 ;
;反应Ⅱ:
 。
。则总反应的焓变

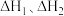 的代数式表示)。若某温度下,反应Ⅰ的平衡常数为
的代数式表示)。若某温度下,反应Ⅰ的平衡常数为 ,反应Ⅱ的平衡常数为
,反应Ⅱ的平衡常数为 ,则总反应的平衡常数
,则总反应的平衡常数
 的代数式表示)
的代数式表示)(3)二氧化碳甲烷化反应合成替代天然气,是利用二氧化碳的技术之一
甲烷化主反应:
 ;
;①写出主反应的平衡常数表达式:
②某容器中加入一定量的
 和
和 ,保持温度和压强不变的情况下,达平衡后再向该容器中注入
,保持温度和压强不变的情况下,达平衡后再向该容器中注入 稀释,主反应的化学平衡将
稀释,主反应的化学平衡将 的体积分数将
的体积分数将(4)
 与
与 是典型的温室气体,
是典型的温室气体, 重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线:
重整制合成气提供了一条规模化综合利用碳源、氢源并转化温室气体的技术路线: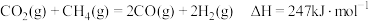
①该反应

②有传闻
 重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
重整制合成气可以在任何条件下自发进行,你认为此传闻是否正确?
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】2015年巴黎气候变化大会的主题之一是节能减排,开发新能源以及提高能源的利用率再次受到国际社会的高度关注。
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是________ (填字母)。
A、氢能 B、天然气 C、石油
(2)工业制氢有多种渠道:
①其中一个重要反应是:CO(g) + H2O(g)=CO2(g) + H2(g) ΔH。
已知: C(s,石墨) + O2(g)=CO2(g) ΔH1=-394 kJ/mol
2C(s,石墨) + O2(g)=2CO(g) ΔH2=-222 kJ/mol
H2(g)+ O2(g)=H2O(g) ΔH3=-242 kJ/mol
O2(g)=H2O(g) ΔH3=-242 kJ/mol
则ΔH=_____ kJ/mol。
②一种“金属(M)氧化物循环制氢”的原理如图所示。写出该流程制氢的总反应式:________ 。

③氢气可用于制备 H2O2。已知: H2(g)+A(l)=B(l) ΔH1、O2(g)+B(l)=A(l)+H2O2(l) ΔH2,这两个反应均为自发反应,则 H2(g)+O2(g)=H2O2(l) 的 ΔH____ 0 ( 填 “ > ” 、 “ < ” 或 “=”)。
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是
A、氢能 B、天然气 C、石油
(2)工业制氢有多种渠道:
①其中一个重要反应是:CO(g) + H2O(g)=CO2(g) + H2(g) ΔH。
已知: C(s,石墨) + O2(g)=CO2(g) ΔH1=-394 kJ/mol
2C(s,石墨) + O2(g)=2CO(g) ΔH2=-222 kJ/mol
H2(g)+
 O2(g)=H2O(g) ΔH3=-242 kJ/mol
O2(g)=H2O(g) ΔH3=-242 kJ/mol则ΔH=
②一种“金属(M)氧化物循环制氢”的原理如图所示。写出该流程制氢的总反应式:

③氢气可用于制备 H2O2。已知: H2(g)+A(l)=B(l) ΔH1、O2(g)+B(l)=A(l)+H2O2(l) ΔH2,这两个反应均为自发反应,则 H2(g)+O2(g)=H2O2(l) 的 ΔH
您最近一年使用:0次



