常温下,向20ml0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液,有关微粒的物质的量的变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示,判断下列说法正确的是
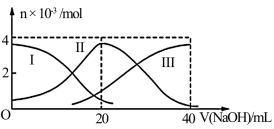

| A.H2A在水中的电离方程式是H2A=H++HA-;HA-⇌H++A2- |
| B.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>c(A2-)>c(OHˉ) |
| C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大,NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HAˉ)+2c(H2A)=c(A2-)+2c(OHˉ) |
更新时间:2021/08/12 20:26:32
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )
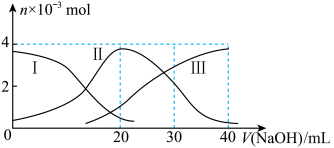
A.H2A在水中的电离方程式是:H2A=H++HA-、HA- H++A2- H++A2- |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性 |
| C.当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-) |
| D.当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列图示与对应的叙述相符的是


| A.图1表示将SO2气体通入溴水中,所得溶液的pH变化 |
| B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀的物质的量与盐酸体积的关系 |
| C.图3表示常温下,向0.1000mol•L-1HCl溶液中滴加20.00mL 0.1000mol•L-1氨水的滴定曲线 |
| D.图4表示乙醇的催化氧化反应中速率随温度的变化图像,升高温度该反应的平衡常数减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,向20.00mL0.100mol·L-1NH4Cl溶液中逐滴加入0.100 mol·L-1NaOH溶液,溶液的pH与NaOH溶液所加入体积的关系如图所示(不考虑挥发)。下列说法正确的是
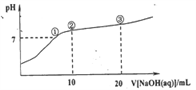

| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Cl-)>c(Na+)>c(NH4+)>c(NH3·H2O) |
| C.点③所示溶液中:c(Cl-)>c(NH3·H2O)>c(OH-)>c(NH4+) |
| D.整个过程中可能出现:c(OH-)+c(Cl-)= c(NH4+)+c(NH3·H2O) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列说法正确的是
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1 |
| C.0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L |
| D.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,NH3•H2O的Kb约为10-5。在下列装置中存在不同pH的两种溶液,溶液中离子不能穿过隔膜,分子可以自由穿过隔膜(如图所示)。已知c起始(NH3•H2O)=c平衡(NH3•H2O)+c(NH )。当达到平衡时,下列叙述正确的是
)。当达到平衡时,下列叙述正确的是

 )。当达到平衡时,下列叙述正确的是
)。当达到平衡时,下列叙述正确的是
A.溶液I中c(OH-)=c(H+)+c(NH ) ) |
| B.溶液I和II中的c平衡(NH3•H2O)不相等 |
C.溶液II中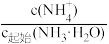 为0.1 为0.1 |
| D.溶液I和II中c起始I(NH3•H2O):c起始II(NH3•H2O)=101:11 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,向10mL0.05mol·L-1的某酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列说法不正确 的是
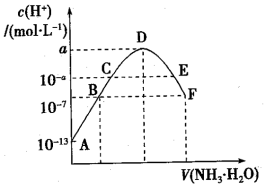

| A.常温下,0.1mol·L-1KHB溶液的pH=1 |
| B.过程中,随着氨水的加入,溶液pH先增后减 |
| C.D、E、F三点中,D点水的电离程度最大 |
D.B点溶液呈酸性,F点溶液c(NH )=2c(B2-) )=2c(B2-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】 是一种二元弱酸。常温下,将稀硫酸滴入一定浓度的
是一种二元弱酸。常温下,将稀硫酸滴入一定浓度的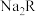 溶液中,混合溶液pY「Y表示
溶液中,混合溶液pY「Y表示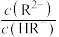 或
或 ,
, ]随pH的变化关系如图所示。下列说法错误的是
]随pH的变化关系如图所示。下列说法错误的是
 是一种二元弱酸。常温下,将稀硫酸滴入一定浓度的
是一种二元弱酸。常温下,将稀硫酸滴入一定浓度的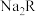 溶液中,混合溶液pY「Y表示
溶液中,混合溶液pY「Y表示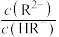 或
或 ,
, ]随pH的变化关系如图所示。下列说法错误的是
]随pH的变化关系如图所示。下列说法错误的是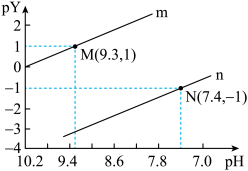
A.曲线n表示 与混合溶液pH的变化关系 与混合溶液pH的变化关系 |
B. 的数量级为 的数量级为 |
C.NaHR溶液中存在: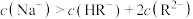 |
D.滴加稀硫酸的过程中 保持不变 保持不变 |
您最近一年使用:0次

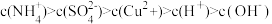
 溶液中
溶液中




