我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳的碳捕捉和碳利用技术则是关键。 的催化加氢同时发生以下反应,如
的催化加氢同时发生以下反应,如
i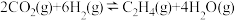
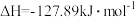
ii.
不同压强下 的平衡转化率与温度的关系如下图:
的平衡转化率与温度的关系如下图:
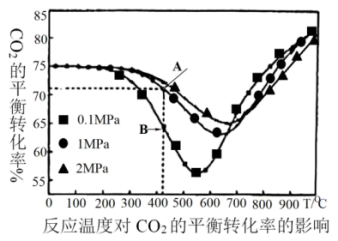
(1)400~600℃, 的平衡转化率随着压强的升高而增大,B点v正
的平衡转化率随着压强的升高而增大,B点v正___ A点v逆(填“>”或“<”或“=”)。
(2)根据图象可知,其他条件相同时,下列反应条件控制中能获得乙烯最多的是___(填序号)。
(3)在恒定压强下,随着温度的升高, 的平衡转化率先降低后升高。试分析可能原因
的平衡转化率先降低后升高。试分析可能原因__ 。
(4)一定条件下,将 和CO2[
和CO2[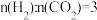 ]在某催化剂作用下,当总压稳定在p时,测得
]在某催化剂作用下,当总压稳定在p时,测得 和CO的物质的量之比为2:1,
和CO的物质的量之比为2:1, 的转化率为50.0%。则反应i的化学平衡常数Kp=
的转化率为50.0%。则反应i的化学平衡常数Kp=__ (只列算式不计算)。
 的催化加氢同时发生以下反应,如
的催化加氢同时发生以下反应,如i
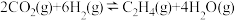
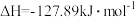
ii.

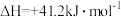
不同压强下
 的平衡转化率与温度的关系如下图:
的平衡转化率与温度的关系如下图:
(1)400~600℃,
 的平衡转化率随着压强的升高而增大,B点v正
的平衡转化率随着压强的升高而增大,B点v正(2)根据图象可知,其他条件相同时,下列反应条件控制中能获得乙烯最多的是___(填序号)。
| A.压强0.1MPa温度800℃ | B.压强4.0MPa温度300℃ |
| C.压强0.1MPa温度300℃ | D.压强4.0MPa温度800℃ |
 的平衡转化率先降低后升高。试分析可能原因
的平衡转化率先降低后升高。试分析可能原因(4)一定条件下,将
 和CO2[
和CO2[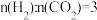 ]在某催化剂作用下,当总压稳定在p时,测得
]在某催化剂作用下,当总压稳定在p时,测得 和CO的物质的量之比为2:1,
和CO的物质的量之比为2:1, 的转化率为50.0%。则反应i的化学平衡常数Kp=
的转化率为50.0%。则反应i的化学平衡常数Kp=
2021高二·全国·专题练习 查看更多[1]
(已下线)专题2.4 化学反应的调控(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)
更新时间:2021-08-21 15:50:03
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:I.
II.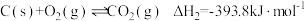
III.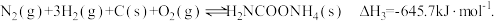
回答下列问题:
(1)写出 H2NCOONH4 分解生成 NH3 与 CO2 气体的热化学方程式:___________ 。
(2)在一定温度下,向 0.5L 密闭容器中,加入 0.1mol H2NCOONH4,实验测得 CO2 物质的量变化如下表所示:
从反应开始到 2min,用 NH3 的浓度变化表示的化学反应速率为___________ ;平衡后,H2NCOONH4 的转化率为___________ 。
(3)若在恒温恒压条件下进行反应,下列能够说明该反应已达到化学平衡状态的是___________。
(4)对该反应,改变某一条件,对化学反应速率的影响及解释不正确的是___________。
已知:I.

II.
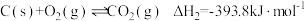
III.
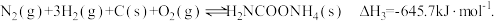
回答下列问题:
(1)写出 H2NCOONH4 分解生成 NH3 与 CO2 气体的热化学方程式:
(2)在一定温度下,向 0.5L 密闭容器中,加入 0.1mol H2NCOONH4,实验测得 CO2 物质的量变化如下表所示:
t/min | 0 | 1 | 2 | 3 | 4 |
n/mol | 0 | a | b | c | c |
(3)若在恒温恒压条件下进行反应,下列能够说明该反应已达到化学平衡状态的是___________。
| A.NH3 的浓度不再改变 | B.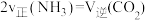 |
| C.容器体积不再改变 | D.容器内密度不再改变 |
| A.升高温度,使单位体积内活化分子百分数增加,反应速率加快 |
| B.增加反应物的量,使活化分子百分数增加,有效碰撞增多,反应速率加快 |
| C.使用催化剂能降低反应活化能,使单位体积内活化分子百分数增加,反应速率加快 |
| D.反应达平衡后,压缩体积增大压强,v 正 仍等于 v逆 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
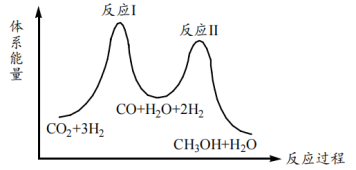
【推荐2】用CO2制备甲醇的反应原理为: 。该反应进程可通过如下图所示的两步反应实现。
。该反应进程可通过如下图所示的两步反应实现。
回答下列问题:
(1)反应I的化学方程式是___________ 。
(2)由图可知,反应___________ (填“I”或“II”)为慢反应。
(3)反应II: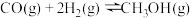 △H
△H___________ 0(填“>”“<”或“=”)。
(4)在容积可变的密闭容器中投入0.5 mol CO和1 mol H2,发生反应: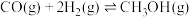 ,测得平衡时CH3OH的物质的量随温度、压强变化如下图所示。
,测得平衡时CH3OH的物质的量随温度、压强变化如下图所示。
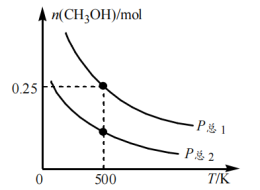
①P总1___________ P总2(填“>”“<”或“=”),判断理由是___________ 。
②若P总1=0.25 MPa,则500 K时该反应的平衡常数KP=___________  。
。
③下列措施中,能够同时增大反应速率和提高CO转化率的是___________ (填字母序号)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应体系中分离出来
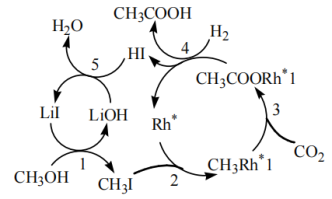
(5)最新科技报道,还可用CO2高效合成乙酸,其反应途径如下图所示,该反应总的化学方程式为___________ 。
 。该反应进程可通过如下图所示的两步反应实现。
。该反应进程可通过如下图所示的两步反应实现。
回答下列问题:
(1)反应I的化学方程式是
(2)由图可知,反应
(3)反应II:
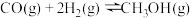 △H
△H(4)在容积可变的密闭容器中投入0.5 mol CO和1 mol H2,发生反应:
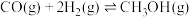 ,测得平衡时CH3OH的物质的量随温度、压强变化如下图所示。
,测得平衡时CH3OH的物质的量随温度、压强变化如下图所示。
①P总1
②若P总1=0.25 MPa,则500 K时该反应的平衡常数KP=
 。
。③下列措施中,能够同时增大反应速率和提高CO转化率的是
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应体系中分离出来
(5)最新科技报道,还可用CO2高效合成乙酸,其反应途径如下图所示,该反应总的化学方程式为

您最近一年使用:0次
【推荐3】氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)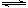 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_______ 92kJ(填“大于”、“等于”或“小于”),原因是____________ ;若加入催化剂,ΔH________ (填“变大”、“变小”或“不变”)。
(2)下列有关合成氨反应速率的叙述,不正确的是___________ (选填序号)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
e.温度升高,其平衡常数数值变小
(3)已知:分别破坏1mol N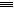 N键、1mol H
N键、1mol H H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N H键需要吸收的能量为
H键需要吸收的能量为___________ kJ。
(4)N2H4可视为:NH3分子中的H被-NH2取代的产物。
发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
则:1mol N2H4完全反应的热化学方程式为______________________ 。
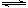 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
(2)下列有关合成氨反应速率的叙述,不正确的是
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
e.温度升高,其平衡常数数值变小
(3)已知:分别破坏1mol N
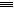 N键、1mol H
N键、1mol H H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N H键需要吸收的能量为
H键需要吸收的能量为(4)N2H4可视为:NH3分子中的H被-NH2取代的产物。
发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
则:1mol N2H4完全反应的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.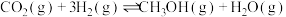
Ⅱ.

Ⅲ.

回答下列问题:
(1)
___________ kJ⋅mol-1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为___________ mol/L(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________ 。
(3)不同压强下,按照 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
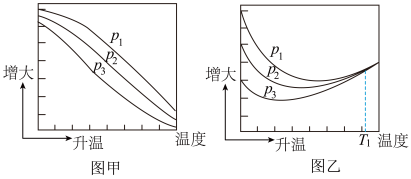
已知: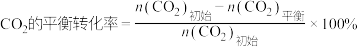
CH3OH的平衡产率=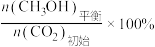
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
(5)甲醇燃料电池中甲醇在___________ (填“正”或“负”)极发生反应,酸性条件下其正极的电极反应式为___________ 。
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为___________ 。
Ⅰ.
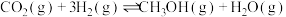
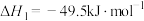
Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中
 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为(3)不同压强下,按照
 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:
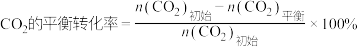
CH3OH的平衡产率=
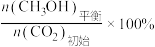
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
(5)甲醇燃料电池中甲醇在
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为
您最近一年使用:0次
【推荐2】甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______ 。
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=_______ 。
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时v正_______ v逆(填“>”“=”或“<”)。
(4)某温度下在恒容密闭容器中发生反应①,若开始加入2mol/LH2和1mol/LCO,达到平衡时,H2的平衡转化率为80%,则此温度下,该反应的化学平衡常数为_______ 。
(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为_______ ,乙中CO2的转化率_______ (填“大于”、“等于”或“小于”)甲。
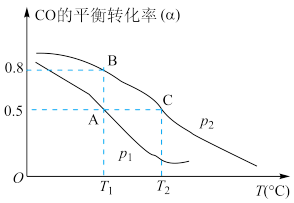
(6)在CO合成甲醇过程中,将10molCO与20molH2充入一容积可变的密闭容器中,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。下列说法正确的是_______(填字母)。
(7)工业上可利用CO或CO2来生产甲醇可能会产生积碳现象。如图表示不同温度条件下,反应Ⅰ: 发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
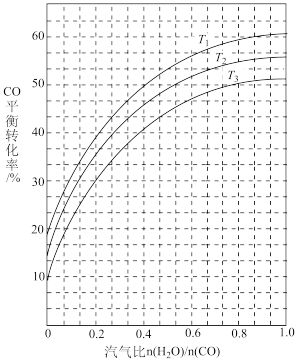
①判断 和
和 由大到小的关系为
由大到小的关系为_______ ;
②若经反应I发生后的汽气比为0.8,所得混合气体经反应II后,得到CO与H2的物质的量之比为 ,则反应II:
,则反应II: 应选择的温度是
应选择的温度是_______ (填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
| 化学反应 | 平衡常数 | 温度/ | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | ||
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时v正
(4)某温度下在恒容密闭容器中发生反应①,若开始加入2mol/LH2和1mol/LCO,达到平衡时,H2的平衡转化率为80%,则此温度下,该反应的化学平衡常数为
(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为
| 起始浓度 | 甲 | 乙 |
| c(H2)/mol/L | 0.10 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.20 |
(6)在CO合成甲醇过程中,将10molCO与20molH2充入一容积可变的密闭容器中,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。下列说法正确的是_______(填字母)。

| A.合成甲醇的反应为吸热反应 |
| B.压强为p1>p2 |
| C.A、B、C三点的平衡常数为KA=KB>KC |
| D.若达平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积也为10L |
 发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
①判断
 和
和 由大到小的关系为
由大到小的关系为②若经反应I发生后的汽气比为0.8,所得混合气体经反应II后,得到CO与H2的物质的量之比为
 ,则反应II:
,则反应II: 应选择的温度是
应选择的温度是 ”、“
”、“ ”或“
”或“ ”)。
”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】二氧化硫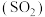 是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。
是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。
(1)利用 吸收
吸收 的离子方程式为:
的离子方程式为:_______
 ___________+□___________ (在“□”里填入系数在“___________”上填入微粒符号),加入
___________+□___________ (在“□”里填入系数在“___________”上填入微粒符号),加入 可以提高
可以提高 去除率,原因是
去除率,原因是___________ 。
(2)工业上还常用氨水吸收法处理 ,可生成
,可生成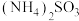 或
或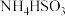 。
。
①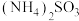 显碱性,结合化学用语,用化学平衡原理解释其原因:
显碱性,结合化学用语,用化学平衡原理解释其原因:___________ 。
②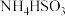 显酸性。用氨水吸收
显酸性。用氨水吸收 ,当吸收液显中性时溶液中离子浓度关系正确的是
,当吸收液显中性时溶液中离子浓度关系正确的是___________ (填字母)。
a.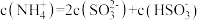
b.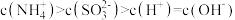
c.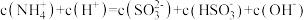
(3)某工厂烟气中主要含 、
、 ,在较高温度经下图所示方法脱除
,在较高温度经下图所示方法脱除 并制得
并制得 。
。
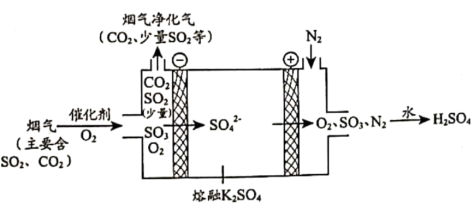
①在阴极放电的物质是___________ 。
②在阳极生成 的电极反应式是
的电极反应式是___________ 。
 是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。
是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。(1)利用
 吸收
吸收 的离子方程式为:
的离子方程式为: ___________+□___________ (在“□”里填入系数在“___________”上填入微粒符号),加入
___________+□___________ (在“□”里填入系数在“___________”上填入微粒符号),加入 可以提高
可以提高 去除率,原因是
去除率,原因是(2)工业上还常用氨水吸收法处理
 ,可生成
,可生成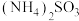 或
或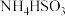 。
。①
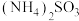 显碱性,结合化学用语,用化学平衡原理解释其原因:
显碱性,结合化学用语,用化学平衡原理解释其原因:②
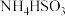 显酸性。用氨水吸收
显酸性。用氨水吸收 ,当吸收液显中性时溶液中离子浓度关系正确的是
,当吸收液显中性时溶液中离子浓度关系正确的是a.
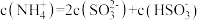
b.
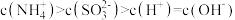
c.
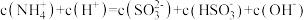
(3)某工厂烟气中主要含
 、
、 ,在较高温度经下图所示方法脱除
,在较高温度经下图所示方法脱除 并制得
并制得 。
。
①在阴极放电的物质是
②在阳极生成
 的电极反应式是
的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】(1)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)⇌CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
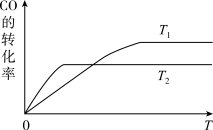
①T1______ T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1______ K2(填“>”、“<”或“=”)。
②若容器容积不变,下列措施不能增加CO转化率的是______ (填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
(2)化学需氧量(COD)可量度水体受有机物污染的程度,以K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量换算成相当于O2的含量(以mg·L-1)来计量。
①处理时,水样应酸化,最好选用______ (“稀硝酸”、“稀硫酸”、“稀盐酸”)酸化。
②在该条件下,Cr2O 最终转化为Cr3+。取水样100mL,处理该水样时消耗了10mL0.025mol·L-1的K2Cr2O7溶液,求该水样的COD
最终转化为Cr3+。取水样100mL,处理该水样时消耗了10mL0.025mol·L-1的K2Cr2O7溶液,求该水样的COD______ (写出计算过程)

①T1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
(2)化学需氧量(COD)可量度水体受有机物污染的程度,以K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量换算成相当于O2的含量(以mg·L-1)来计量。
①处理时,水样应酸化,最好选用
②在该条件下,Cr2O
 最终转化为Cr3+。取水样100mL,处理该水样时消耗了10mL0.025mol·L-1的K2Cr2O7溶液,求该水样的COD
最终转化为Cr3+。取水样100mL,处理该水样时消耗了10mL0.025mol·L-1的K2Cr2O7溶液,求该水样的COD
您最近一年使用:0次
【推荐2】乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为C2H5OH(g)+IB(g) ETBE(g) ΔH。回答下列问题:
ETBE(g) ΔH。回答下列问题:
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的ΔH=a kJ/mol,下列选项正确的是_____________ (填序号)。
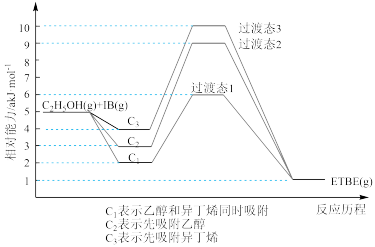
A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1∶1充入乙醇和异丁烯,在温度为378K与388K时异丁烯的转化率随时间变化如图所示。
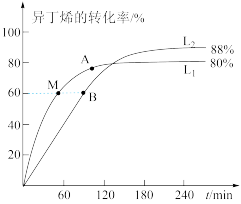
①图中A、M两点,正反应速率由大到小的顺序为_____ ,图中A、M、B三点其中逆反应速率最大的点是_______________ (用符号A、M、B填写)。
②388K时,容器内起始总压为P0Pa,用分压表示的该反应的平衡常数Kp=_________ Pa (用含有P0的式子表示,已知分压=总压×物质的量分数)。
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为: (其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
(其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是___ (填序号,K正、K逆为正、逆速率常数)。
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
已知反应速率v=v正-v逆=K正P(C2H5OH)·P(IB)-K逆P(ETBE),计算上图中M点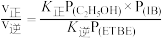 =
=_______________ (保留两位小数)。
 ETBE(g) ΔH。回答下列问题:
ETBE(g) ΔH。回答下列问题:(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的ΔH=a kJ/mol,下列选项正确的是

A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1∶1充入乙醇和异丁烯,在温度为378K与388K时异丁烯的转化率随时间变化如图所示。

①图中A、M两点,正反应速率由大到小的顺序为
②388K时,容器内起始总压为P0Pa,用分压表示的该反应的平衡常数Kp=
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:
 (其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
(其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
已知反应速率v=v正-v逆=K正P(C2H5OH)·P(IB)-K逆P(ETBE),计算上图中M点
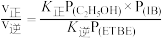 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】“氢经济”是“双碳”转型中非常关键的一环。大量安全制空是关键技术之一。
方法一:甲烷-水蒸气催化重整法。其涉及的主要反应如下:
反应I:

反应Ⅱ:
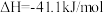
(1)反应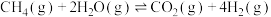 能自发进行的条件是
能自发进行的条件是________ (填“高温”“低温”或“任何温度下”)
(2)为了提高 的平衡转化率,同时提高CO的浓度,可以采取的措施是________(填字母)。
的平衡转化率,同时提高CO的浓度,可以采取的措施是________(填字母)。
(3)恒定压强为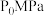 时,将
时,将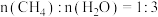 的混合气体投入反应器中发生反应I和Ⅱ,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中发生反应I和Ⅱ,平衡时,各组分的物质的量分数与温度的关系如图所示。 的物质的量分数与温度的变化曲线是
的物质的量分数与温度的变化曲线是________ (填字母)。
②系统中 的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:________ 。
③600℃时,计算反应Ⅱ的平衡常数
________ ( 是以分压表示的平衡常数,分压=总压
是以分压表示的平衡常数,分压=总压 物质的量分数,结果可用分数表示)。
物质的量分数,结果可用分数表示)。
方法二:甲醇催化脱空法。催化反应的部分机理如下:
历程i: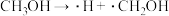 历程ii:
历程ii: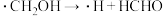
历程iii: 历程iv:
历程iv: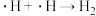
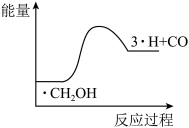
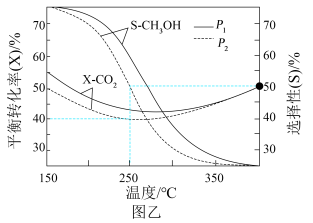
(4)在一个2L恒容密闭容器中投入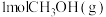 ,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)分别与温度的关系如左图所示。700℃时,历程iii能量~反应过程如右图所示,在图上画出历程ii的“能量~反应过程”示意图
,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)分别与温度的关系如左图所示。700℃时,历程iii能量~反应过程如右图所示,在图上画出历程ii的“能量~反应过程”示意图________ 。
方法一:甲烷-水蒸气催化重整法。其涉及的主要反应如下:
反应I:


反应Ⅱ:

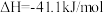
(1)反应
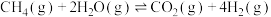 能自发进行的条件是
能自发进行的条件是(2)为了提高
 的平衡转化率,同时提高CO的浓度,可以采取的措施是________(填字母)。
的平衡转化率,同时提高CO的浓度,可以采取的措施是________(填字母)。| A.使用高效催化剂 | B.升高温度 |
| C.增大压强 | D.增大 和 和 物质的量之比 物质的量之比 |
(3)恒定压强为
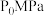 时,将
时,将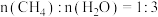 的混合气体投入反应器中发生反应I和Ⅱ,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中发生反应I和Ⅱ,平衡时,各组分的物质的量分数与温度的关系如图所示。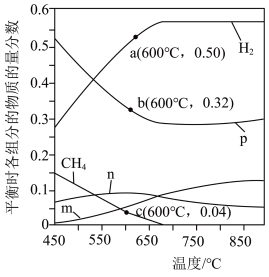
 的物质的量分数与温度的变化曲线是
的物质的量分数与温度的变化曲线是②系统中
 的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:③600℃时,计算反应Ⅱ的平衡常数

 是以分压表示的平衡常数,分压=总压
是以分压表示的平衡常数,分压=总压 物质的量分数,结果可用分数表示)。
物质的量分数,结果可用分数表示)。方法二:甲醇催化脱空法。催化反应的部分机理如下:
历程i:
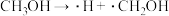 历程ii:
历程ii: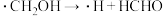
历程iii:
 历程iv:
历程iv: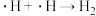
(4)在一个2L恒容密闭容器中投入
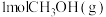 ,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)分别与温度的关系如左图所示。700℃时,历程iii能量~反应过程如右图所示,在图上画出历程ii的“能量~反应过程”示意图
,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)分别与温度的关系如左图所示。700℃时,历程iii能量~反应过程如右图所示,在图上画出历程ii的“能量~反应过程”示意图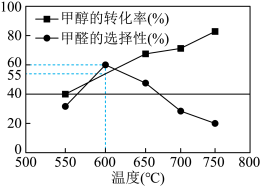
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】由 合成甲醇是
合成甲醇是 资源化利用的重要方法。涉及的主要反应如下:
资源化利用的重要方法。涉及的主要反应如下:
反应Ⅰ: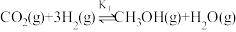

反应Ⅱ: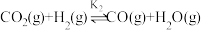

回答下列问题:
(1)反应Ⅰ、Ⅱ的lnK与温度T的关系如图甲所示。
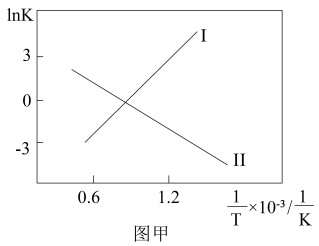

________ 0(填“>”“=”或“<”);反应 的化学平衡常数K=
的化学平衡常数K=________ (用K1、K2的代数式表示),升高温度,K________ (填“增大”“减小”或“不变”)。
(2)起始按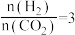 投料发生上述反应Ⅰ、Ⅱ,测
投料发生上述反应Ⅰ、Ⅱ,测 的平衡转化率(
的平衡转化率(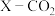 )和
)和 的选择性(
的选择性(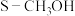 )随温度、压强的变化如图乙所示。
)随温度、压强的变化如图乙所示。
已知: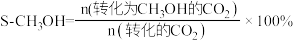
则p1________ p2(填“>”或“<”),不改变温度和压强,能提高甲醇选择性的措施有________ ;350℃时,p1和p2下的 平衡转化率几乎交于一点的原因是
平衡转化率几乎交于一点的原因是________ ;250℃,压强为p2时,反应Ⅱ的平衡常数Kx=________ (保留2位有效数字)。
 合成甲醇是
合成甲醇是 资源化利用的重要方法。涉及的主要反应如下:
资源化利用的重要方法。涉及的主要反应如下:反应Ⅰ:
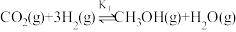

反应Ⅱ:
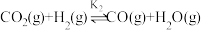

回答下列问题:
(1)反应Ⅰ、Ⅱ的lnK与温度T的关系如图甲所示。


 的化学平衡常数K=
的化学平衡常数K=(2)起始按
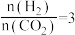 投料发生上述反应Ⅰ、Ⅱ,测
投料发生上述反应Ⅰ、Ⅱ,测 的平衡转化率(
的平衡转化率(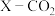 )和
)和 的选择性(
的选择性(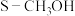 )随温度、压强的变化如图乙所示。
)随温度、压强的变化如图乙所示。
已知:
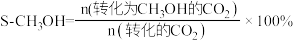
则p1
 平衡转化率几乎交于一点的原因是
平衡转化率几乎交于一点的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________ ,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________ (已知 )
)
(2)2NO(g)+O2(g) 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应2NO(g)+O2(g)  2NO2(g)的△H
2NO2(g)的△H______ (用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,若升高温度,K将
2NO2(g)达到平衡状态,若升高温度,K将____ (填“增大”、“减小”或“不变”),平衡常数的表达式K=____ (用 、
、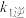 、
、 、
、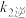 表示)
表示)
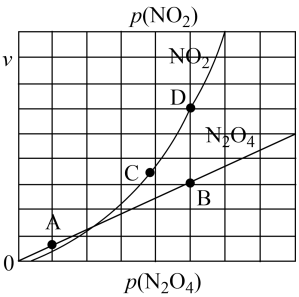
(3)反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中 、
、 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
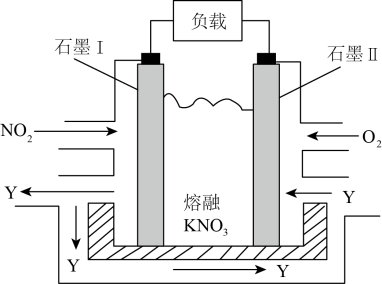
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式
 )
)(2)2NO(g)+O2(g)
 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:| 反应 | 速率表达式 | 反应热 |
反应I:2NO(g)  N2O2(g)(快) N2O2(g)(快) | 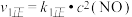 , , | △H1<0 |
反应II:N2O2(g)+O2(g)  2NO2(g)(慢) 2NO2(g)(慢) | 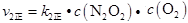 , ,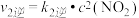 | △H2<0 |
 2NO2(g)的△H
2NO2(g)的△H 2NO2(g)达到平衡状态,若升高温度,K将
2NO2(g)达到平衡状态,若升高温度,K将 、
、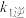 、
、 、
、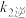 表示)
表示)(3)反应N2O4(g)
 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中 、
、 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是
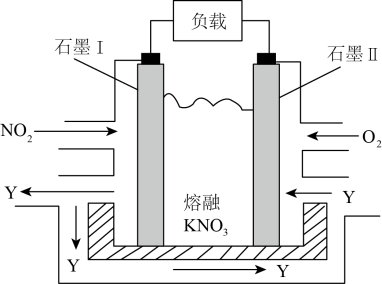
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+ O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___ 。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___ ;该反应的平衡常数Kp=___ Pa。若提高C3H8的平衡转化率,可采取的措施有___ (填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
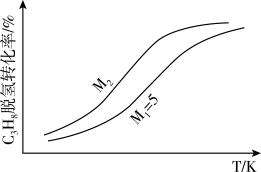
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___ 5(填“>”或“<”)。
(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是___ 。反应气中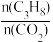 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时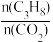 的配比是
的配比是___ 。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+
 O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/molH2(g)+
 O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2

(4)已知高温下C-C键断裂反应比C-H键断裂的脱氢反应容易发生,这将导致丙烯选择性降低;同时高温加剧催化剂表面积炭,导致催化剂迅速失活。在生产中充入CO2的作用之一是利于催化剂活性保持,其原因是
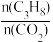 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时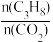 的配比是
的配比是 | C3H8转化率(%) | C3H6选择性(%) | C3H6收率(%) |
| 1:1.3 | 14.8 | 85.1 | 12.6 |
| 1:2.4 | 23.2 | 82.8 | |
| 1:3.6 | 22.8 | 83.5 | |
| 1:6.8 | 18.0 | 60.3 | 10.9 |
您最近一年使用:0次



