已知:常温下, 。某温度下,饱和溶液中
。某温度下,饱和溶液中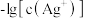 与
与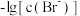 、
、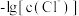 的关系如图所示。
的关系如图所示。
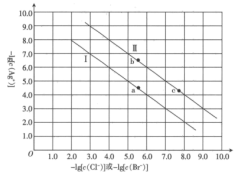
下列说法正确的是
 。某温度下,饱和溶液中
。某温度下,饱和溶液中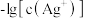 与
与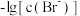 、
、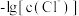 的关系如图所示。
的关系如图所示。
下列说法正确的是
A.曲线Ⅱ代表 的沉淀溶解平衡曲线 的沉淀溶解平衡曲线 |
B.常温下, 的 的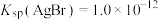 |
C.常温下,当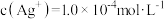 时,饱和溶液中 时,饱和溶液中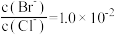 |
D.加入 固体可使溶液由 固体可使溶液由 点沿直线变为 点沿直线变为 点 点 |
21-22高三上·河北·开学考试 查看更多[4]
河北省2022届高三上学期9月份开学摸底联考化学试题(已下线)第21讲 难溶电解质的沉淀溶解平衡(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)水溶液中的离子反应与平衡——课时6沉淀溶解平衡(已下线)2019年高考海南卷化学试题变式题(不定项选择题)
更新时间:2021-09-06 15:35:20
|
相似题推荐
多选题
|
适中
(0.65)
【推荐1】常温时,向20 mL0.1000 mol/L H2C2O4溶液中滴加0.1000 mol·L-1NaOH溶液,混合溶液pH随加入NaOH溶液体积的变化如图所示。下列有关叙述正确的是


| A.点①、③、④所示溶液中,点③所示溶液H2O的电离程度最小 |
B.点②所示溶液中: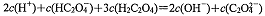 |
C.点③所示溶液中: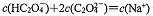 |
D.滴定过程中可能出现: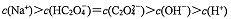 |
您最近一年使用:0次
多选题
|
适中
(0.65)
【推荐2】常温下向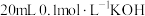 溶液中加入
溶液中加入 的醋酸,溶液
的醋酸,溶液 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是

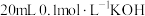 溶液中加入
溶液中加入 的醋酸,溶液
的醋酸,溶液 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是
A. |
B.a、b两点所示溶液中水的电离程度: |
C.当 时,有 时,有 |
D.b点所示溶液中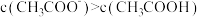 |
您最近一年使用:0次
多选题
|
适中
(0.65)
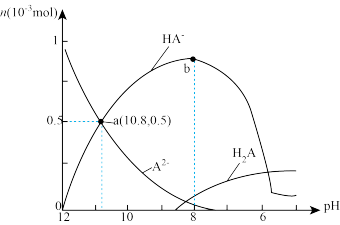
【推荐3】常温下,向 溶液中逐滴加入0.2
溶液中逐滴加入0.2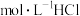 溶液10.0
溶液10.0 ,溶液中微粒的物质的量(挥发的
,溶液中微粒的物质的量(挥发的 未画出)随
未画出)随 的变化如下图所示。下列说法正确的是
的变化如下图所示。下列说法正确的是
 溶液中逐滴加入0.2
溶液中逐滴加入0.2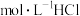 溶液10.0
溶液10.0 ,溶液中微粒的物质的量(挥发的
,溶液中微粒的物质的量(挥发的 未画出)随
未画出)随 的变化如下图所示。下列说法正确的是
的变化如下图所示。下列说法正确的是
| A.随着盐酸的加入,溶液中水的电离程度先减小后增大 |
B. 的水解常数 的水解常数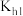 的数量级约为 的数量级约为 |
C.a点对应溶液中离子浓度: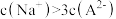 |
D.b点对应溶液中: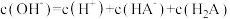 |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
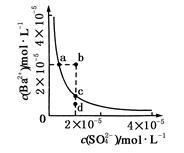
【推荐1】某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)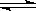 Ba2+(aq)+SO(aq) Ksp=c(Ba2+)·c(SO ),沉淀溶解平衡曲线如图所示。 下列说法正确的是
Ba2+(aq)+SO(aq) Ksp=c(Ba2+)·c(SO ),沉淀溶解平衡曲线如图所示。 下列说法正确的是
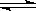 Ba2+(aq)+SO(aq) Ksp=c(Ba2+)·c(SO ),沉淀溶解平衡曲线如图所示。 下列说法正确的是
Ba2+(aq)+SO(aq) Ksp=c(Ba2+)·c(SO ),沉淀溶解平衡曲线如图所示。 下列说法正确的是
| A.b点时c(Ba2+)·c(SO )小于Ksp |
| B.a点对应的Ksp等于c点对应的Ksp |
| C.加水稀释可以使溶液由b点变到c点 |
| D.加入适量的Na2SO4可以使溶液由a点变到c点 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t °C时AgCl的Ksp=4×10-10,下列说法不正确的是
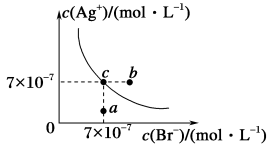

| A.图中a点有AgBr沉淀析出 |
| B.在t°C时,AgBr的Ksp数值为4.9×10-13 |
| C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| D.在t°C时,AgCl(s)+Br-(aq)⇌AgBr(s)+Cl-(aq)的平衡常数K≈816 |
您最近一年使用:0次

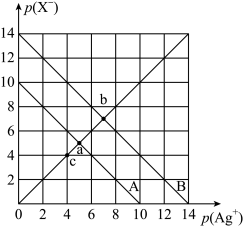
 AgBr(s)+Cl-(aq)的平衡常数K=104
AgBr(s)+Cl-(aq)的平衡常数K=104

