已知:pM为阳离子浓度的负对数,pR为阴离子浓度的负对数。常温下,CaSO4、CaCO3、MnCO3三种物质的pM与pR的关系如图所示,下列说法错误的是
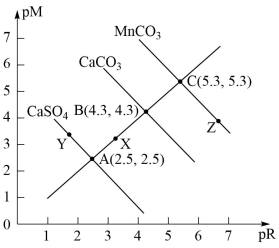

| A.常温下,溶度积:CaSO4>CaCO3>MnCO3 |
| B.X点对CaSO4要析出沉淀,X点对CaCO3是不饱和溶液,能继续溶解CaCO3 |
C.Y点:c(SO )>c(Ca2+),二者的溶度积等于10-5 )>c(Ca2+),二者的溶度积等于10-5 |
D.Z点:c(CO )<c(Mn2+),二者的溶度积等于10-10.6 )<c(Mn2+),二者的溶度积等于10-10.6 |
更新时间:2021-09-23 19:02:11
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是
| A.某物质的溶液中由水电离出的c(H+)=1×10-a mol•L-1,若a>7时,则该溶液的pH一定为14-a |
| B.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②(NH4)2SO4、③CH3COONH4、④NH3·H2O;c(NH4+)由大到小的顺序是:②>①>③>④ |
| C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
D.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl―(aq),往其中加入少量NaCl粉末,平衡会向左移动,Ksp减少 Ag+(aq)+Cl―(aq),往其中加入少量NaCl粉末,平衡会向左移动,Ksp减少 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,下列溶液中各离子浓度关系正确的是
| A.0.1mol·L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S) |
B.浓度为0.1mol·L-1的碳酸钠溶液:2c(Na+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
| C.0.1mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol·L-1盐酸③0.01mol·L-1氯化镁溶液④0.1mol·L-1硝酸银溶液中Ag+的浓度①>④=②>③ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】常温时,PbR(R2-为 或CO
或CO )的沉淀溶解平衡关系图如图所示。已知常温碳酸铅的溶解度小于硫酸铅,下列说法正确的是
)的沉淀溶解平衡关系图如图所示。已知常温碳酸铅的溶解度小于硫酸铅,下列说法正确的是
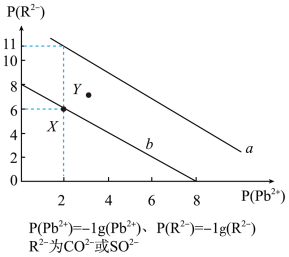
 或CO
或CO )的沉淀溶解平衡关系图如图所示。已知常温碳酸铅的溶解度小于硫酸铅,下列说法正确的是
)的沉淀溶解平衡关系图如图所示。已知常温碳酸铅的溶解度小于硫酸铅,下列说法正确的是
| A.b表示PbCO3 |
| B.常温下将澄清饱和的PbCO3溶液和澄清饱和的PbSO4溶液等体积混合,混合后溶液变浑浊,并产生PbSO4沉淀 |
C.当PbSO4和PbCO3沉淀共存时,溶液中 和 和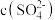 的比是1×105 的比是1×105 |
D.向0.1mol/L的Na2SO4溶液中加入等体积0.12mol/LPb(NO3)2(忽略体积变化),反应后溶液中的c( )=1×106mol·L-1 )=1×106mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知 时,
时,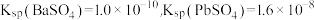 。用
。用 的
的 溶液滴定
溶液滴定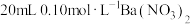 溶液,滴定过程中
溶液,滴定过程中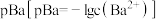 随硫酸溶液体积的变化如图所示。下列说法正确的是
随硫酸溶液体积的变化如图所示。下列说法正确的是
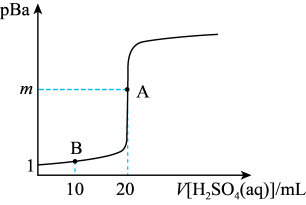
 时,
时,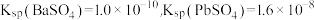 。用
。用 的
的 溶液滴定
溶液滴定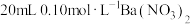 溶液,滴定过程中
溶液,滴定过程中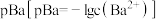 随硫酸溶液体积的变化如图所示。下列说法正确的是
随硫酸溶液体积的变化如图所示。下列说法正确的是
A.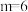 |
| B.可选用甲基橙作指示剂,达到滴定终点时溶液从黄色变为橙色 |
C.B点溶液中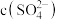 约为 约为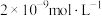 |
D.若将 溶液变为 溶液变为 溶液,则A点将向下移动 溶液,则A点将向下移动 |
您最近一年使用:0次
【推荐2】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)],已知该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的是( )
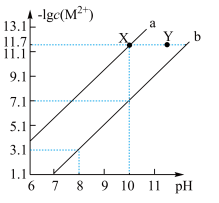

| A.a线表示Fe(OH)2饱和溶液中的变化关系 |
| B.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 |
| C.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
D.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中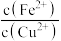 =104.6 =104.6 |
您最近一年使用:0次
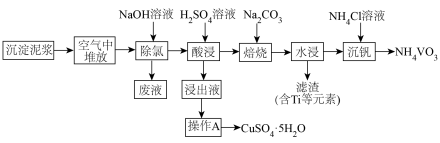
【推荐3】某工厂废液经简易处理后的沉淀泥浆中含有大量废铜丝和少量 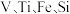 元素氯化物及复杂化合物,一种以该沉淀泥浆为原料回收铜与钒的工艺流程如图所示
元素氯化物及复杂化合物,一种以该沉淀泥浆为原料回收铜与钒的工艺流程如图所示
已知:常温下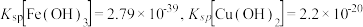 ,溶液中的离子浓度小于
,溶液中的离子浓度小于  时可以认为已经除尽。下列说法
时可以认为已经除尽。下列说法错误的 是
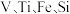 元素氯化物及复杂化合物,一种以该沉淀泥浆为原料回收铜与钒的工艺流程如图所示
元素氯化物及复杂化合物,一种以该沉淀泥浆为原料回收铜与钒的工艺流程如图所示
已知:常温下
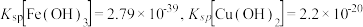 ,溶液中的离子浓度小于
,溶液中的离子浓度小于  时可以认为已经除尽。下列说法
时可以认为已经除尽。下列说法| A.泥浆在空气中堆放可使铜被氧化,该操作便于后续酸浸时铜进入溶液 |
| B.操作 A依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
C.若浸出液中  的浓度为 的浓度为 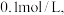 则酸浸时可调 则酸浸时可调  |
D.“沉钒”时,增大  溶液的浓度,可提高钒的回收率 溶液的浓度,可提高钒的回收率 |
您最近一年使用:0次



