为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图所示:
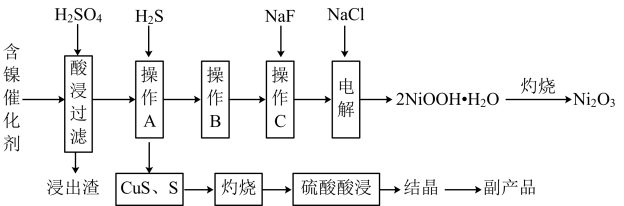
已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
②常温下,Ksp(CaF2)=2.7×10-11。
请回答下列问题:
(1)浸出渣的成分是:___________ ,写出通入H2S时发生所有反应的离子方程式:___________
(2)“操作B”的过程是,先在40~50℃加入H2O2,其作用是___________ (用离子方程式表示);再调pH至3.7~7.7,操作B可除去溶液中的___________ (填元素名称)元素。
(3)电解沉镍的过程中,产物2NiOOH·H2O在电解池的___________ (填“阳极”或“阴极)附近产生,可以看成是氯气在强碱性环境下氧化溶液中的镍元素而来,写出该反应的离子方程式___________
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3.0×10-3mol·L-1,则溶液中 =
=___________ 。

已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
请回答下列问题:
(1)浸出渣的成分是:
(2)“操作B”的过程是,先在40~50℃加入H2O2,其作用是
(3)电解沉镍的过程中,产物2NiOOH·H2O在电解池的
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3.0×10-3mol·L-1,则溶液中
 =
=
2021·全国·模拟预测 查看更多[3]
更新时间:2021-09-30 10:49:57
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铁、银及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
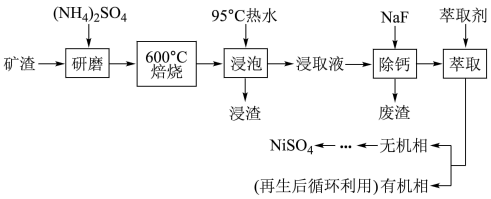
已知:(NH4)2SO4在350℃时分解生成NH3和H2SO4。
回答下列问题:
(1)基态Ni原子的价层电子排布图为__________ ,与Ni元素同周期,基态原子有1个未成对电子的金属元素有___________ 种。
(2)“浸渣”的成分有Fe2O3、FeO(OH),SiO2外,还含有___________ (写化学式)。
(3)矿渣中部分FeO在空气中焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_________ 。
(4)将“浸取液”冷却到室温,测得溶液中c(Ca2+)=l.0×10-3mol・L-1,向其中加入一定量的NaF晶体,搅拌,当溶液中c(F‑)=1.0×10-3mol·L-1时,除钙率为___________ %[室温时,Ksp(CaF2)=4.0×10‑11,除钙率=1- ]。
]。
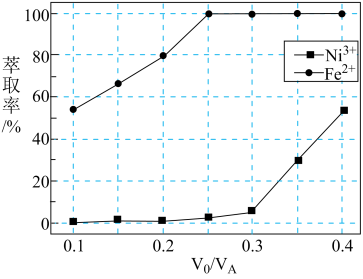
(5)采用萃取操作可对溶液中的金属离子进行富集与分离:Fe2+(水相)+2HR(有机相)⇌FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(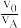 )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,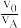 的最佳取值为
的最佳取值为___________ 。有机相中加入稀硫酸可以使萃取剂再生,反应的离子方程式为___________ 。
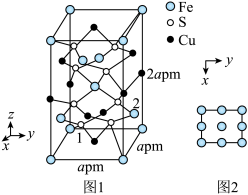
(6)CuFeS2晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如图1中原子1的分数坐标为( ,
, ,
, ),则原子2
),则原子2__________ 。

已知:(NH4)2SO4在350℃时分解生成NH3和H2SO4。
回答下列问题:
(1)基态Ni原子的价层电子排布图为
(2)“浸渣”的成分有Fe2O3、FeO(OH),SiO2外,还含有
(3)矿渣中部分FeO在空气中焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(4)将“浸取液”冷却到室温,测得溶液中c(Ca2+)=l.0×10-3mol・L-1,向其中加入一定量的NaF晶体,搅拌,当溶液中c(F‑)=1.0×10-3mol·L-1时,除钙率为
 ]。
]。(5)采用萃取操作可对溶液中的金属离子进行富集与分离:Fe2+(水相)+2HR(有机相)⇌FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(
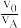 )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,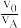 的最佳取值为
的最佳取值为
(6)CuFeS2晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如图1中原子1的分数坐标为(
 ,
, ,
, ),则原子2
),则原子2
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),制备高效水处理剂聚合硫酸铁铝的流程如下:
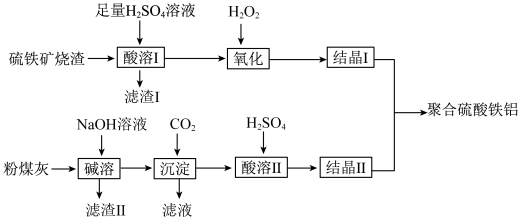
已知:SiO2既不溶于H2SO4溶液,也不和H2SO4溶液反应。
(1)“酸溶Ⅰ”得到的溶液中所含的金属阳离子主要有___________ 。
(2)“氧化”时,若用氯水代替H2O2,
①发生反应的离子方程式为___________ 。
②与使用氯水相比,“氧化”时使用H2O2的优点是___________ 。
(3)“碱溶”时,Al2O3发生反应的化学方程式为___________ 。
(4)在流程中可以循环利用的是___________ (填“滤渣Ⅰ”、“滤渣Ⅱ”或“滤渣Ⅰ和滤渣Ⅱ”)。
(5)向Fe3O4、FeO的固体混合物中,加入足量H2SO4溶液,充分反应后,向溶液中再加入足量铜粉,充分搅拌反应,得到的溶液中离子浓度比为c(Cu2+):c(Fe2+)=2:7,则固体混合物中物质的量比n(Fe3O4):n(FeO)为___________ 。

已知:SiO2既不溶于H2SO4溶液,也不和H2SO4溶液反应。
(1)“酸溶Ⅰ”得到的溶液中所含的金属阳离子主要有
(2)“氧化”时,若用氯水代替H2O2,
①发生反应的离子方程式为
②与使用氯水相比,“氧化”时使用H2O2的优点是
(3)“碱溶”时,Al2O3发生反应的化学方程式为
(4)在流程中可以循环利用的是
(5)向Fe3O4、FeO的固体混合物中,加入足量H2SO4溶液,充分反应后,向溶液中再加入足量铜粉,充分搅拌反应,得到的溶液中离子浓度比为c(Cu2+):c(Fe2+)=2:7,则固体混合物中物质的量比n(Fe3O4):n(FeO)为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】钛合金密度较小,常温下特别稳定,耐酸碱腐蚀,韧性好,高温下海绵状钛能与氧气反应,是航空、军工、电力等领域的必须金属材料。
Ⅰ.由钛铁矿(主要成分是钛酸亚铁: ,还含有少量
,还含有少量 、
、 等杂质)制备
等杂质)制备 的一种工艺流程示意如下:
的一种工艺流程示意如下:
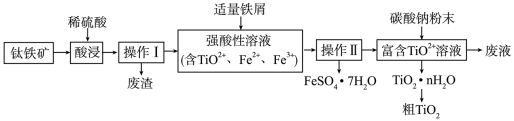
回答下列问题:
(1) 中Ti的化合价为
中Ti的化合价为_______ 。
(2)“酸浸”中, 反应的离子方程式为
反应的离子方程式为_______ 。
(3)加入铁屑的作用是_______ 。
(4)①实验室完成“操作Ⅰ”需用到的玻璃仪器有烧杯、_______ ,废渣的主要成分是_______ ,②实验室完成“操作Ⅱ”包含的具体操作有蒸发浓缩,_______ ,过滤,洗涤,干燥。
Ⅱ.以 为原料,采用亨特(Hunter)法生产钛的流程如下:
为原料,采用亨特(Hunter)法生产钛的流程如下:
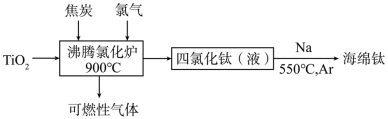
(5)沸腾氯化炉中反应的化学方程式为_______ 。
(6)制备海绵钛中Ar的作用是_______ 。
Ⅰ.由钛铁矿(主要成分是钛酸亚铁:
 ,还含有少量
,还含有少量 、
、 等杂质)制备
等杂质)制备 的一种工艺流程示意如下:
的一种工艺流程示意如下:
回答下列问题:
(1)
 中Ti的化合价为
中Ti的化合价为(2)“酸浸”中,
 反应的离子方程式为
反应的离子方程式为(3)加入铁屑的作用是
(4)①实验室完成“操作Ⅰ”需用到的玻璃仪器有烧杯、
Ⅱ.以
 为原料,采用亨特(Hunter)法生产钛的流程如下:
为原料,采用亨特(Hunter)法生产钛的流程如下:
(5)沸腾氯化炉中反应的化学方程式为
(6)制备海绵钛中Ar的作用是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:
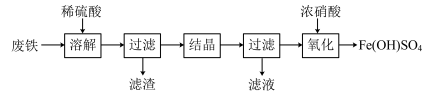
已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。
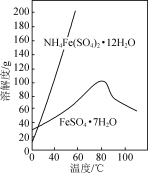
(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________ 。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________ ,溶解时铁需过量的原因是________________ 。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________ 。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________ (任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________ (已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。

已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。

(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是
(2)溶解时控制溶液温度为70~80 ℃,目的是
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】钴及其化合物广泛应用于航天、电池、磁性合金等高科技领域,我国钴资源贫乏,再生钴资源的回收利用是解决钴资源供给的重要途径。一种利用含钴废料(主要成分为 ,含少量
,含少量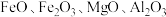 、有机物)制取
、有机物)制取 的工艺流程如图:
的工艺流程如图: ,回答下列问题:
,回答下列问题:
(1)“焙烧”的主要目的是_______ 。
(2)“浸取”过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)“沉淀”时先加入 溶液,
溶液, 的作用主要是
的作用主要是_______ ;再加入 溶液调节
溶液调节 为5.0,此时滤液中的
为5.0,此时滤液中的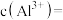
_______  。
。
(4)“萃取”用到的玻璃仪器主要有_______ 、烧杯,萃取原理可表述为: (水层)
(水层) (有机层)
(有机层)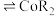 (有机层)
(有机层) (水层)。已知
(水层)。已知 萃取率随
萃取率随 变化如图所示,分析其变化原因
变化如图所示,分析其变化原因_______ 。水相中含有的阳离子有_______ 。 ,反应的离子方程式为
,反应的离子方程式为_______ 。
 ,含少量
,含少量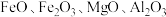 、有机物)制取
、有机物)制取 的工艺流程如图:
的工艺流程如图: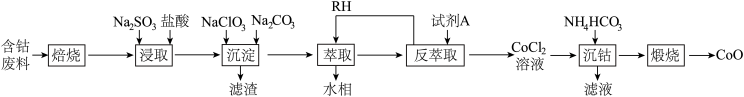
 ,回答下列问题:
,回答下列问题:| 金属离子 |  |  |  |  |  |
开始沉淀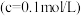 的 的 | 7.5 | 1.8 | 3.4 | 9.1 | 6.5 |
沉淀完全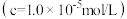 的 的 | 9.5 | 3.2 | 4.7 | 11.1 | 8.5 |
(1)“焙烧”的主要目的是
(2)“浸取”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(3)“沉淀”时先加入
 溶液,
溶液, 的作用主要是
的作用主要是 溶液调节
溶液调节 为5.0,此时滤液中的
为5.0,此时滤液中的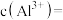
 。
。(4)“萃取”用到的玻璃仪器主要有
 (水层)
(水层) (有机层)
(有机层)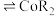 (有机层)
(有机层) (水层)。已知
(水层)。已知 萃取率随
萃取率随 变化如图所示,分析其变化原因
变化如图所示,分析其变化原因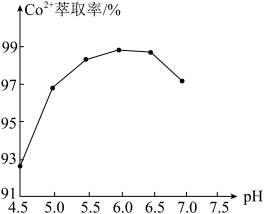
 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】V2O5是化工生产中重要的催化剂,可用于制备硫酸和彩色玻璃。一种以含钒废料(主要成分为V2O3,还含有Fe2O3、Al2O3、CuO、有机物杂质)制备V2O5的工艺流程如下图所示。
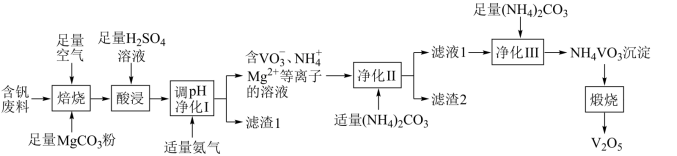
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②该流程温度下:Ksp[Fe(OH)3]=8.0×10-38;Ksp[Al(OH)3]=1.0×10-33;Ksp[Cu(OH)2]=1.0×10-19
请回答下列问题:
(1)“焙烧”的目的之一是将V2O3转化为Mg(VO3)2,还有一个目的是_______ ;
(2)已知Mg(VO3)2难溶于水,能溶于酸,写出在“酸浸”时(pH<2)发生的离子反应方程式_______ 。为提高酸浸速率,可采取的措施_______ (填序号)。
a.使用98%的硫酸 b.加速搅拌
c.升高温度 d.增大压强
(3)“调pH净化I”时需将Fe3+、Al3+、Cu2+三种离子去除干净(浓度<1×10-5 mol∙L-1时视为去除干净),需调节pH范围为_______ (pH值保留1位小数)。
(4)“净化II”时,若加入过量(NH4)2CO3,可能导致的结果是_______ 。
(5)“煅烧”时,改变环境会得到不同产物,但都会有V2O5生成。若煅烧时隔绝空气,还生成物质A和一种参与大气循环的物质,且A可在该流程中循环使用,则A的化学式为_______ ;若煅烧时通入空气,还生成两种参与大气循环的物质,该反应的化学方程式为_______ 。

已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  |  |
请回答下列问题:
(1)“焙烧”的目的之一是将V2O3转化为Mg(VO3)2,还有一个目的是
(2)已知Mg(VO3)2难溶于水,能溶于酸,写出在“酸浸”时(pH<2)发生的离子反应方程式
a.使用98%的硫酸 b.加速搅拌
c.升高温度 d.增大压强
(3)“调pH净化I”时需将Fe3+、Al3+、Cu2+三种离子去除干净(浓度<1×10-5 mol∙L-1时视为去除干净),需调节pH范围为
(4)“净化II”时,若加入过量(NH4)2CO3,可能导致的结果是
(5)“煅烧”时,改变环境会得到不同产物,但都会有V2O5生成。若煅烧时隔绝空气,还生成物质A和一种参与大气循环的物质,且A可在该流程中循环使用,则A的化学式为
您最近一年使用:0次
【推荐1】铊(T1)在工业中的用途非常广泛。从某铅锌厂的电尘(主要成分为PbO、ZnO还含有少量Fe2O3、T12O)中回收铊的工艺流程如图所示:
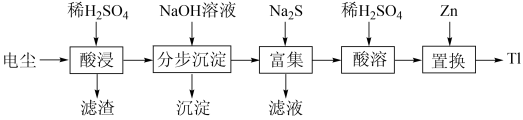
已知:①Zn(OH)2为两性氢氧化物,溶液pH=10.0时开始溶解。
②常温下,相关离子开始沉淀和沉淀完全时的pH如下表所示:
回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有_______ (写出一种)。
(2)为提高电尘的转化率,利用洗涤后的滤渣检验“酸浸”是否充分,其实验操作__________ 。
(3)“滤渣”的主要成分是_______ (填化学式),由于沉淀颗粒很细,通常在“酸浸”时还需要加入絮凝剂,其目的是_______ 。
(4)“分步沉淀”时,先形成的沉淀为_______ (填化学式)。沉淀第二种离子时调节溶液pH的范围为_______ ,当其恰好完全沉淀,则溶液中先沉淀的离子浓度为_______ 。
(5)“酸溶”中发生反应的离子方程式是_______ 。

已知:①Zn(OH)2为两性氢氧化物,溶液pH=10.0时开始溶解。
②常温下,相关离子开始沉淀和沉淀完全时的pH如下表所示:
| 离子 | Fe3+ | Zn2+ |
| 开始沉淀的pH | 2.7 | 6.4 |
| 沉淀完全的pH | 3.7 | 8.0 |
(1)为提高“酸浸”效率,可采取的措施有
(2)为提高电尘的转化率,利用洗涤后的滤渣检验“酸浸”是否充分,其实验操作
(3)“滤渣”的主要成分是
(4)“分步沉淀”时,先形成的沉淀为
(5)“酸溶”中发生反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)在下列溶液中c(H+)由小到大排列的是____ (填序号),pH由小到大的排列是____ (填序号)。
①0.1mol/LHCl溶液②0.1mol/LH2SO4溶液③0.1mol/LNaOH溶液④0.1mol/LCH3COOH溶液
(2)①某工厂用NaOH溶液吸收尾气,得到Na2S,Na2S水解的离子方程式为____ ,溶液显_____ 性。(填“酸”、“碱”“中”)。
②草木灰与铵态氮肥不能混合施用,其原因是____ 。
③实验室配置FeCl3溶液,常常把FeCl3晶体溶于浓盐酸中,然后再加水稀释到所需要的浓度。这样做的理由是_____ 。
(3)①已知25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1mol•-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____ 沉淀(填化学式),生成该沉淀的离子方程式为____ 。
②已知25℃时,Ksp(AgCl)=1.8×10-10,则将AgCl加入蒸馏水中形成饱和溶液,溶液中的c(Ag+)约为_____ mol•L-1。
(1)在下列溶液中c(H+)由小到大排列的是
①0.1mol/LHCl溶液②0.1mol/LH2SO4溶液③0.1mol/LNaOH溶液④0.1mol/LCH3COOH溶液
(2)①某工厂用NaOH溶液吸收尾气,得到Na2S,Na2S水解的离子方程式为
②草木灰与铵态氮肥不能混合施用,其原因是
③实验室配置FeCl3溶液,常常把FeCl3晶体溶于浓盐酸中,然后再加水稀释到所需要的浓度。这样做的理由是
(3)①已知25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1mol•-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
②已知25℃时,Ksp(AgCl)=1.8×10-10,则将AgCl加入蒸馏水中形成饱和溶液,溶液中的c(Ag+)约为
您最近一年使用:0次
【推荐3】已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ: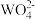 (aq)+Ca(OH)2(s)
(aq)+Ca(OH)2(s) CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)
(1)如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。

①计算T1时,Ksp(CaWO4)=________ 。
②T1________ T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表:
①该反应平衡常数K的表达式为________ 。
②该反应的ΔH________ 0(“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后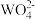 的沉淀率为60%,此时
的沉淀率为60%,此时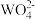 的平衡浓度为
的平衡浓度为________ mol·L-1,实验测得的平衡常数为________ (保留小数点后两位)。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是________ 。
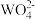 (aq)+Ca(OH)2(s)
(aq)+Ca(OH)2(s) CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)(1)如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。

①计算T1时,Ksp(CaWO4)=
②T1
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
①该反应平衡常数K的表达式为
②该反应的ΔH
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后
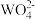 的沉淀率为60%,此时
的沉淀率为60%,此时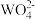 的平衡浓度为
的平衡浓度为(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求填空:
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈__ 性,溶液中c(Na+)__ c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈__ 性,溶液中c(Na+)___ c(CH3COO-)(填“>”“=”或“<”);
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为___ 。
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):____ ;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以___ (填“促进”、“抑制”)其水解。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有____ ,其浓度由大到小的顺序为_____ ,氨水的浓度a__ 0.01 mol·L-1(填“>”、“ <”或“=”)。
(5)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为____ 。
(6)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
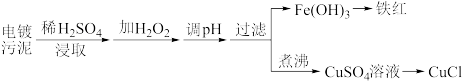
①酸浸后加入H2O2的目的是_____________ ,调pH的最适宜范围为_______ 。
②调pH过程中加入的试剂最好是_________ 。
A.NaOH B.CuO C.NH3·H2O D.Cu2(OH)2CO3
③煮沸CuSO4溶液的原因是_____ ;向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,反应的化学方程式________ 。
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有
(5)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为
(6)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
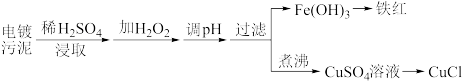
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
①酸浸后加入H2O2的目的是
②调pH过程中加入的试剂最好是
A.NaOH B.CuO C.NH3·H2O D.Cu2(OH)2CO3
③煮沸CuSO4溶液的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室制备颜料PbCrO4的实验步骤如下:
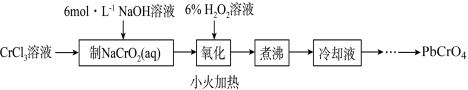
已知:① Cr(OH)3(两性氢氧化物)呈绿色且难溶于水;
② 均易溶于水,PbCrO4难溶于水,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7;
均易溶于水,PbCrO4难溶于水,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7;
③PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成;
④六价格在溶液中物种分布分数与pH关系如图所示。
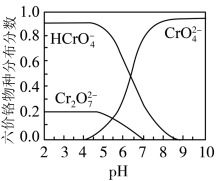
(1)制备 的离子方程式
的离子方程式_______ 。
(2)“氧化”后溶液中主要溶质是_______ 。
(3)用“冷却液”制备PbCrO4需要用到下列所有操作:
a.加热煮沸溶液
b.滴加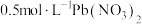 溶液至有大量沉淀产生
溶液至有大量沉淀产生
c.加入一滴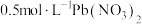 溶液搅拌片刻,有少量沉淀产生
溶液搅拌片刻,有少量沉淀产生
d.过滤、洗涤、干燥
e.静置后,向上层清液中继续滴入Pb(NO3)2溶液,若无沉淀生成,则说明滴加完全
f.在不断搅拌下,向“冷却液”中加入 的醋酸调节反应液pH值
的醋酸调节反应液pH值
请给出上述操作的正确排序:_______ 。
f→_______→_______→_______→_______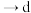 。
。
(4)关于本实验的操作下列说法不正确 的是_______。
(5)PbCrO4产品纯度测定方法如下(杂质不参与反应):
取 克产品加入水中,用醋酸酸化后,加入过量
克产品加入水中,用醋酸酸化后,加入过量 溶液充分反应。用
溶液充分反应。用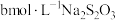 标准溶液滴定,在接近滴定终点时向反应液中加入少量淀粉溶液,滴至终点共消耗标准液cmL。已知:
标准溶液滴定,在接近滴定终点时向反应液中加入少量淀粉溶液,滴至终点共消耗标准液cmL。已知: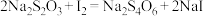 ,PbCrO4摩尔质量
,PbCrO4摩尔质量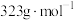 。
。
①在加入淀粉溶液前,判断已接近滴定终点的现象_______ 。
②产品中PbCrO4的纯度_______ %(用含a、b、c的质量百分数 最简式表示)

已知:① Cr(OH)3(两性氢氧化物)呈绿色且难溶于水;
②
 均易溶于水,PbCrO4难溶于水,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7;
均易溶于水,PbCrO4难溶于水,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7;③PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成;
④六价格在溶液中物种分布分数与pH关系如图所示。

(1)制备
 的离子方程式
的离子方程式(2)“氧化”后溶液中主要溶质是
(3)用“冷却液”制备PbCrO4需要用到下列所有操作:
a.加热煮沸溶液
b.滴加
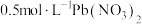 溶液至有大量沉淀产生
溶液至有大量沉淀产生c.加入一滴
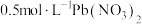 溶液搅拌片刻,有少量沉淀产生
溶液搅拌片刻,有少量沉淀产生d.过滤、洗涤、干燥
e.静置后,向上层清液中继续滴入Pb(NO3)2溶液,若无沉淀生成,则说明滴加完全
f.在不断搅拌下,向“冷却液”中加入
 的醋酸调节反应液pH值
的醋酸调节反应液pH值请给出上述操作的正确排序:
f→_______→_______→_______→_______
 。
。(4)关于本实验的操作下列说法
A.制备 的具体操作为:不断搅拌下加入 的具体操作为:不断搅拌下加入 溶液,至产生的绿色沉淀完全溶解 溶液,至产生的绿色沉淀完全溶解 |
| B.氧化后“煮沸”的目的是将过量的H2O2除尽,防止降低PbCrO4产率 |
C.用“冷却液”制备PbCrO4时,加入 的醋酸使反应液呈强酸性条件最佳 的醋酸使反应液呈强酸性条件最佳 |
| D.洗涤沉淀操作时,遵循“少量多次”的原则,洗后尽量沥干,可以提高洗涤效率 |
(5)PbCrO4产品纯度测定方法如下(杂质不参与反应):
取
 克产品加入水中,用醋酸酸化后,加入过量
克产品加入水中,用醋酸酸化后,加入过量 溶液充分反应。用
溶液充分反应。用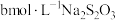 标准溶液滴定,在接近滴定终点时向反应液中加入少量淀粉溶液,滴至终点共消耗标准液cmL。已知:
标准溶液滴定,在接近滴定终点时向反应液中加入少量淀粉溶液,滴至终点共消耗标准液cmL。已知: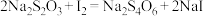 ,PbCrO4摩尔质量
,PbCrO4摩尔质量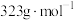 。
。①在加入淀粉溶液前,判断已接近滴定终点的现象
②产品中PbCrO4的纯度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用下图所示装置制备干燥纯净的氯气,请回答下列问题。
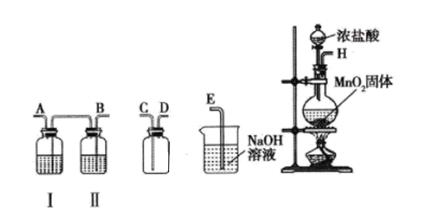
(1)I中所盛试剂为________ (填序号,下同),II中所盛试剂为________ 。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→____ 、____ 、→____ 、____ →____ ;选择最后一个装置的目的是___________________ 。
(3)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:____ 。
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定含有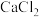 ,请设计实验探究该样品中可能存在的其他物质。
,请设计实验探究该样品中可能存在的其他物质。
I.提出合理假设。
假设1:该漂白粉未变质,含有_______________________ ;
假设2:该漂白粉全部变质,含有_________________________ ;
假设3:该漂白粉部分变质,既含有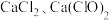 ,又含有
,又含有 。
。

(1)I中所盛试剂为
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→
(3)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定含有
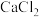 ,请设计实验探究该样品中可能存在的其他物质。
,请设计实验探究该样品中可能存在的其他物质。I.提出合理假设。
假设1:该漂白粉未变质,含有
假设2:该漂白粉全部变质,含有
假设3:该漂白粉部分变质,既含有
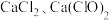 ,又含有
,又含有 。
。
您最近一年使用:0次



